Содержание
- 2. План лекции: Человек как объект генетики. Плюсы и минусы. Генеалогический метод. Традиционные и нетрадиционные типы наследования.
- 3. Особенности человека как объекта генетики. Что создает трудности: Нельзя скрещивать по желанию экспериментатора. Число потомков невелико
- 4. Основные методы изучения генетики человека. Цитогенетический (см. лекцию о хромосомах.) Близнецовый (см. лекцию о фенотипе) Биохимический
- 5. Краткое напоминание задач близнецового и цитогенетического методов
- 6. Близнецовый метод изучает соотносительную роль генотипа и среды в развитии признака Н = КМБ(в%%) – КДБ(в
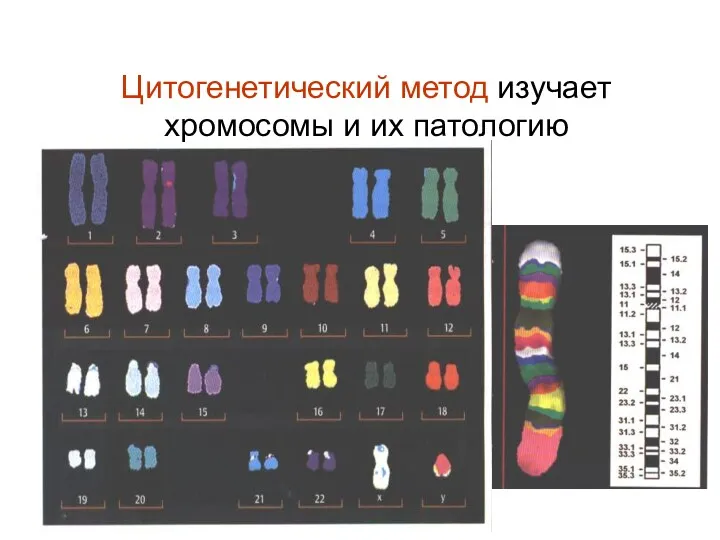
- 7. Цитогенетический метод изучает хромосомы и их патологию
- 8. Генеалогический метод – метод анализа родословных
- 9. Генеалогический метод Был предложен в 1883 г. Ф. Гальтоном. Метод позволяет установить: 1) является ли данный
- 10. Сэр Фрэнсис Гальтон (Francis Galton) Кузен Ч.Дарвина Занимался вопросами наследственности,, биометрией, дерматоглификой, статистикой и тестированием; первым
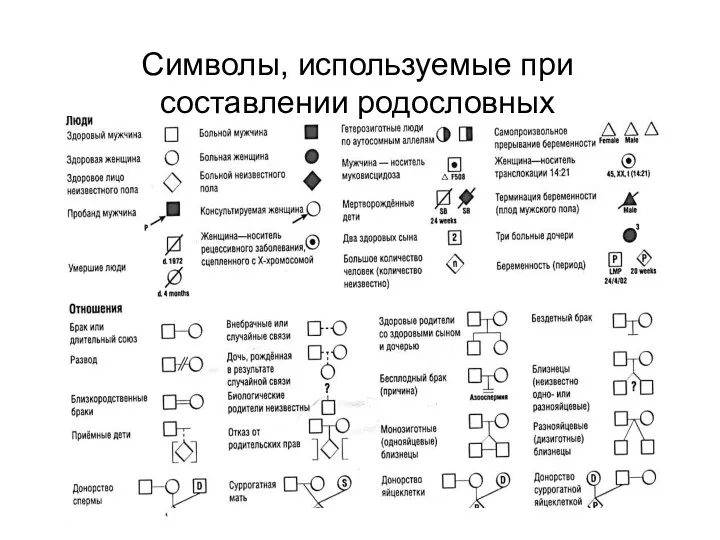
- 11. Символы, используемые при составлении родословных
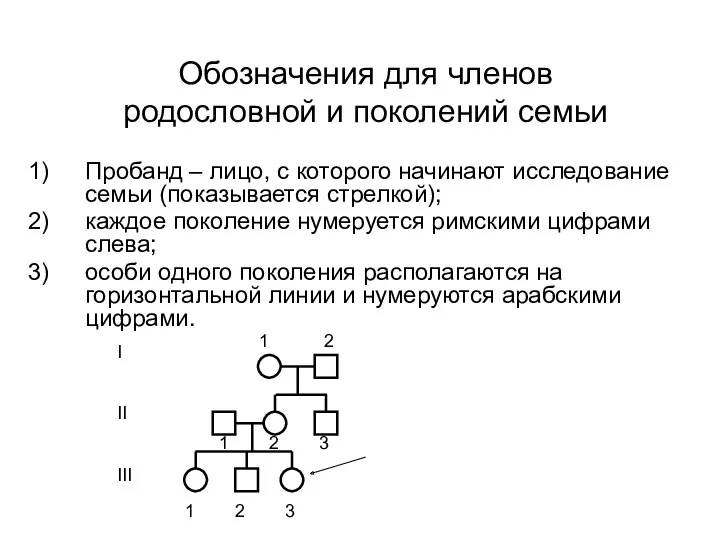
- 12. Обозначения для членов родословной и поколений семьи Пробанд – лицо, с которого начинают исследование семьи (показывается
- 13. Различают 5 основных типов моногенного наследования AD (аутосомно-доминантный) AR (аутосомно-рецессивный) XD (Х-сцепленный доминантный) XR (Х-сцепленный рецессивный)
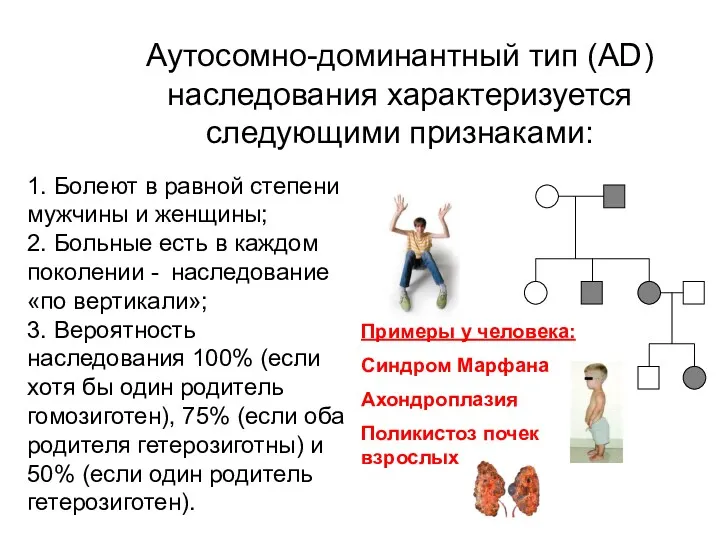
- 14. Аутосомно-доминантный тип (AD) наследования характеризуется следующими признаками: 1. Болеют в равной степени мужчины и женщины; 2.
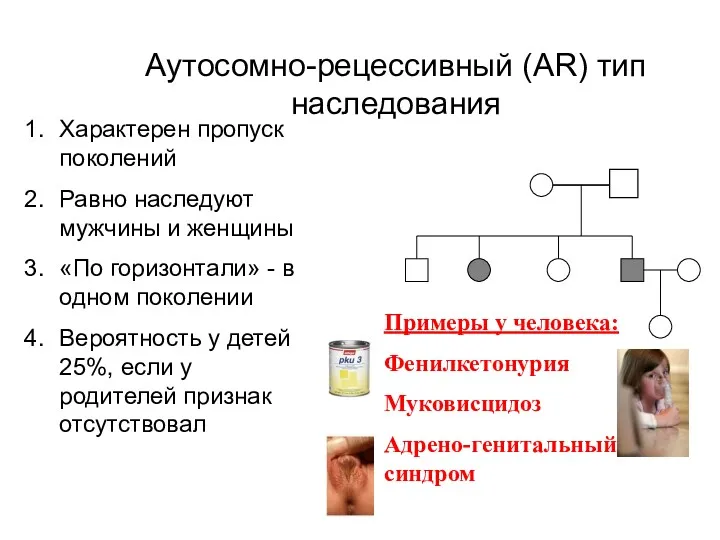
- 15. Аутосомно-рецессивный (AR) тип наследования Характерен пропуск поколений Равно наследуют мужчины и женщины «По горизонтали» - в
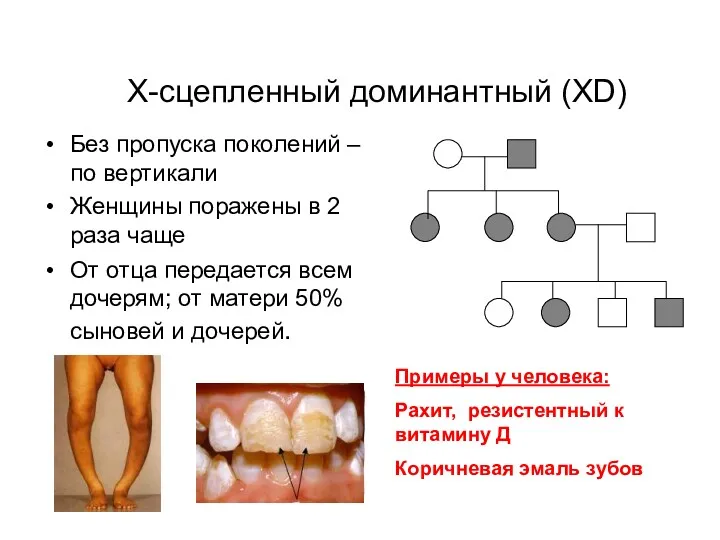
- 16. Х-сцепленный доминантный (XD) Без пропуска поколений – по вертикали Женщины поражены в 2 раза чаще От
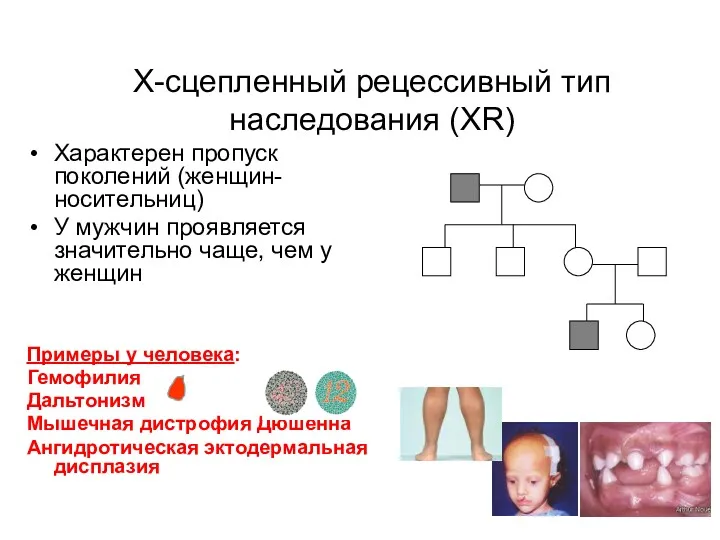
- 17. Х-сцепленный рецессивный тип наследования (XR) Характерен пропуск поколений (женщин-носительниц) У мужчин проявляется значительно чаще, чем у
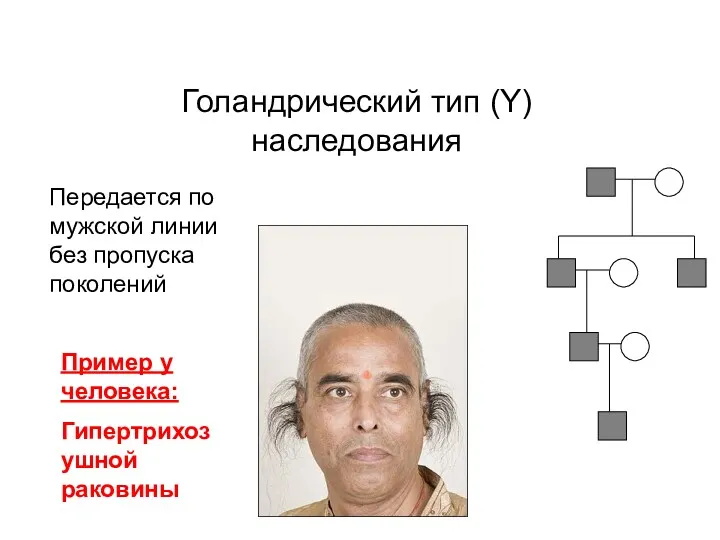
- 18. Голандрический тип (Y) наследования Передается по мужской линии без пропуска поколений Пример у человека: Гипертрихоз ушной
- 19. Нетрадиционные типы наследования. Цитоплазматическое наследование. Геномный импринтинг. Феномен антиципации (Болезни экспансии нуклеотидных повторов).
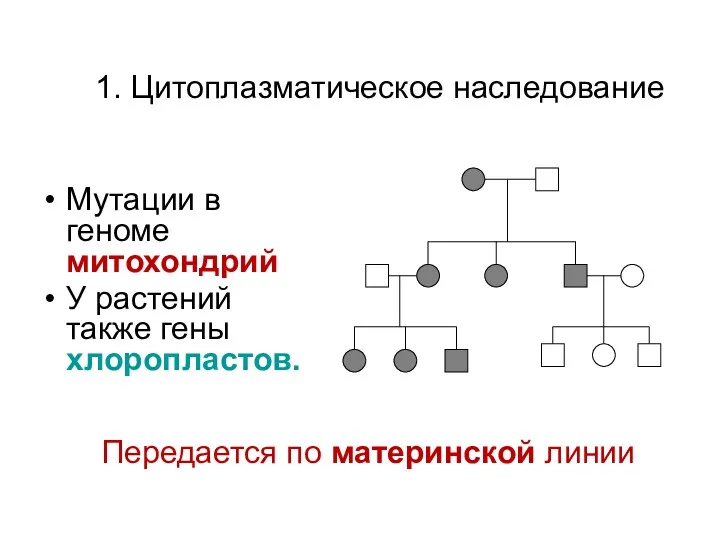
- 20. 1. Цитоплазматическое наследование Мутации в геноме митохондрий У растений также гены хлоропластов. Передается по материнской линии
- 21. Пестролистность – пример цитоплазматического наследования у растений
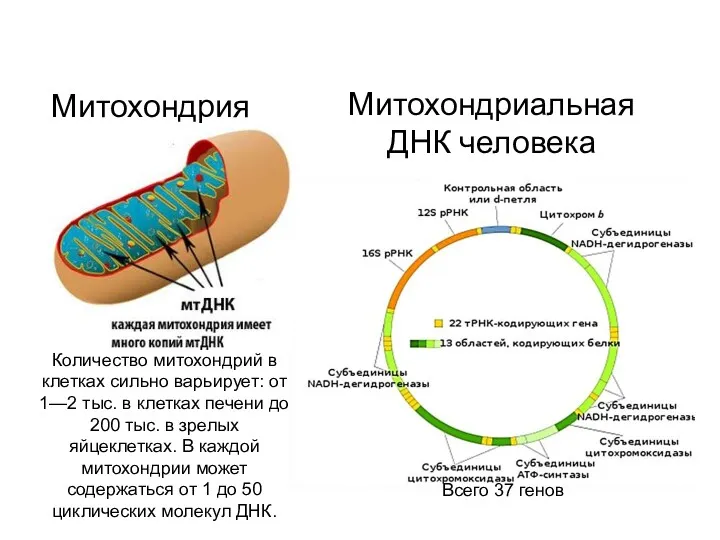
- 22. Количество митохондрий в клетках сильно варьирует: от 1—2 тыс. в клетках печени до 200 тыс. в
- 23. Митохондриальные болезни у человека пример: митохондриальная миопатия Помимо относительно распространённой митохондриальной миопатии, встречаются: митохондриальный сахарный диабет,
- 24. Появился на свет первый в мире ребенок с генетическим материалом трех родителей. Операцию по искусственному оплодотворению
- 25. 2. Геномный импринтинг Геномный импринтинг (т.е. запечатление) это особый вид регуляции активности генов. Аллель экспрессируется в
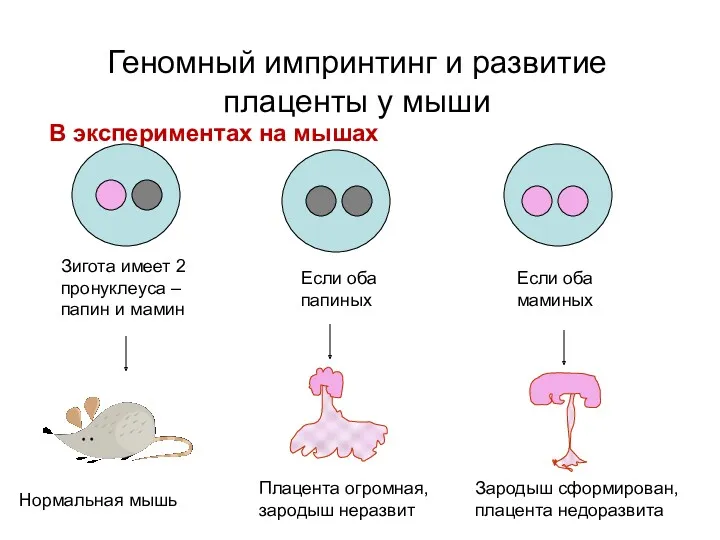
- 26. Геномный импринтинг и развитие плаценты у мыши В экспериментах на мышах Зигота имеет 2 пронуклеуса –
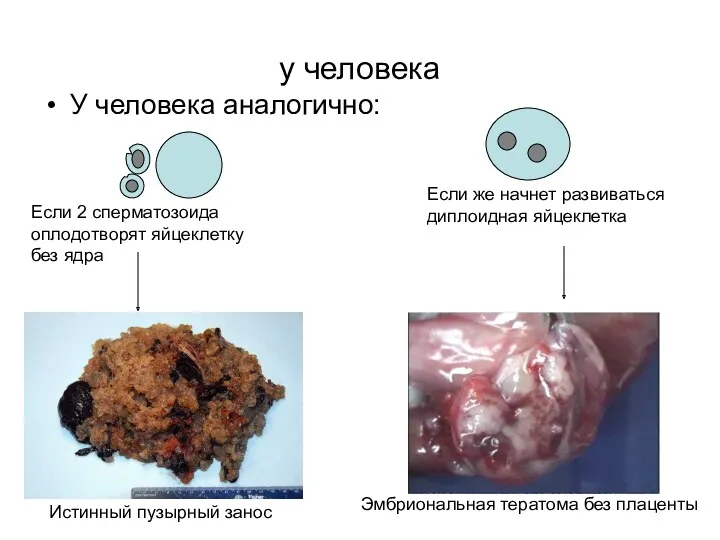
- 27. у человека У человека аналогично: Если 2 сперматозоида оплодотворят яйцеклетку без ядра Истинный пузырный занос Если
- 28. «Война полов» - причина импринтинга? Отцовские хромосомы запускают развитие плаценты и тем самым обеспечивают максимальное питание
- 29. Интенсивность импринтинга варьирует от ткани к ткани У мыши найдено около 100 импринтинговых генов. У человека
- 30. Синдромы Прадера-Вилли и Ангельмана Если происходит делеция определенного района 15 хромосомы (q11.2-q13) или возникает однородительская дисомия,
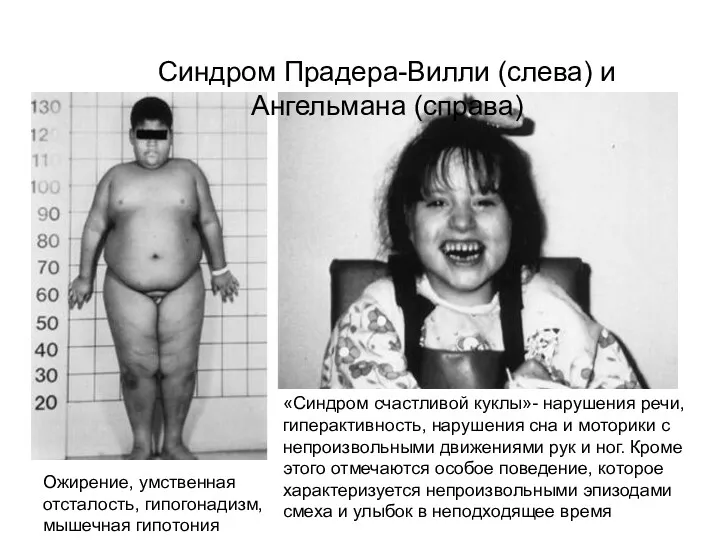
- 31. Синдром Прадера-Вилли (слева) и Ангельмана (справа) Ожирение, умственная отсталость, гипогонадизм, мышечная гипотония «Синдром счастливой куклы»- нарушения
- 32. Возникновение однородительской дисомии (в данном случае – от отца) Нерасхождение в анафазе 1 мейоза Нерасхождение в
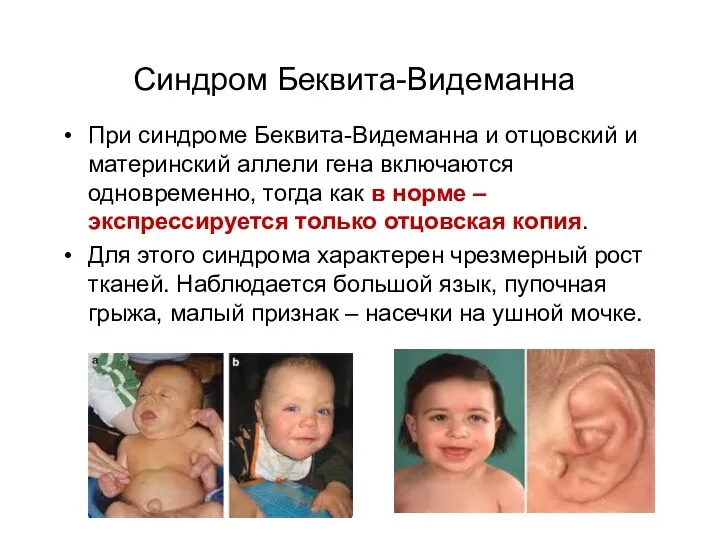
- 33. Синдром Беквита-Видеманна При синдроме Беквита-Видеманна и отцовский и материнский аллели гена включаются одновременно, тогда как в
- 34. 3. Болезни экспансии тринуклеотидных повторов Особый вид генных мутаций, открытый в 1991 году, для которого характерно:
- 35. Экспансия нуклеотидных повторов В кодирующей части гена – всегда повтор трех нуклеотидов, иначе – сдвиг рамки
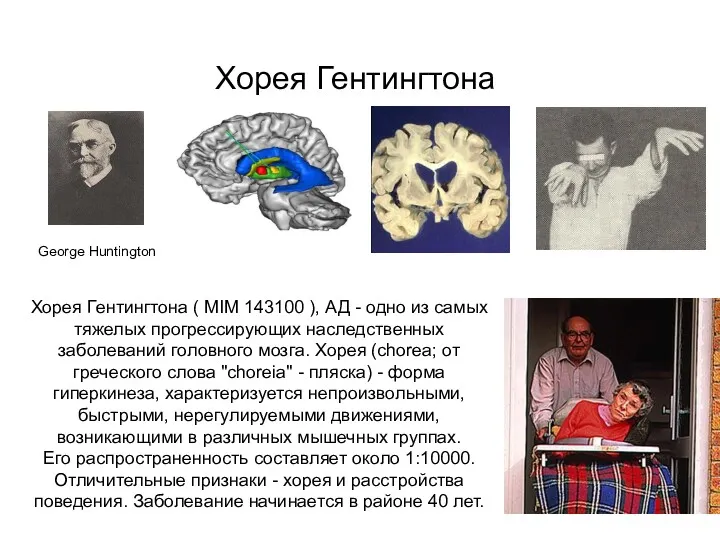
- 36. Хорея Гентингтона George Huntington Хорея Гентингтона ( MIM 143100 ), АД - одно из самых тяжелых
- 37. Синдром Мартина – Белл (синдром ломкой Х-хромосомы) Впервые в 1934 г. J. Martin и J. Bell
- 38. Синдром Мартина -Белл Признаки: большая голова с высоким и широким лбом, длинное лицо с увеличенным подбородком
- 39. Дерматоглифический метод (тоже предложен Гальтоном) Метод помогает в диагностике наследственных синдромов Не путать с генной дактилоскопией!
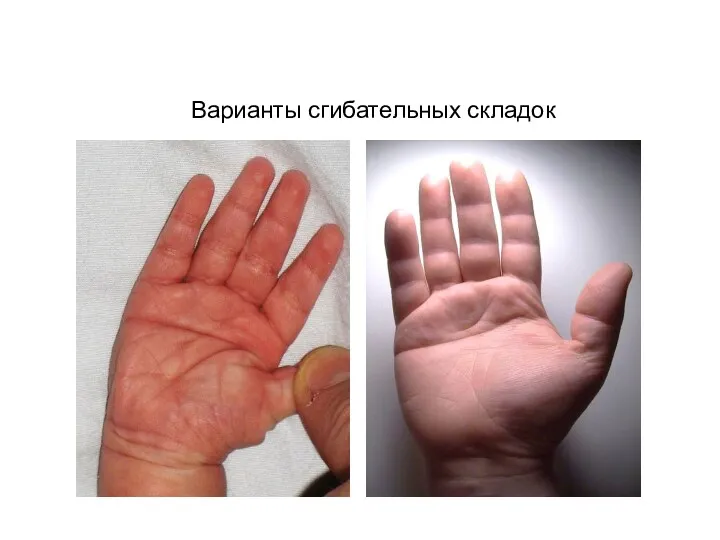
- 40. Дерматоглифический метод Изучает особенности гребешковой кожи и основные сгибательные линии ладоней и подошв
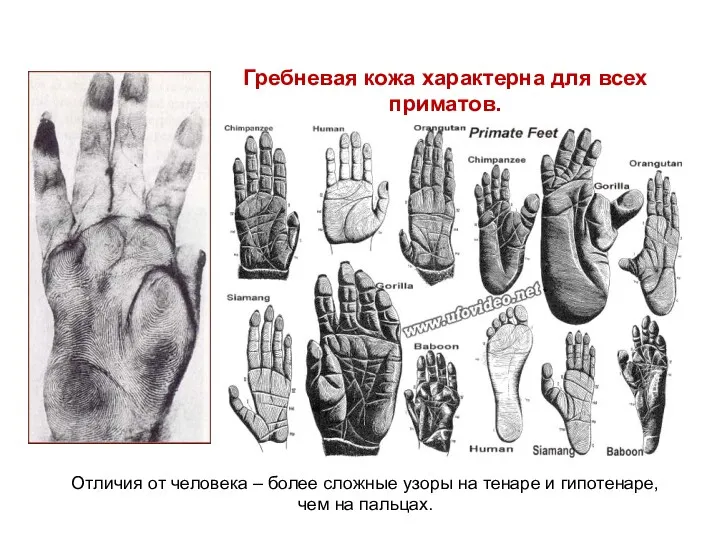
- 41. Гребневая кожа характерна для всех приматов. Отличия от человека – более сложные узоры на тенаре и
- 42. Три основных вида пальцевых узоров дуга петля завиток Дактилоскопия – область криминалистики - также изучает отпечатки
- 43. Варианты сгибательных складок
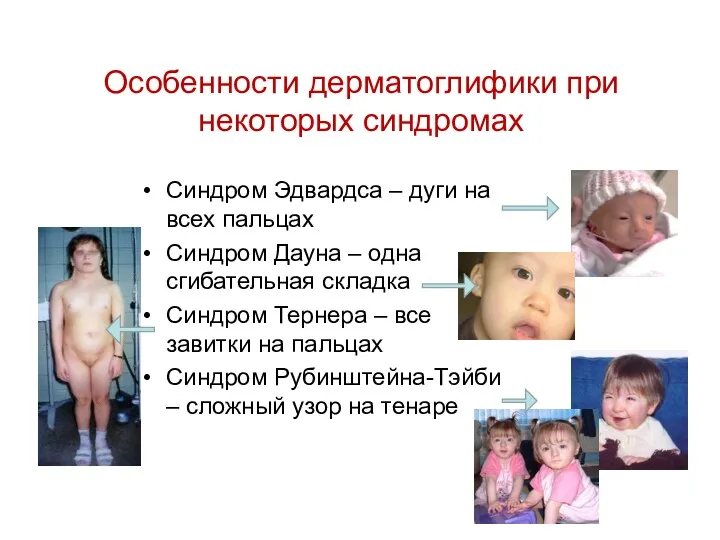
- 44. Особенности дерматоглифики при некоторых синдромах Синдром Эдвардса – дуги на всех пальцах Синдром Дауна – одна
- 45. Биохимический метод Используется для изучения ферментопатий – мутаций, нарушающих работу ферментов. В крови и моче больных
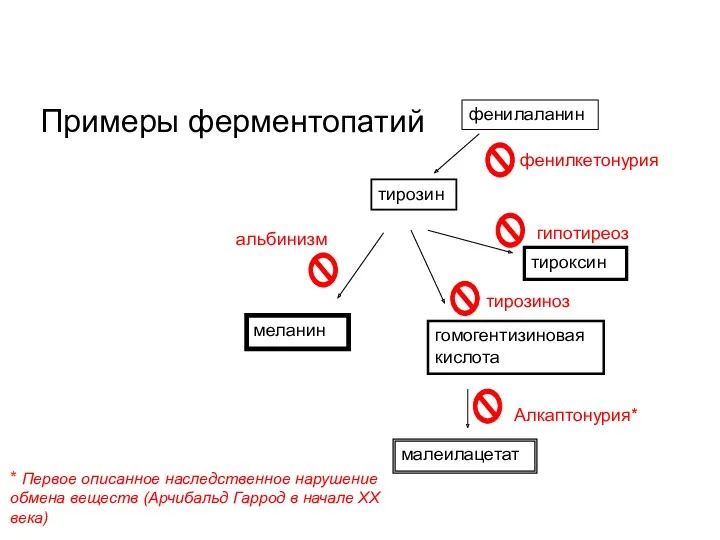
- 46. Примеры ферментопатий фенилаланин тирозин меланин гомогентизиновая кислота малеилацетат фенилкетонурия альбинизм тирозиноз тироксин гипотиреоз Алкаптонурия* * Первое
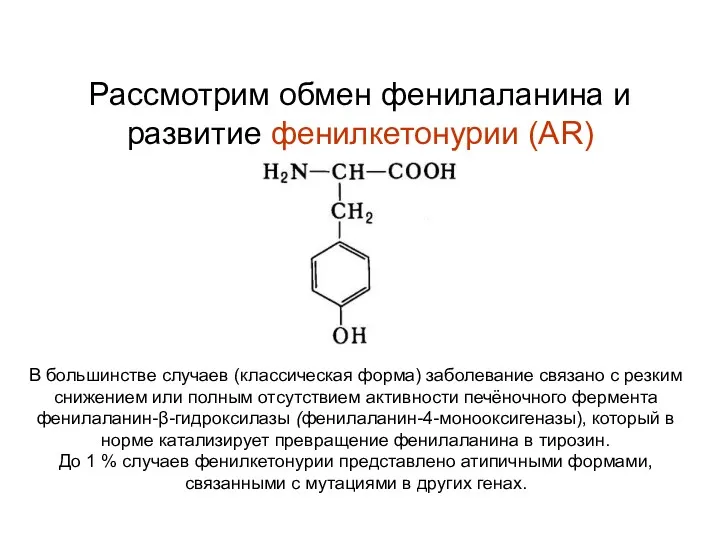
- 47. Рассмотрим обмен фенилаланина и развитие фенилкетонурии (АR) В большинстве случаев (классическая форма) заболевание связано с резким
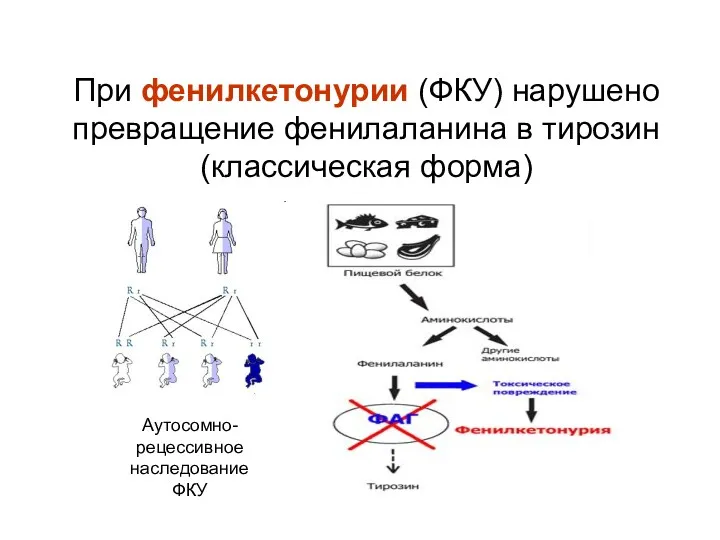
- 48. При фенилкетонурии (ФКУ) нарушено превращение фенилаланина в тирозин (классическая форма) Аутосомно-рецессивное наследование ФКУ
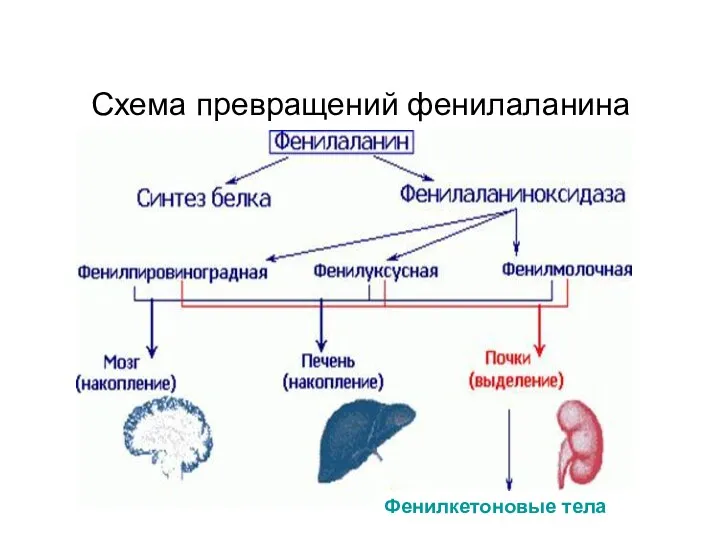
- 49. Фенилкетоновые тела Схема превращений фенилаланина
- 50. Распространенность ФКУ В исследовании 1987 года в Словакии среди отдельных цыганских популяций были обнаружены сверхвысокие уровни
- 51. Дети с рождения должны соблюдать диету с ограничением по фенилаланину
- 52. Ферментопатии выявляют при помощи неонатального скрининга Неонатальный скрининг – «просеивание» всех младенцев на наличие биохимических дефекты
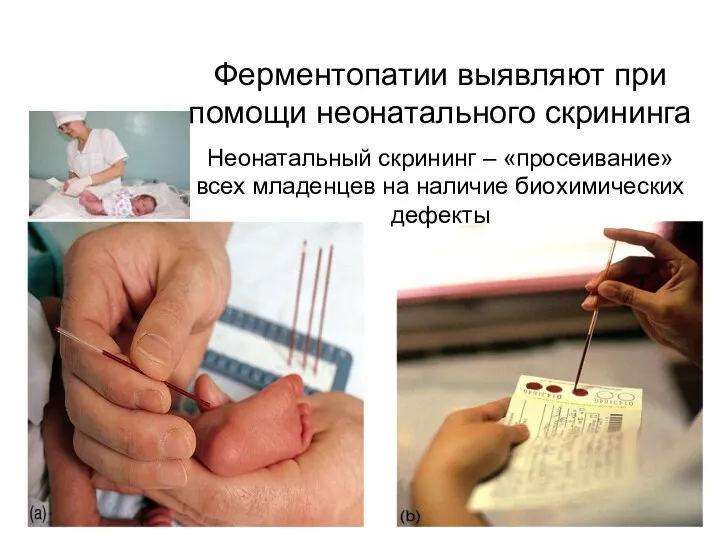
- 53. В настоящее время детей тестируют на фенилкетонурии, муковисцидоза, врожденного гипотиреоза, адреногенитального синдрома и галактоземии При выборе
- 54. Популяционно-статистический метод генетики Изучает и сравнивает популяции людей. Основан на законе Харди-Вайнберга
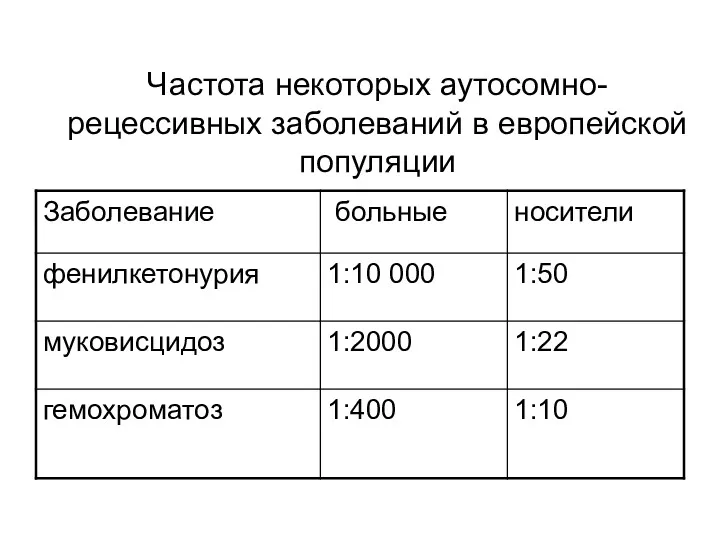
- 55. Частота некоторых аутосомно- рецессивных заболеваний в европейской популяции
- 56. Популяции отличаются по частоте встречаемости генных мутаций Наследственные болезни, характерные для этнических групп
- 57. Закон генетической стабильности популяций Сформулирован в 1908 году независимо английским математиком Г. Харди и немецким врачом
- 58. Отклонения от равновесия Харди-Вайнберга свидетельствует о действии на популяцию эволюционных факторов: естественного отбора мутаций дрейфа генов
- 59. Генетика соматических клеток и составление хромосомных карт
- 60. Основные методы составления генетических (хромосомных) карт На основе скрещиваний - не у человека! (гибридологический метод) -
- 61. Расстояние генов В и V – 17 морганид Опыты Моргана по сцеплению у дрозофилы.
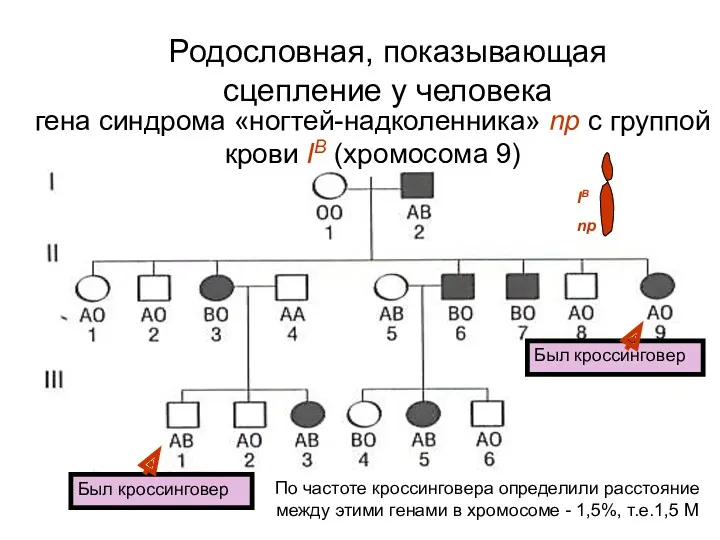
- 62. Родословная, показывающая сцепление у человека Был кроссинговер Был кроссинговер По частоте кроссинговера определили расстояние между этими
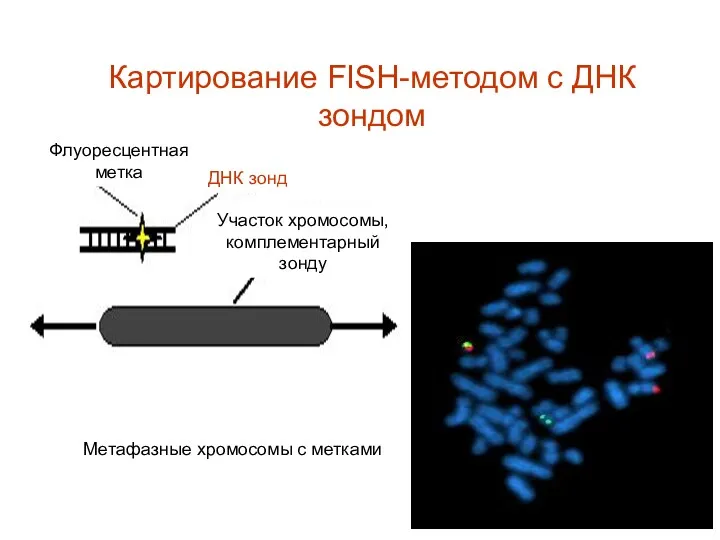
- 63. Флуоресцентная метка Участок хромосомы, комплементарный зонду Метафазные хромосомы с метками Картирование FISH-методом с ДНК зондом ДНК
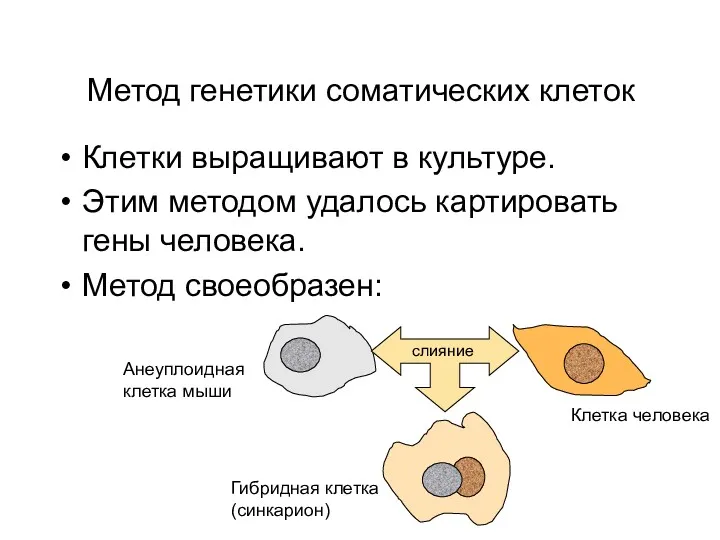
- 64. Метод генетики соматических клеток Клетки выращивают в культуре. Этим методом удалось картировать гены человека. Метод своеобразен:
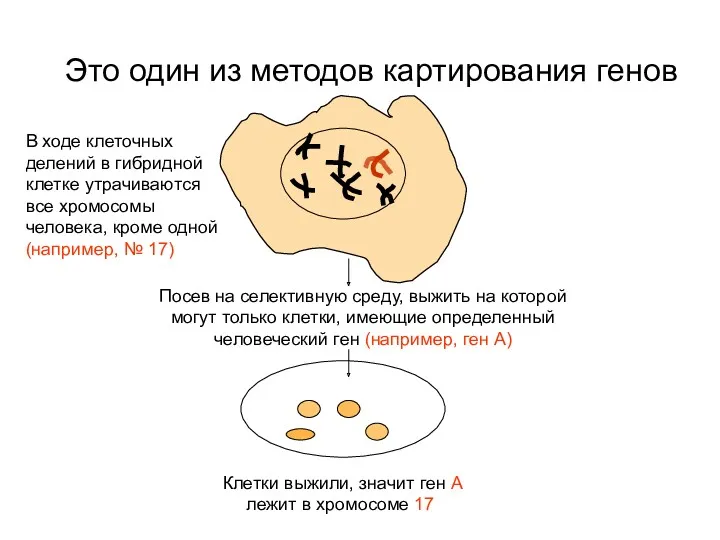
- 65. В ходе клеточных делений в гибридной клетке утрачиваются все хромосомы человека, кроме одной (например, № 17)
- 66. Методы работы с ДНК
- 67. Некоторые термины, описывающие методы анализа ДНК ДНК-зонд - фрагмент ДНК, меченный тем или иным образом и
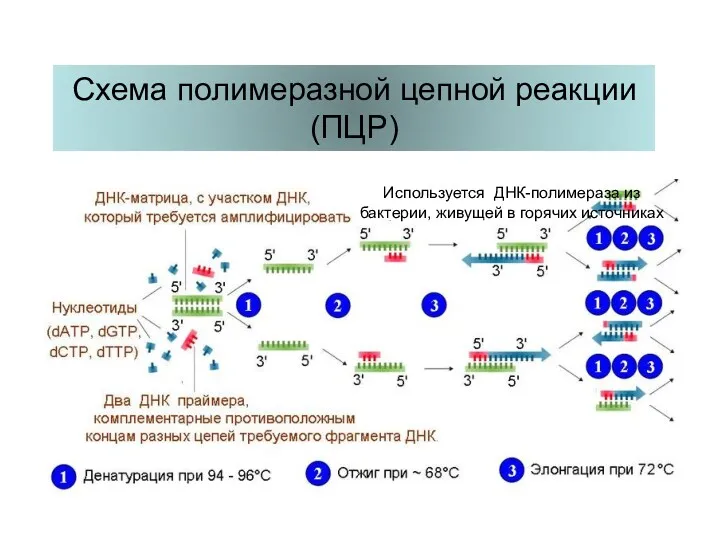
- 68. Схема полимеразной цепной реакции (ПЦР) Используется ДНК-полимераза из бактерии, живущей в горячих источниках
- 69. Аппарат для проведения ПЦР Один цикл ПЦР длится 3 – 5 минут, число циклов обычно 23
- 70. Рестрикционный анализ ДНК
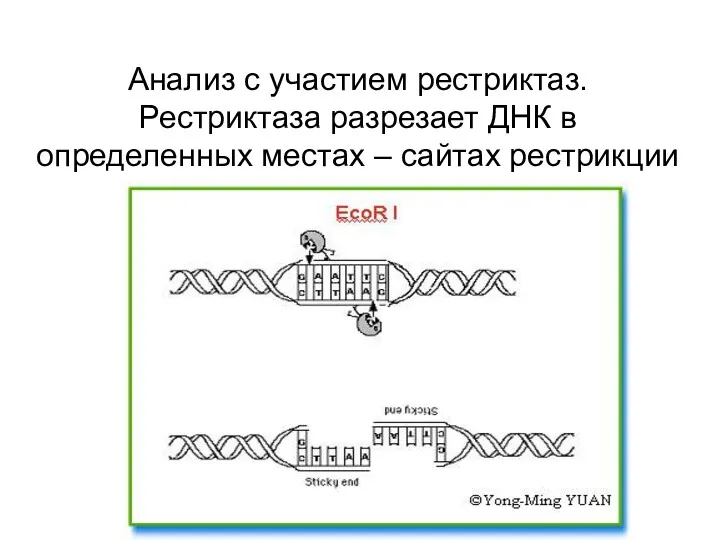
- 71. Анализ с участием рестриктаз. Рестриктаза разрезает ДНК в определенных местах – сайтах рестрикции
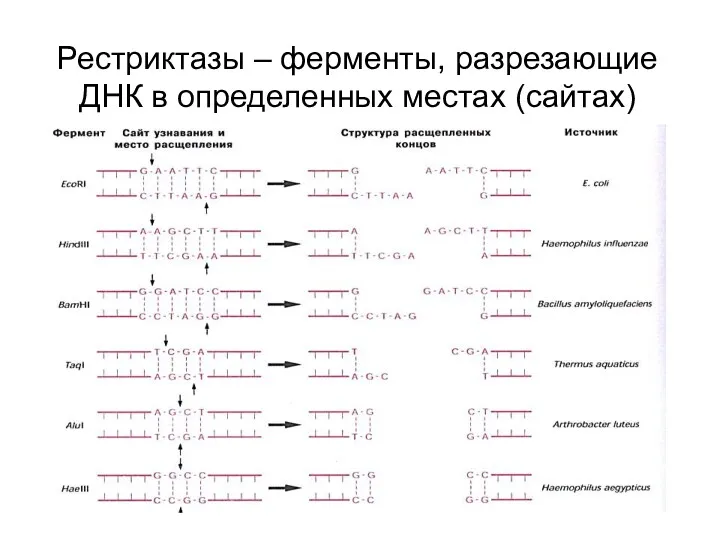
- 72. Рестриктазы – ферменты, разрезающие ДНК в определенных местах (сайтах)
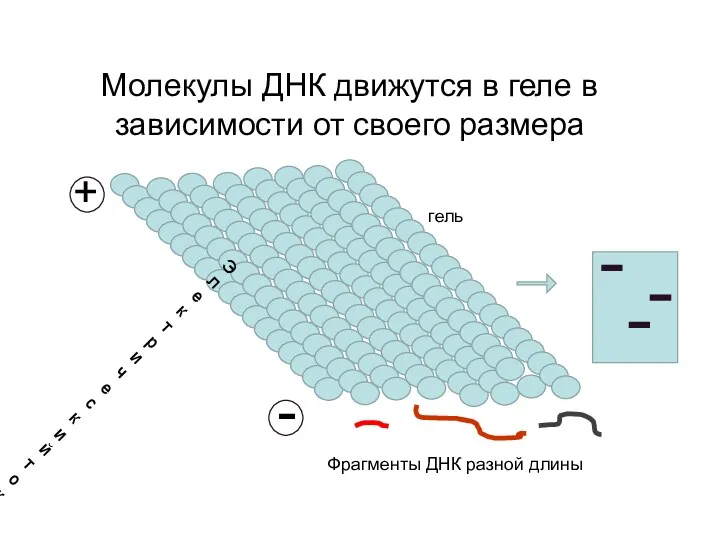
- 73. Молекулы ДНК движутся в геле в зависимости от своего размера гель Электрический ток + - Фрагменты
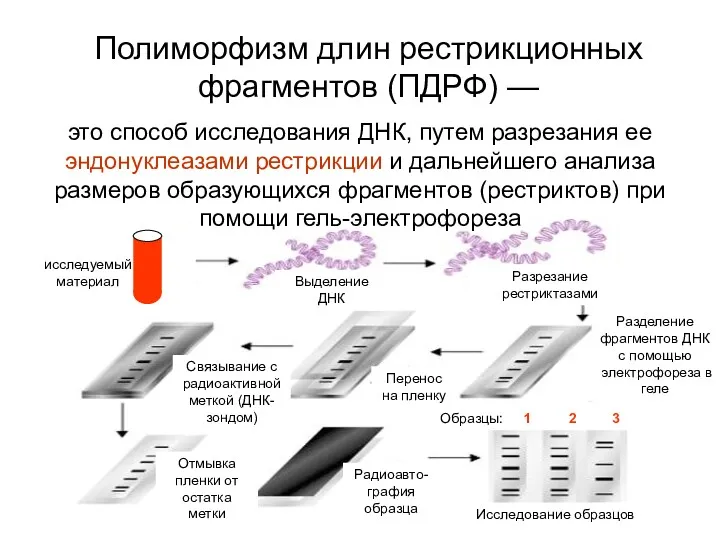
- 74. Полиморфизм длин рестрикционных фрагментов (ПДРФ) — исследуемый материал Выделение ДНК Разрезание рестриктазами Разделение фрагментов ДНК с
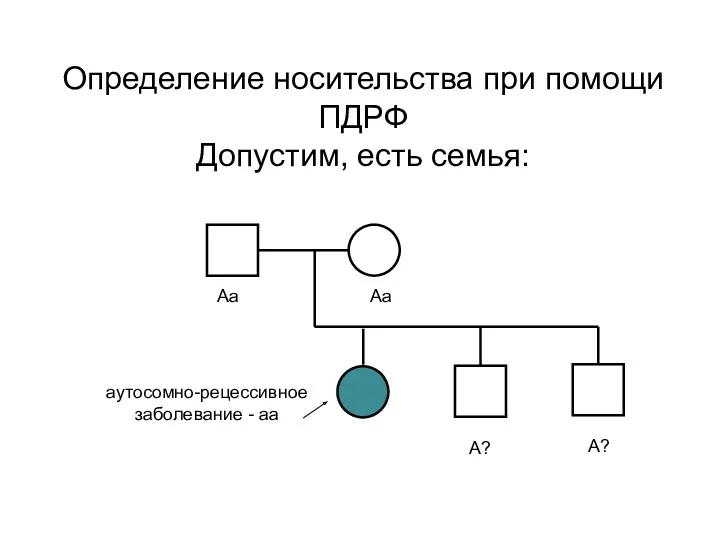
- 75. Определение носительства при помощи ПДРФ Допустим, есть семья: аутосомно-рецессивное заболевание - аа Аа Аа А? А?
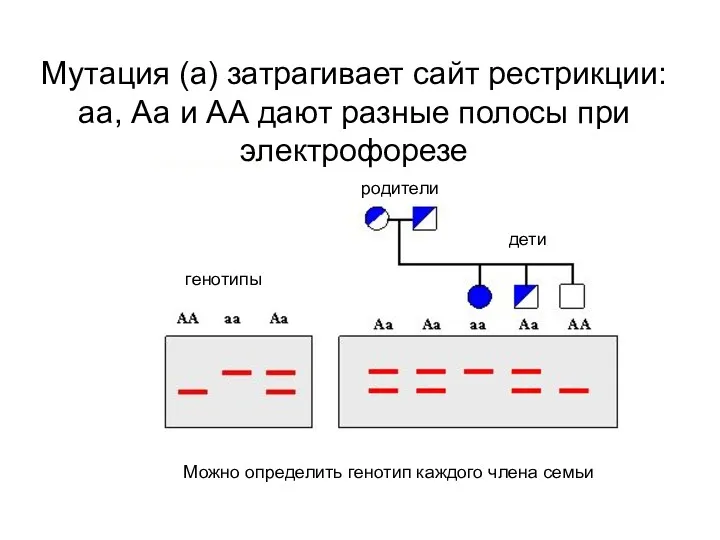
- 76. родители дети генотипы Можно определить генотип каждого члена семьи Мутация (а) затрагивает сайт рестрикции: аа, Аа
- 77. Генная дактилоскопия = ДНК профилирование
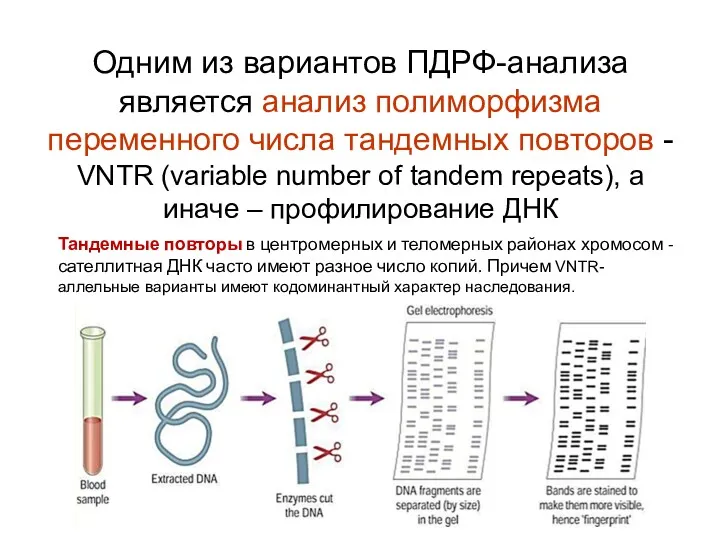
- 78. Одним из вариантов ПДРФ-анализа является анализ полиморфизма переменного числа тандемных повторов - VNTR (variable number of
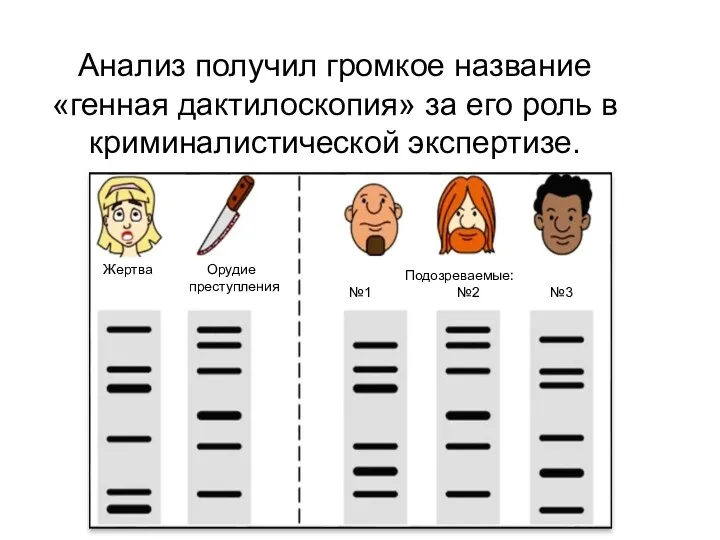
- 79. Анализ получил громкое название «генная дактилоскопия» за его роль в криминалистической экспертизе. Жертва Орудие преступления Подозреваемые:
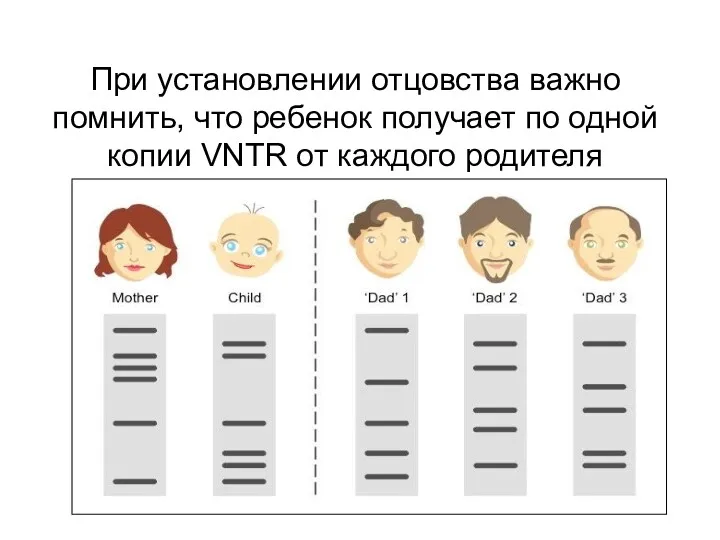
- 80. При установлении отцовства важно помнить, что ребенок получает по одной копии VNTR от каждого родителя
- 81. Секвенирование ДНК
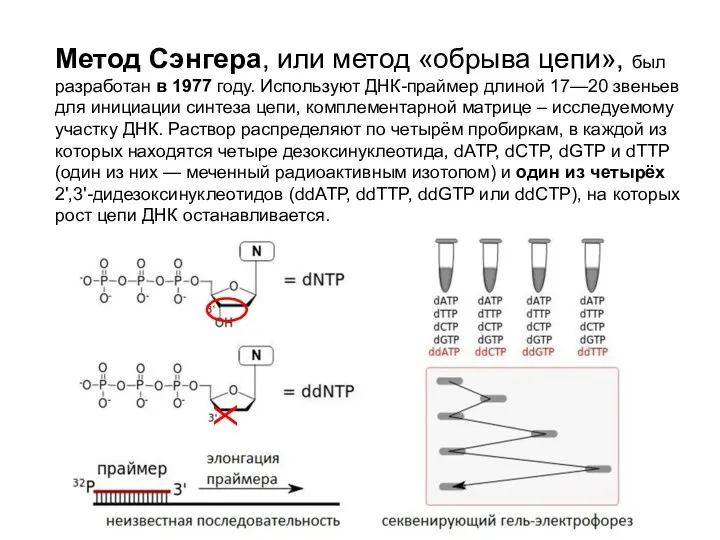
- 82. Метод Сэнгера, или метод «обрыва цепи», был разработан в 1977 году. Используют ДНК-праймер длиной 17—20 звеньев
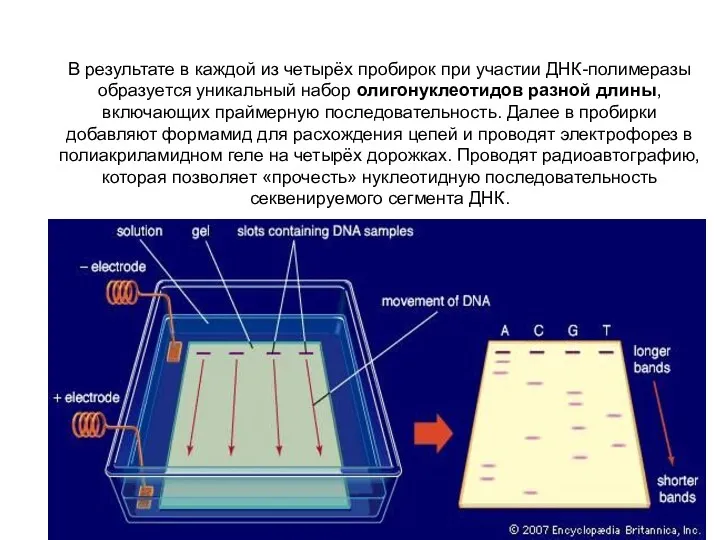
- 83. В результате в каждой из четырёх пробирок при участии ДНК-полимеразы образуется уникальный набор олигонуклеотидов разной длины,
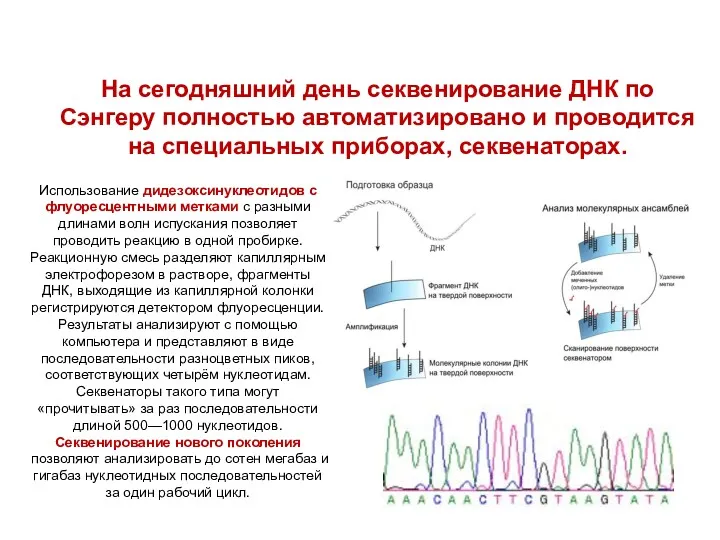
- 84. На сегодняшний день секвенирование ДНК по Сэнгеру полностью автоматизировано и проводится на специальных приборах, секвенаторах. Использование
- 85. Секвенирование генома – определение нуклеотидных последовательностей всей ДНК
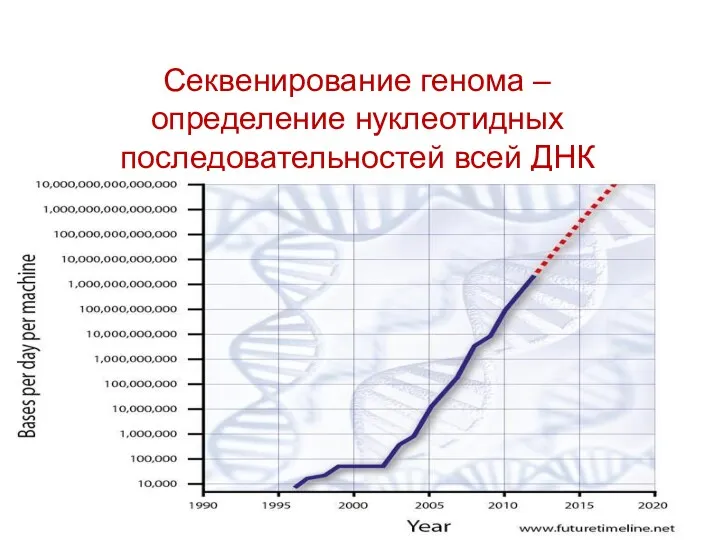
- 86. На конференции BioGenomics2017 объявили о новом масштабном проекте. Смитсоновская инициатива по геномике биоразнообразия и китайская компания
- 87. ДНК-диагностика наследственных болезней - наиболее адекватная и точная диагностика В OMIM описано около 5 тысяч фенотипов
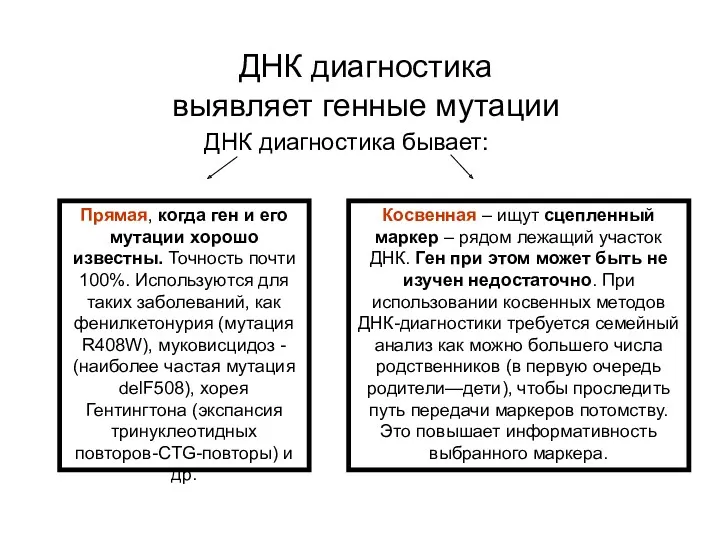
- 88. ДНК диагностика выявляет генные мутации ДНК диагностика бывает: Прямая, когда ген и его мутации хорошо известны.
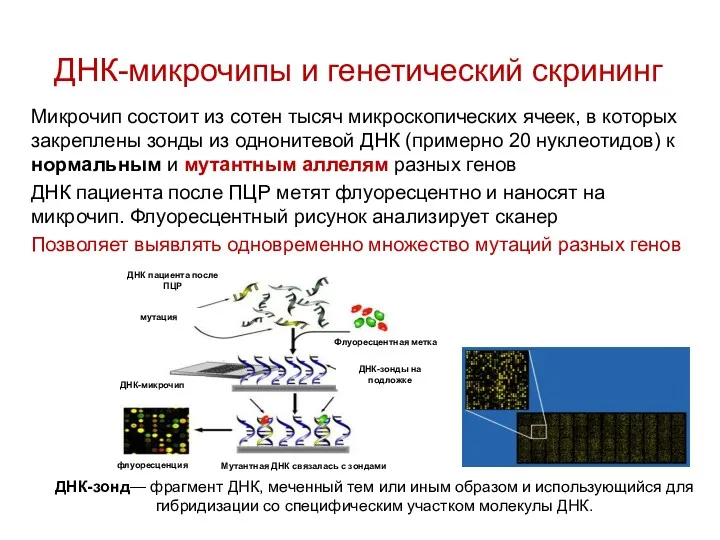
- 89. ДНК-микрочипы и генетический скрининг Микрочип состоит из сотен тысяч микроскопических ячеек, в которых закреплены зонды из
- 90. Перспективы http://www.humanvariomeproject.org/ http://www.hgvs.org/ В 2011 году, стартовал проект «Вариом человека», который ставит задачей изучение генетического разнообразия
- 92. Скачать презентацию













































 Доказательства эволюции
Доказательства эволюции Урок-презентация по теме :Бабочки.
Урок-презентация по теме :Бабочки. Севообороты. Основные понятия и определения
Севообороты. Основные понятия и определения Обмен углеводов в организме человека
Обмен углеводов в организме человека Адаптация организмов к условиям обитания как результат действия естественного отбора
Адаптация организмов к условиям обитания как результат действия естественного отбора Цветок. Его строение и значение
Цветок. Его строение и значение Механизмы регуляции эмбриогенеза
Механизмы регуляции эмбриогенеза Паразитология. Разделы паразитологии
Паразитология. Разделы паразитологии Биоэнергетика. Биологическое окисление
Биоэнергетика. Биологическое окисление Стебель – часть побега. Клеточное строение стебля
Стебель – часть побега. Клеточное строение стебля Ткани и органы растений
Ткани и органы растений Основы цитологии. Клетка. Строение и жизненный цикл клетки
Основы цитологии. Клетка. Строение и жизненный цикл клетки Тип хордовые (chordata)
Тип хордовые (chordata) Биохимия печени
Биохимия печени Своя игра на тему Самое необыкновенное вещество в мире - обыкновенная вода
Своя игра на тему Самое необыкновенное вещество в мире - обыкновенная вода Дыхательная система
Дыхательная система Предмет и содержание биостатистики
Предмет и содержание биостатистики Функціональні блоки мозку
Функціональні блоки мозку Система растений и животных — отображение эволюции
Система растений и животных — отображение эволюции Общая характеристика обмена веществ и превращения энергии в организме
Общая характеристика обмена веществ и превращения энергии в организме Плоды. Разнообразие и значение
Плоды. Разнообразие и значение Ферменты: структура, свойства, классификация
Ферменты: структура, свойства, классификация Қос мекенділердің орталық нерв жүйесі мен ішкі қанқасы
Қос мекенділердің орталық нерв жүйесі мен ішкі қанқасы Метаболизм и основы биоэнергетики
Метаболизм и основы биоэнергетики Как зимуют в лесу звери
Как зимуют в лесу звери Высшие растения. Споровые и голосеменные
Высшие растения. Споровые и голосеменные Популяционная структура вида
Популяционная структура вида Скелет человека
Скелет человека