Содержание
- 2. Плазміди бактерій – факультативний елемент геному Це позахромосомні кільцеві або лінійні молекули ДНК, що здатні до
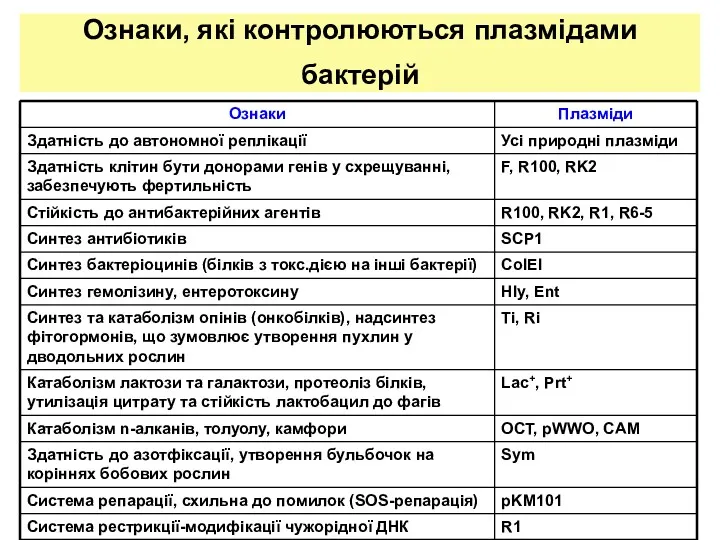
- 3. Ознаки, які контролюються плазмідами бактерій
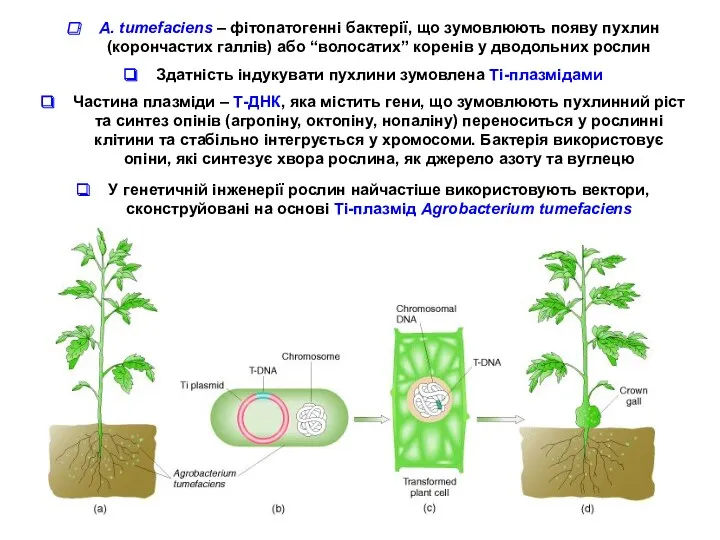
- 4. А. tumefaciens – фітопатогенні бактерії, що зумовлюють появу пухлин (корончастих галлів) або “волосатих” коренів у дводольних
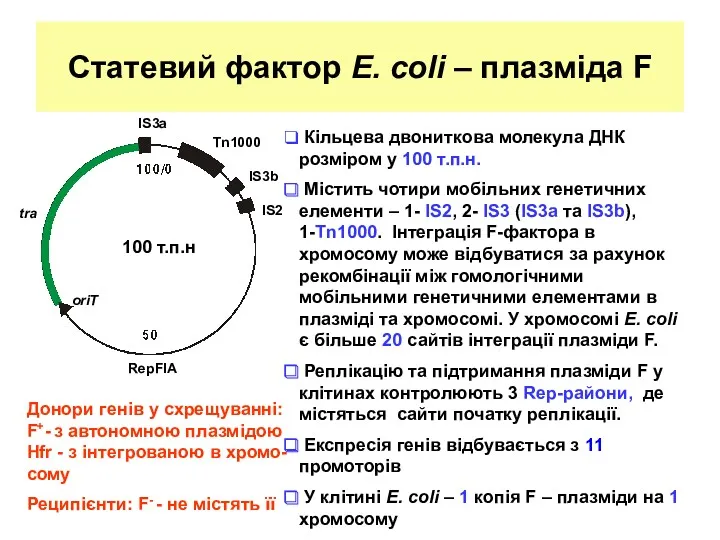
- 5. Статевий фактор Е. coli – плазміда F tra IS3a Кільцева двониткова молекула ДНК розміром у 100
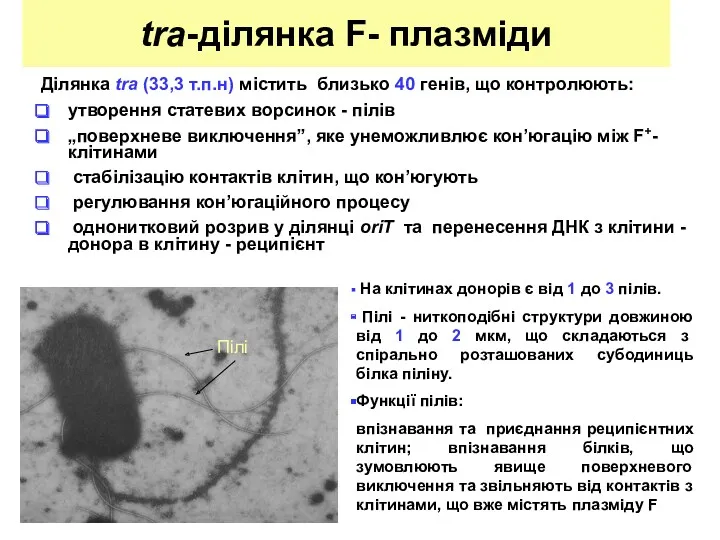
- 6. tra-ділянка F- плазміди Ділянка tra (33,3 т.п.н) містить близько 40 генів, що контролюють: утворення статевих ворсинок
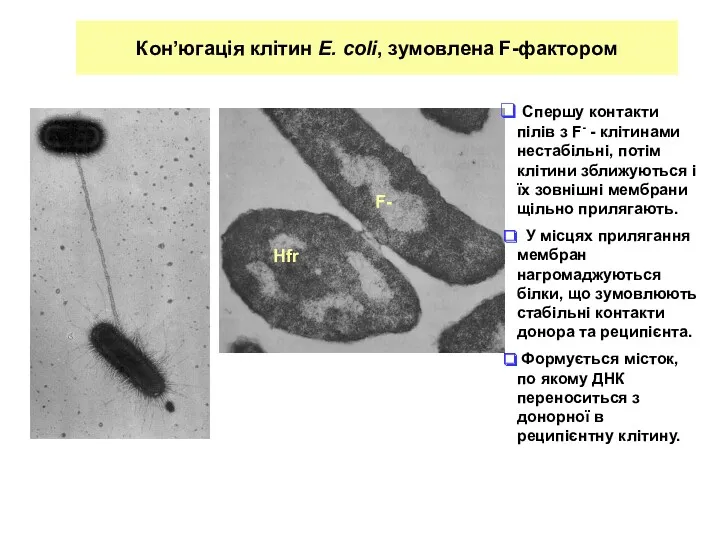
- 7. Кон’югація клітин E. coli, зумовлена F-фактором Спершу контакти пілів з F- - клітинами нестабільні, потім клітини
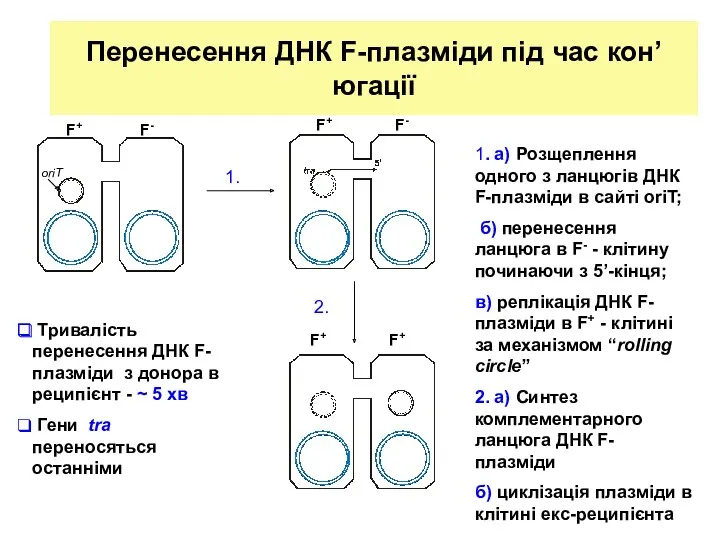
- 8. Перенесення ДНК F-плазміди під час кон’югації 1. а) Розщеплення одного з ланцюгів ДНК F-плазміди в сайті
- 9. Виявлення плазмід у клітинах бактерій Генетичні підходи – аналіз успадкування ознак, які ймовірно визначаються плазмідами генетичний
- 10. Мобільні генетичні елементи прокаріот
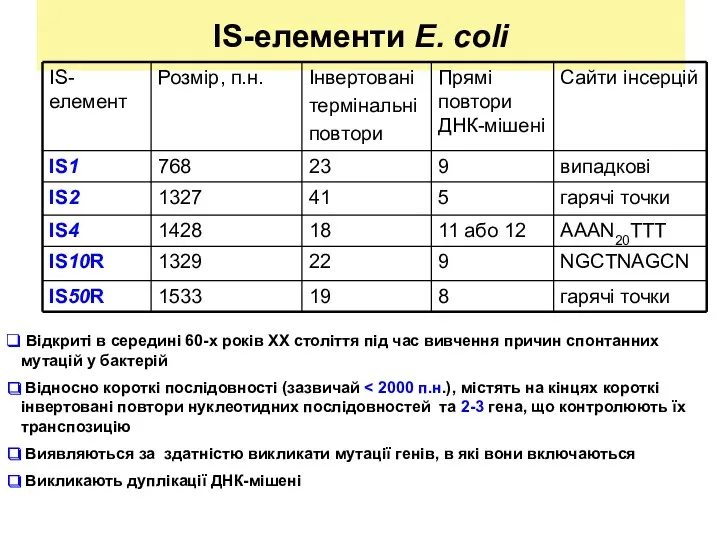
- 11. IS-елементи E. coli Відкриті в середині 60-х років ХХ століття під час вивчення причин спонтанних мутацій
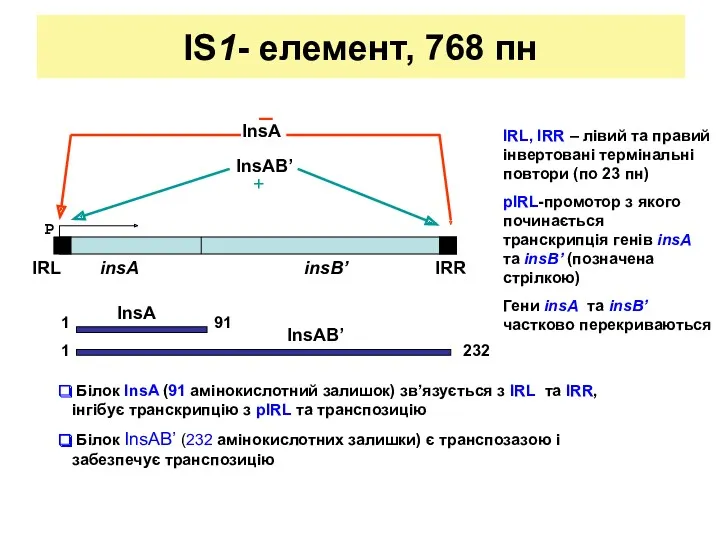
- 12. IS1- елемент, 768 пн P IRL, IRR – лівий та правий інвертовані термінальні повтори (по 23
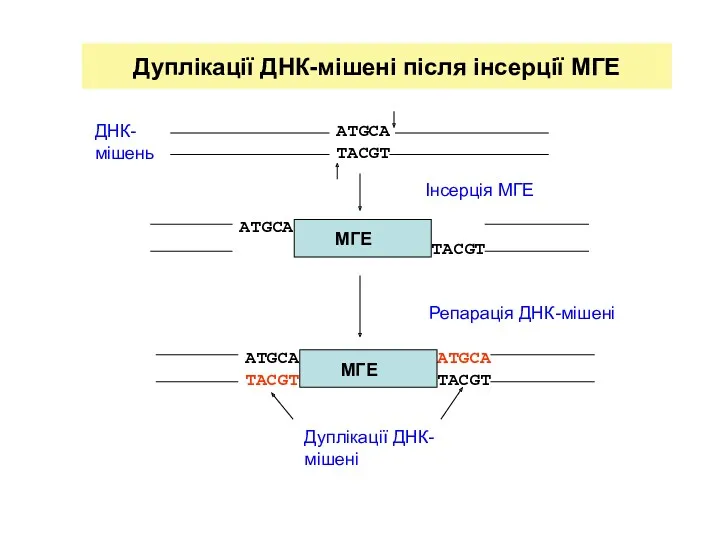
- 13. Дуплікації ДНК-мішені після інсерції МГЕ
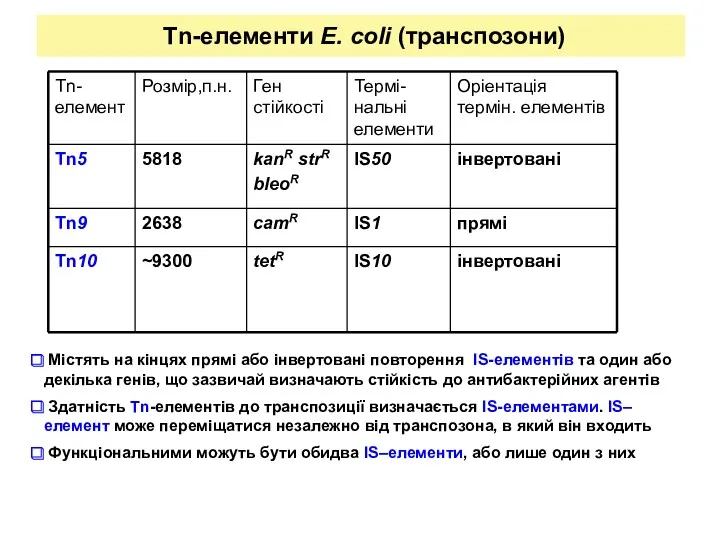
- 14. Tn-елементи E. coli (транспозони) Містять на кінцях прямі або інвертовані повторення IS-елементів та один або декілька
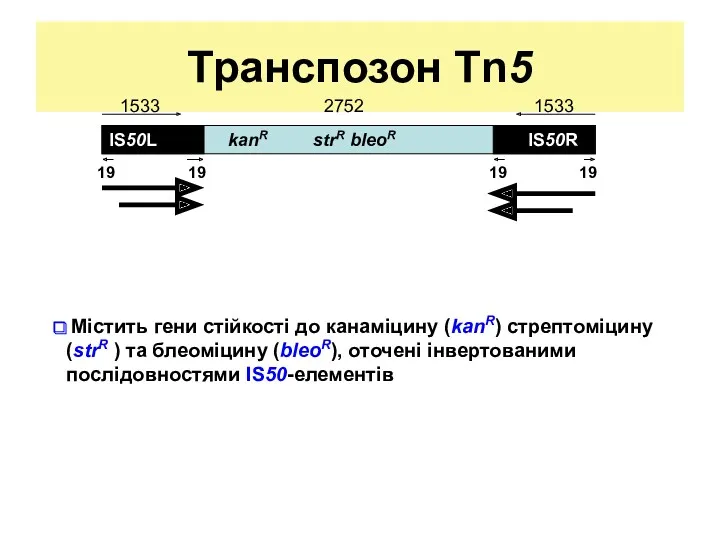
- 15. Транспозон Tn5 Містить гени стійкості до канаміцину (kanR) стрептоміцину (strR ) та блеоміцину (bleoR), оточені інвертованими
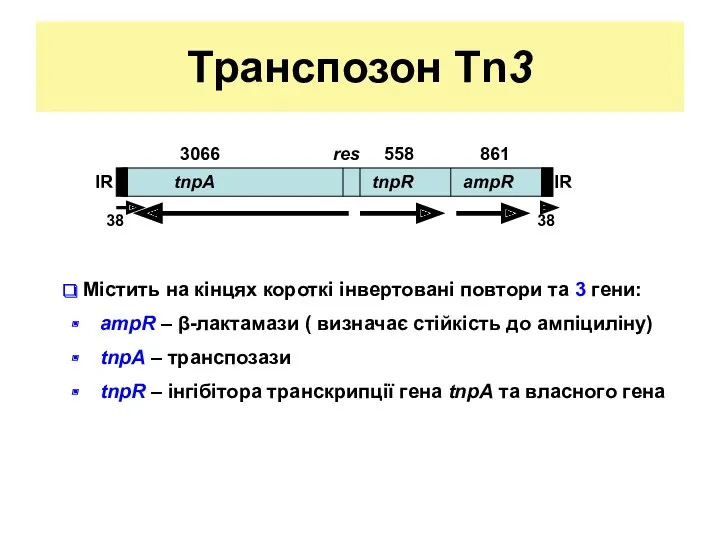
- 16. Транспозон Tn3 Містить на кінцях короткі інвертовані повтори та 3 гени: ampR – β-лактамази ( визначає
- 17. Кон’югативні транспозони (cTn) Відкриті в кінці 70-х років ХХ століття під час вивчення механізму резистентності бактерій
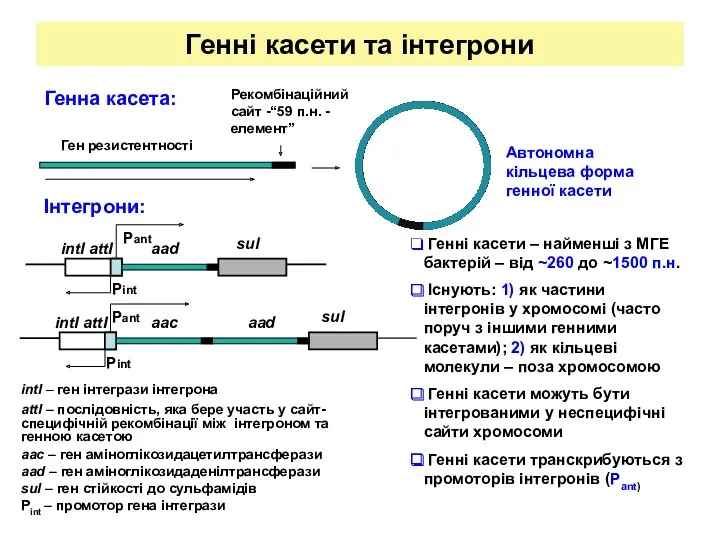
- 18. Генні касети та інтегрони intI – ген інтегрази інтегрона attI – послідовність, яка бере участь у
- 19. Транспозиції відбуваються: 1) за участю транспозази; 2) рекомбінаційними механізмами Відмінності рекомбінації при транспозиції і кросинговері: -
- 20. МГЕ – важливі чинники мінливості бактерій МГЕ зумовлюють мутації генів, в які вони включаються. При їх
- 21. Геном бактеріофагів ( облігатних внутрішньоклітинних паразитів ) Бактеріофаги – найпростіші моделі вивчення: структури і функції як
- 22. Основні особливості організації геномів бактеріофагів Види молекул нуклеїнових кислот, які виконують роль носіїв генетичної інформації фагів:
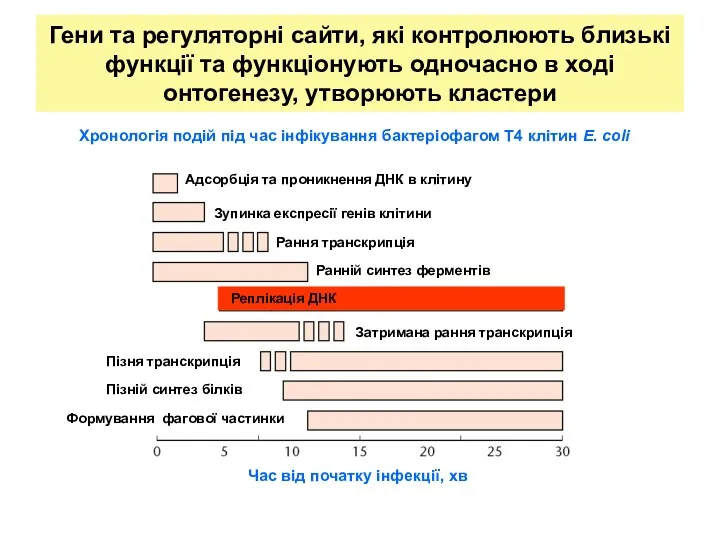
- 23. Гени та регуляторні сайти, які контролюють близькі функції та функціонують одночасно в ході онтогенезу, утворюють кластери
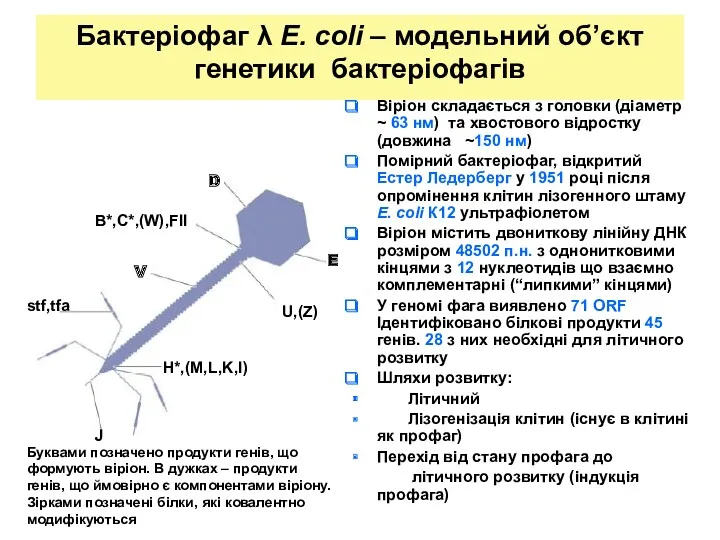
- 24. Бактеріофаг λ E. coli – модельний об’єкт генетики бактеріофагів Віріон складається з головки (діаметр ~ 63
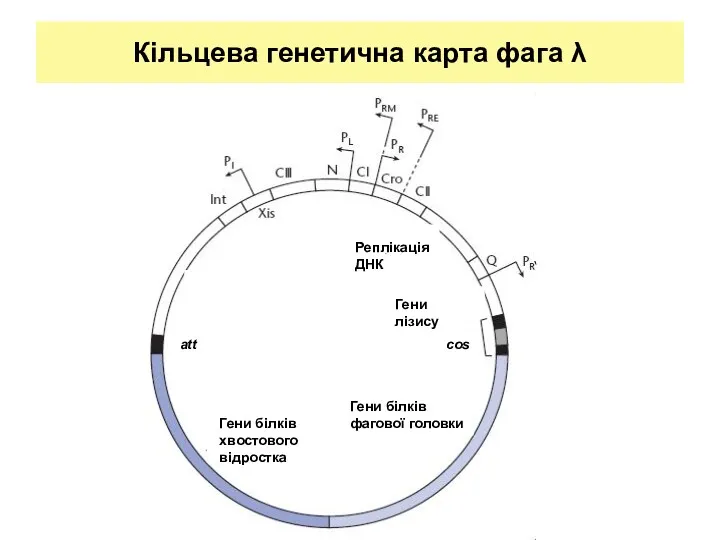
- 25. Кільцева генетична карта фага λ Реплікація ДНК Гени лізису Гени білків фагової головки att Гени білків
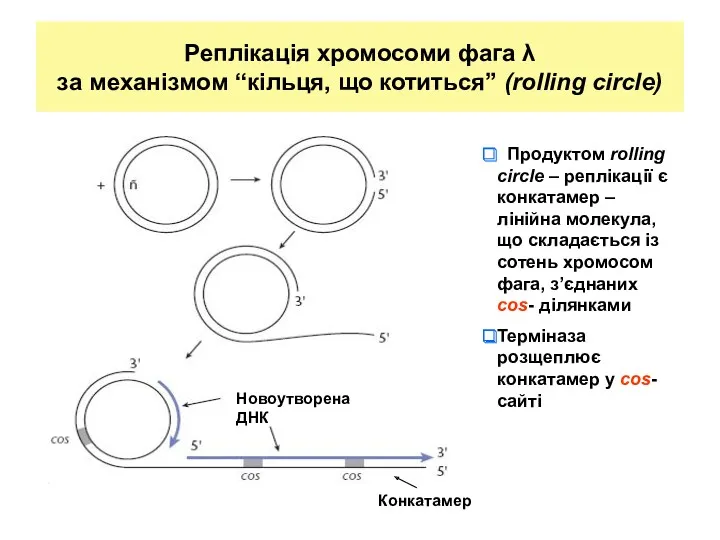
- 26. Реплікація хромосоми фага λ за механізмом “кільця, що котиться” (rolling circle) Конкатамер Новоутворена ДНК Продуктом rolling
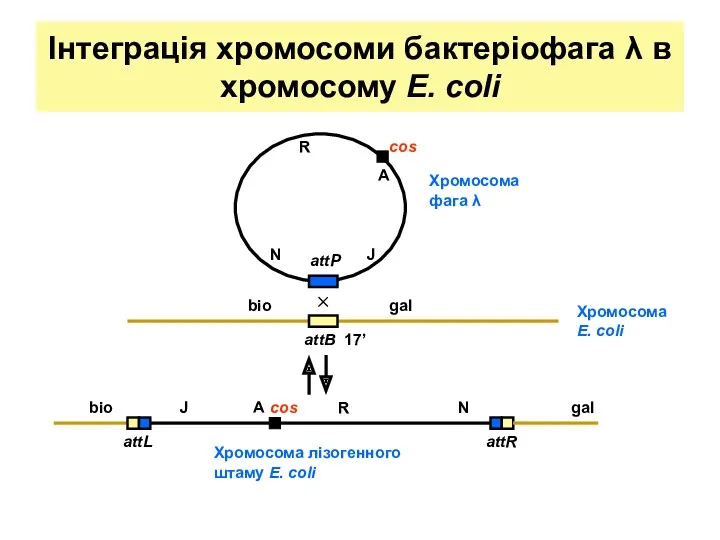
- 27. Інтеграція хромосоми бактеріофага λ в хромосому E. coli
- 28. Засновники генетики бактеріофагів – Макс Дельбрюк, Альфред Херші, Сальвадор Луріа Нобелівські лауреати з медицини та фізіології,
- 30. Скачать презентацию









 Жизнь и творчество Бориса Владимировича Заходера (1918-2000)
Жизнь и творчество Бориса Владимировича Заходера (1918-2000) Как звери ухаживают за детенышами
Как звери ухаживают за детенышами мхи
мхи Наследственная изменчивость. (9-10 класс)
Наследственная изменчивость. (9-10 класс) Як бджоли готуються до зими
Як бджоли готуються до зими Взаимодействие аллельных и неаллельных генов
Взаимодействие аллельных и неаллельных генов Hereditary blood diseases and hereditary disease of endocrine system
Hereditary blood diseases and hereditary disease of endocrine system Природные сообщества
Природные сообщества Викторина Анализаторы
Викторина Анализаторы Семейство растений бобовые
Семейство растений бобовые Сердечно-сосудистая и лимфотическая системы
Сердечно-сосудистая и лимфотическая системы Тип Членистоногие
Тип Членистоногие Анатомия и физиология конечного мозга
Анатомия и физиология конечного мозга Особенности строения и функционирования гладких мышц
Особенности строения и функционирования гладких мышц Строение стебля
Строение стебля Кишечнополостные. Класс Гидроидные. Класс Коралловые полипы. Класс Сцифоидные медузы
Кишечнополостные. Класс Гидроидные. Класс Коралловые полипы. Класс Сцифоидные медузы Зимующие птицы
Зимующие птицы Набор рисунков к теме по адаптации
Набор рисунков к теме по адаптации Биохимия мышц
Биохимия мышц Где зимуют птицы
Где зимуют птицы Строение и свойства белков
Строение и свойства белков Пресмыкающиеся Нижегородской области
Пресмыкающиеся Нижегородской области Размножение растений
Размножение растений Системность в коре больших полушарий
Системность в коре больших полушарий Різноманітність плазунів, їх роль в екосистемах та значення для людини. Охорона плазунів
Різноманітність плазунів, їх роль в екосистемах та значення для людини. Охорона плазунів Что же такое биология?
Что же такое биология? Размножение и развитие человека
Размножение и развитие человека презентация История исследования фотосинтеза
презентация История исследования фотосинтеза