Содержание
- 2. Ферменты –вещества белковой природы, способные ускорять химические реакции в живой клетке.
- 3. Общие свойства катализаторов 1. Катализаторы сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает
- 4. Особенности ферментов как биологических катализаторов 1. Работают в мягких условиях 2. Высокая эффективность действия. Ферменты ускоряют
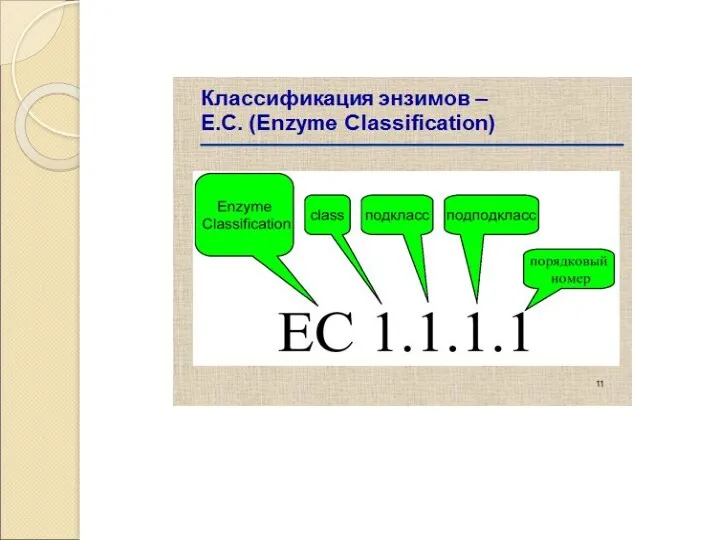
- 5. Номенклатура ферментов Систематическая номенклатура: Название фермента является сложным и состоит из 4 частей: 1. Название субстрата,
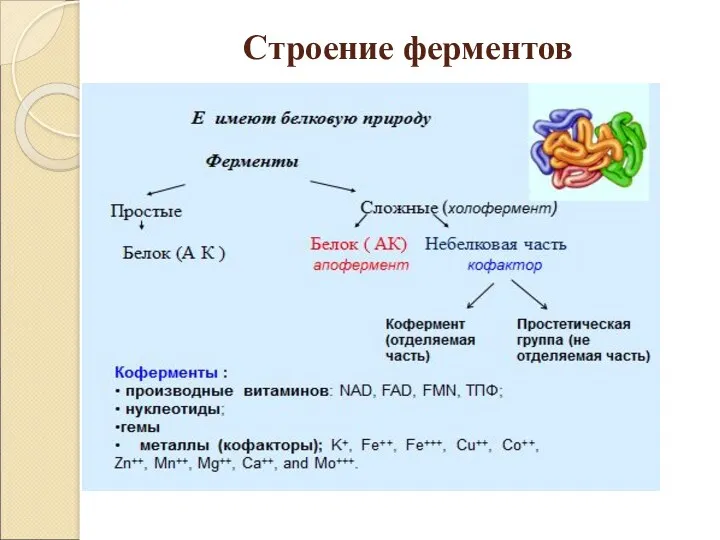
- 7. Строение ферментов
- 8. Функциональные центры: Активный центр – зона молекулы фермента, которая специфически взаимодействует с субстратом. Представлен функциональными группами
- 9. Сложные ферменты состоят из белковой и небелковой частей. Белковая часть фермента называется - апоферментом, небелковая –
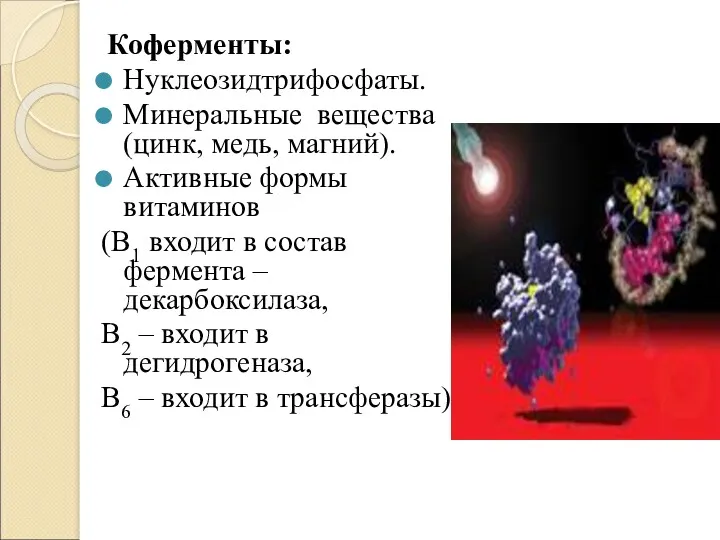
- 10. Коферменты: Нуклеозидтрифосфаты. Минеральные вещества (цинк, медь, магний). Активные формы витаминов (В1 входит в состав фермента –
- 11. Функции коферментов: Участие в акте катализа; Осуществление контакта между ферментом и субстратом; Стабилизация апофермента
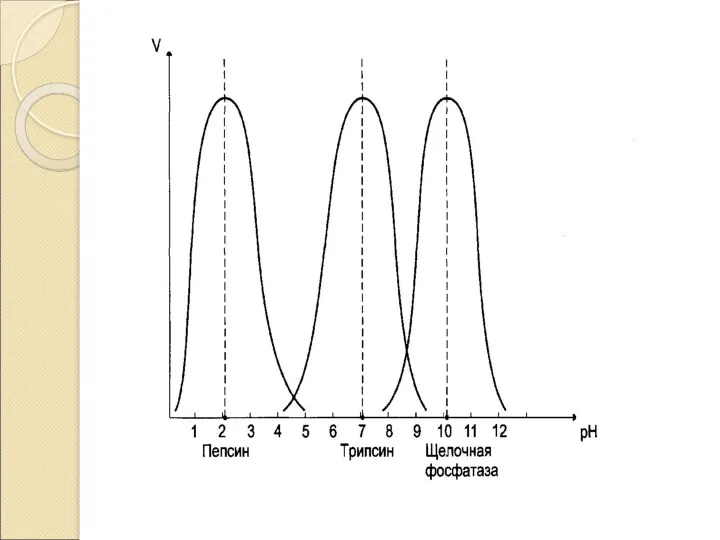
- 12. Специфичность действия ферментов: Относительная специфичность наблюдается, когда фермент катализирует реакции одного типа с более чем одним
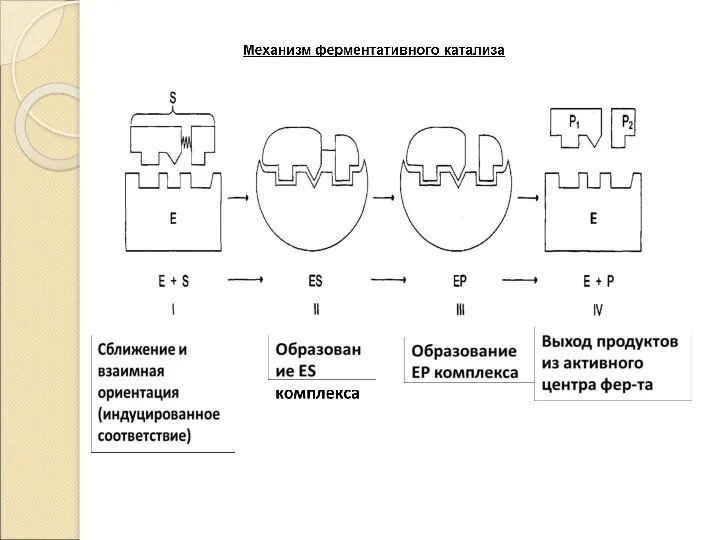
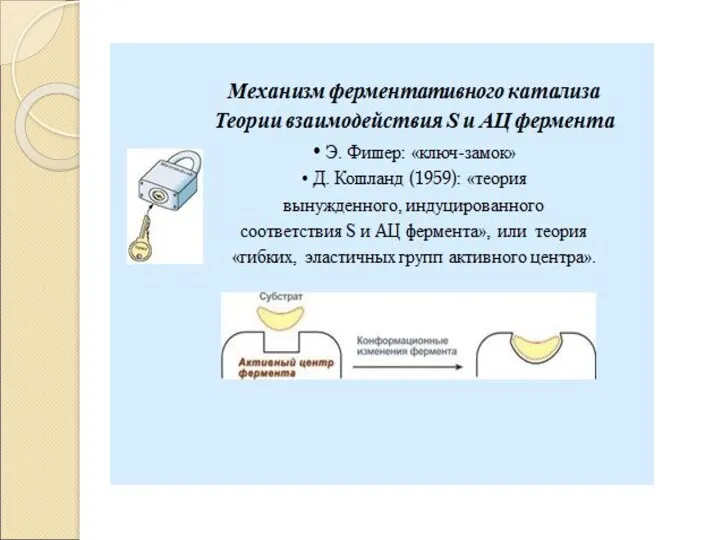
- 13. Механизм ферментативного катализа: Катализ – это процесс ускорения химической реакции под влиянием катализаторов, которые активно участвуют
- 14. E + S ES E + P Фермент – это биокатализатор, который путем образования фермент –
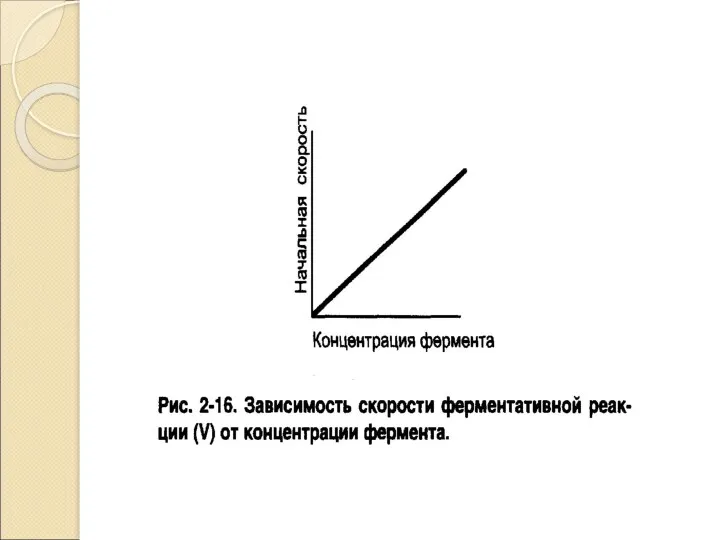
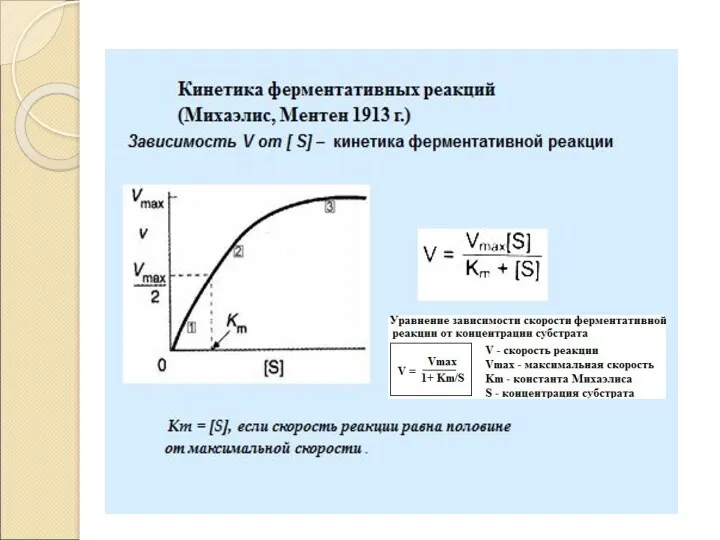
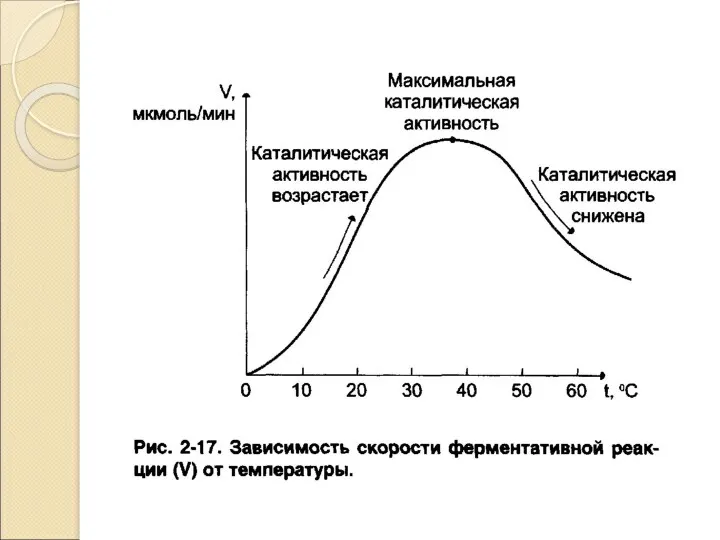
- 17. Кинетика ферментативных реакций Кинетика изучает изменение скорости ферментативной реакции во времени в зависимости отряда факторов: Концентрация
- 18. Активность – это изменение концентрации субстрата под влиянием фермента в единицу времени. Международная единица активности (МЕ
- 25. Количество фермента можно определить по его активности За единицу активности фермента принимается такое количество фермента, которое
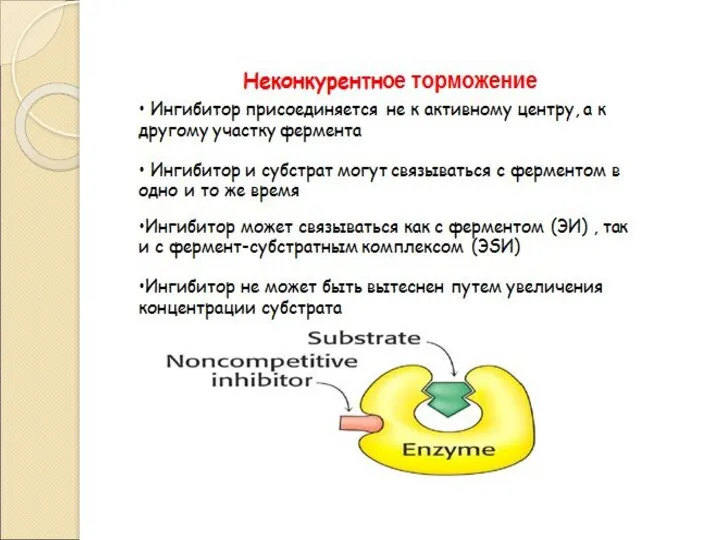
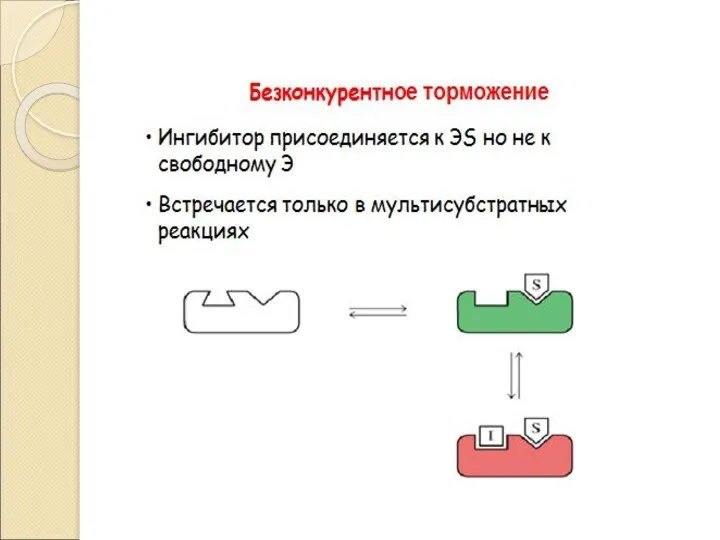
- 32. Регуляция Активности Ферментов • Закон действующих масс Аллостерическая регуляция • Обратимая ковалентная модификация • Компартментализация •
- 37. Скачать презентацию























 Рентгеноанатомия черепа. Обозначьте кости мозгового черепа
Рентгеноанатомия черепа. Обозначьте кости мозгового черепа Водорастворимые витамины
Водорастворимые витамины Птицы водоемов
Птицы водоемов Опора и движение. Опорно-двигательная система
Опора и движение. Опорно-двигательная система Мониезиоз жвачных животных. Разработка мер борьбы и профилактики
Мониезиоз жвачных животных. Разработка мер борьбы и профилактики Презентация В мире бактерий
Презентация В мире бактерий Перелётные птицы
Перелётные птицы Пространственная организация белков. Конформации полипептидной цепи. Карты Рамачандрана
Пространственная организация белков. Конформации полипептидной цепи. Карты Рамачандрана Всасывание. Роль печени. Функции толстого кишечника
Всасывание. Роль печени. Функции толстого кишечника Викторина. Тема Птицы.
Викторина. Тема Птицы. Функциональная асимметрия полушарий
Функциональная асимметрия полушарий Черты приспособленности организмов к среде обитания
Черты приспособленности организмов к среде обитания Ядовитые грибы и ягоды
Ядовитые грибы и ягоды Презентация Плоды
Презентация Плоды Урок по биологии в 7 классе по теме Семейство злаковые по программе Сонина Н.И. (содержит презентацию и текстовую разработку урока)
Урок по биологии в 7 классе по теме Семейство злаковые по программе Сонина Н.И. (содержит презентацию и текстовую разработку урока) Влияние двигательной активности на здоровье человека
Влияние двигательной активности на здоровье человека Біологічні науки, що вивчають організм людини
Біологічні науки, що вивчають організм людини Доклад на тему: Формирование универсальных умений и универсальных учебных действий учащихся в свете требований ФГОС на уроках биологии .
Доклад на тему: Формирование универсальных умений и универсальных учебных действий учащихся в свете требований ФГОС на уроках биологии .  Бактерии. История открытия. Строение бактерий
Бактерии. История открытия. Строение бактерий Проект Разнообразие природы родного края
Проект Разнообразие природы родного края Класс насекомые
Класс насекомые Викторина Анализаторы
Викторина Анализаторы История развития знаний о строении и функциях организма человека
История развития знаний о строении и функциях организма человека Класс Пресмыкающиеся, или Рептилии. Отряд Чешуйчатые
Класс Пресмыкающиеся, или Рептилии. Отряд Чешуйчатые Альбом по эмбриологии
Альбом по эмбриологии Социально-биологические основы физической культуры
Социально-биологические основы физической культуры Методика обучения биологии
Методика обучения биологии Кольчатые черви
Кольчатые черви