Содержание
- 2. Филогенез эукариотической клетки
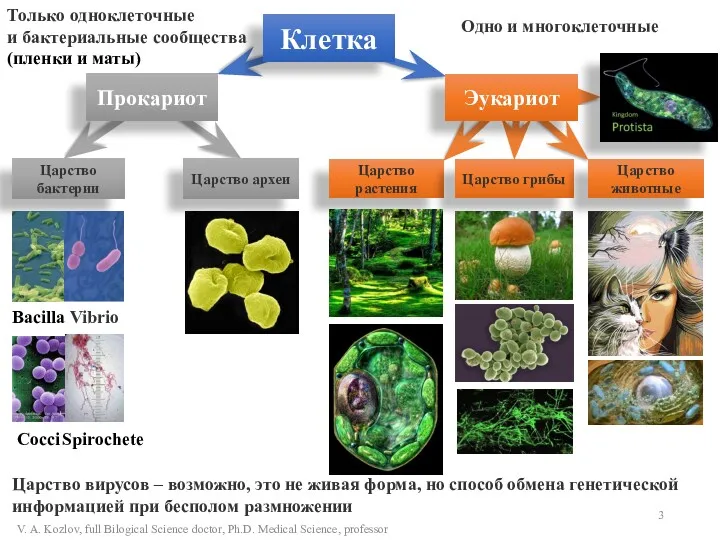
- 3. Клетка Прокариот Эукариот Царство бактерии Царство археи Bacilla Cocci Только одноклеточные и бактериальные сообщества (пленки и
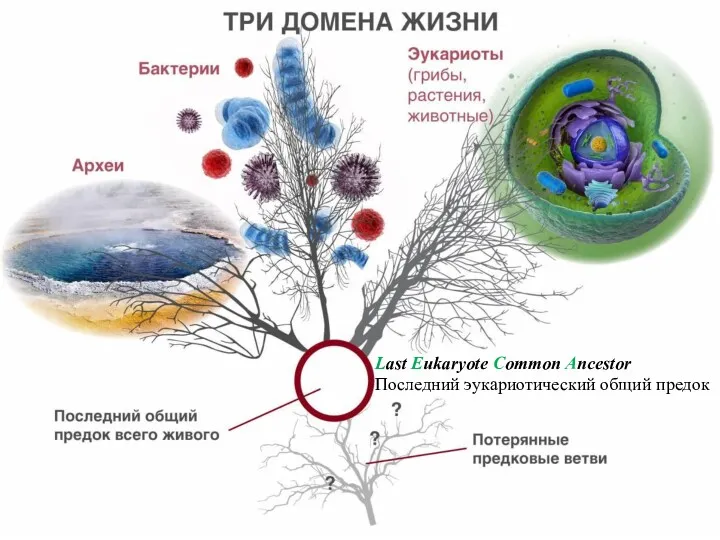
- 4. Last Eukaryote Common Ancestor Последний эукариотический общий предок
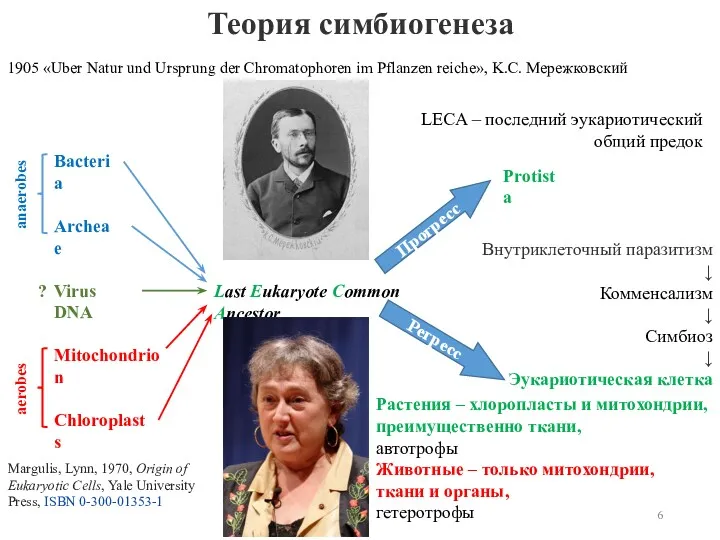
- 5. В 1905 K.С. Мережковский предположил, что эукариотическая клетка образовалась в результате симбиогенеза – слияния бактериальных клеток
- 6. Теория симбиогенеза anaerobes aerobes 1905 «Uber Natur und Ursprung der Chromatophoren im Pflanzen reiche», K.С. Мережковский
- 7. V. A. Kozlov, full Bilogical Science doctor, Ph.D. Medical Science, professor Р. Гупта предположил, что эукариотическая
- 8. Последний эукариотический общий предок имел значительно более сложный геном, чем у современных многоклеточных. Многоклеточность осуществлялась через
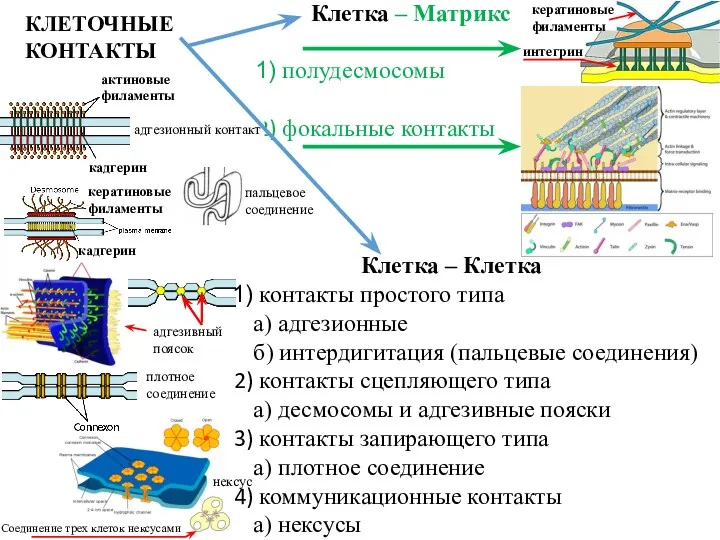
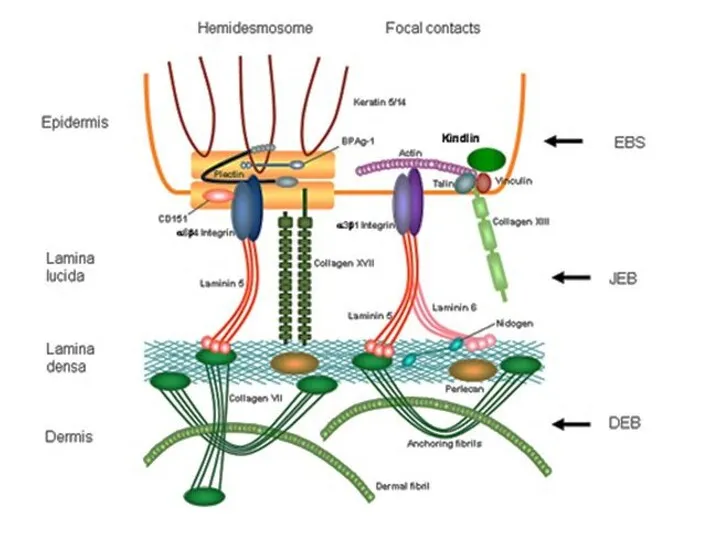
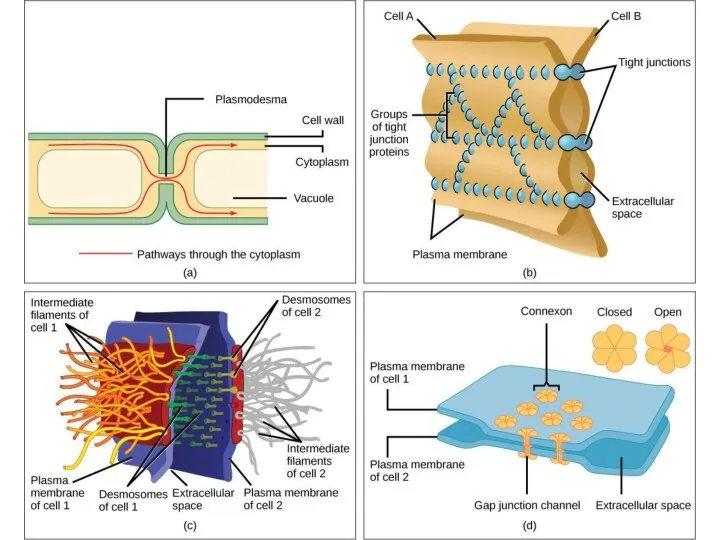
- 9. Типы соединения клеток
- 10. нексус Клетка – Клетка контакты простого типа а) адгезионные б) интердигитация (пальцевые соединения) контакты сцепляющего типа
- 13. Межклеточные контакты необходимы для соединения клеток информационного обмена а) межклеточного б) с внешней средой Для этого
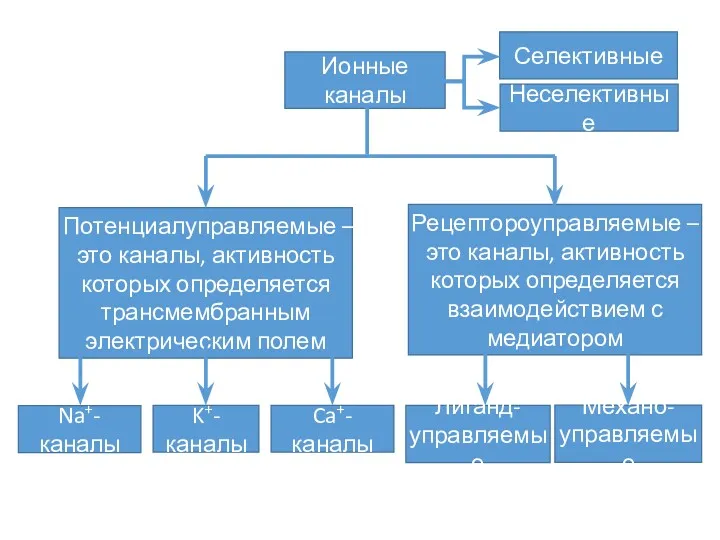
- 14. Ионные каналы
- 16. Общее представление о структуре и функциях ионных каналов Каналообразующие белковые молекулы всех ионных каналов имеют некоторые
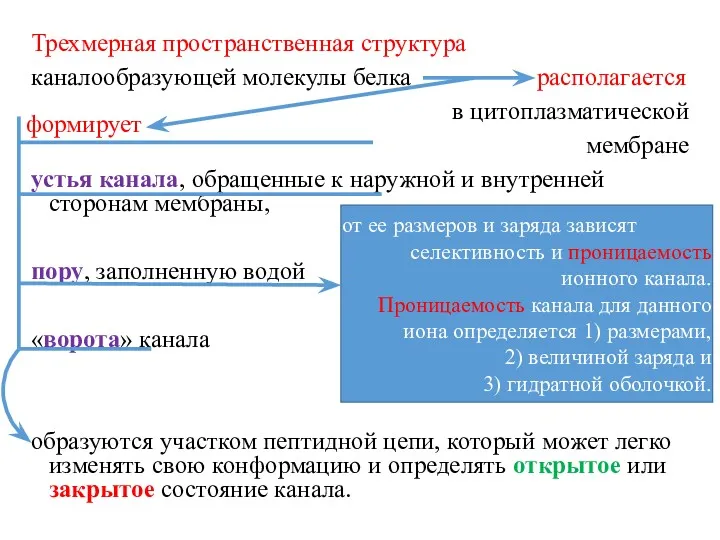
- 17. Трехмерная пространственная структура каналообразующей молекулы белка располагается в цитоплазматической мембране устья канала, обращенные к наружной и
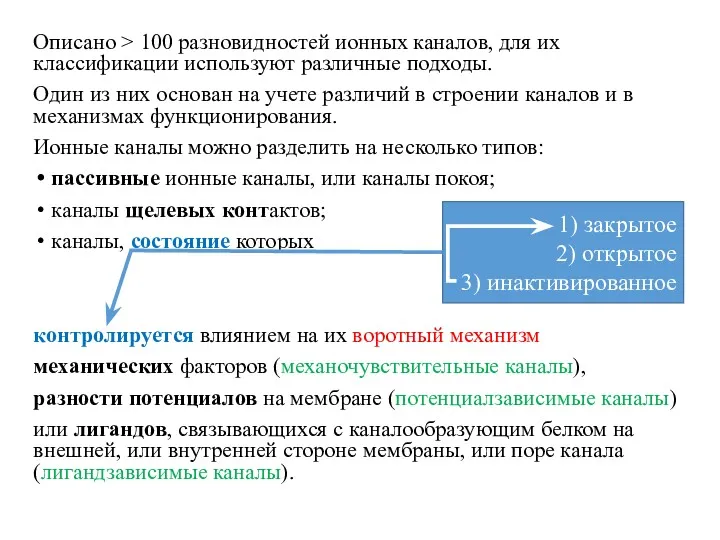
- 18. Описано > 100 разновидностей ионных каналов, для их классификации используют различные подходы. Один из них основан
- 19. Пассивные каналы могут быть открытыми (активными) в покоящихся клетках, т.е. в отсутствие каких-либо воздействий не являются
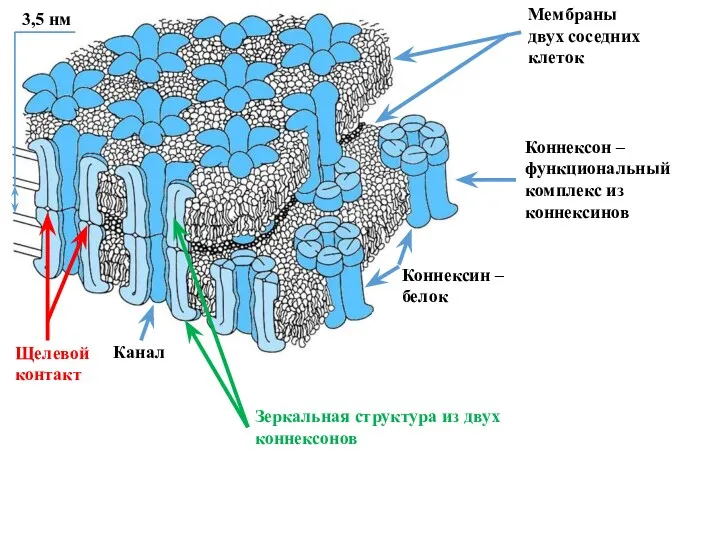
- 20. Каналы щелевых (плотных) контактов клеток Каналы щелевых контактов формируются в области контакта двух соседних клеток, очень
- 21. Мембраны двух соседних клеток Канал Щелевой контакт 3,5 нм Коннексин – белок Коннексон – функциональный комплекс
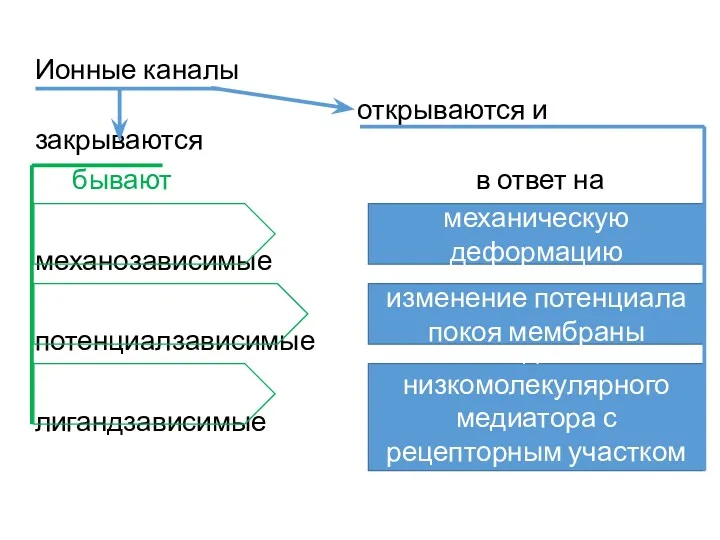
- 22. Ионные каналы открываются и закрываются бывают в ответ на механозависимые потенциалзависимые лигандзависимые взаимодействие низкомолекулярного медиатора с
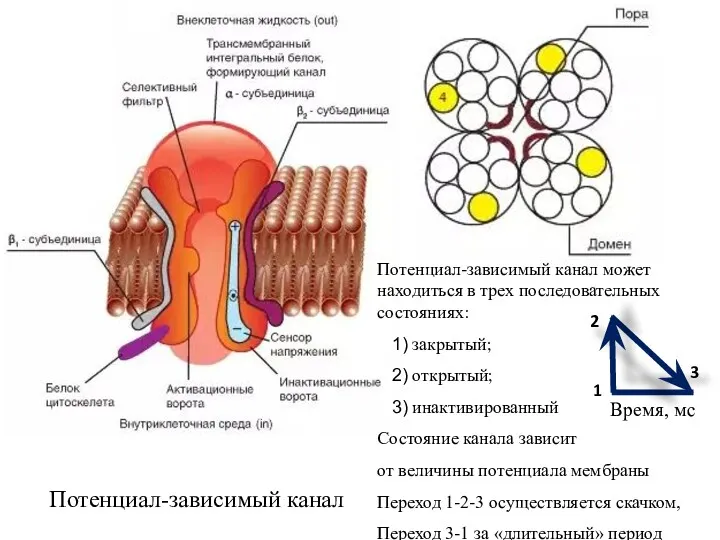
- 23. Потенциалзависимые каналы Состояние этих каналов управляется силами электрического поля, создаваемого величиной разности потенциалов (Δϕ) на мембране.
- 24. Потенциал-зависимый канал может находиться в трех последовательных состояниях: закрытый; открытый; инактивированный Состояние канала зависит от величины
- 25. Скорость открытия активационных ворот может быть очень высокой и низкой. По этому показателю потенциалзависимые ионные каналы
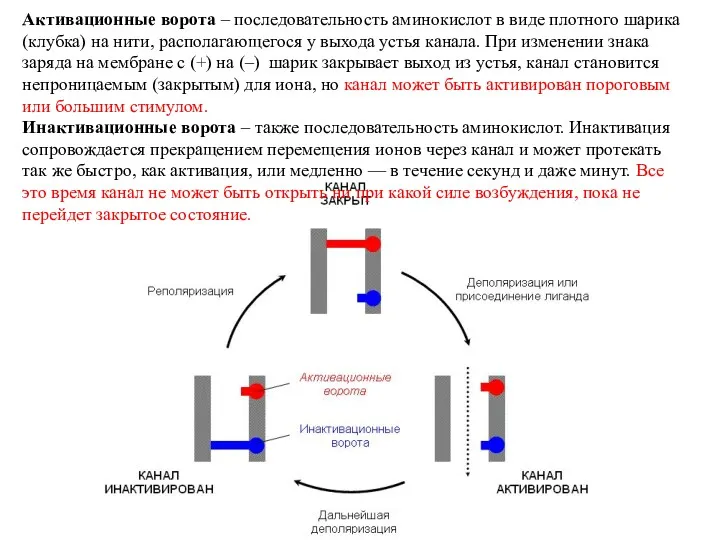
- 26. Активационные ворота – последовательность аминокислот в виде плотного шарика (клубка) на нити, располагающегося у выхода устья
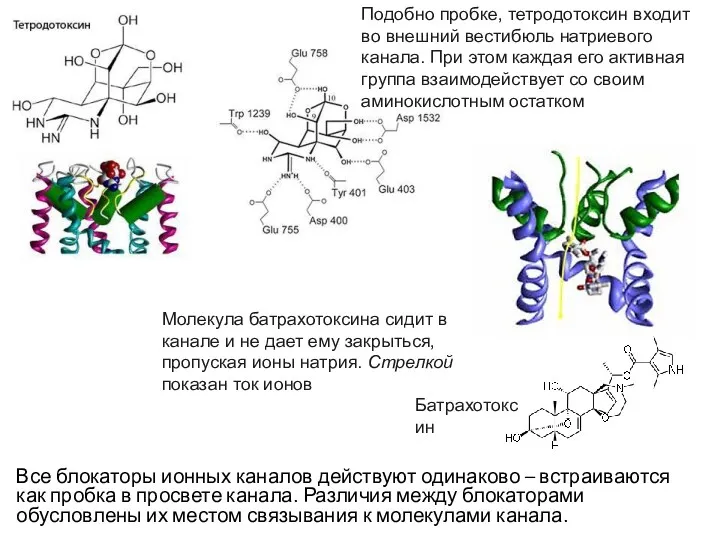
- 27. Существуют вещества, блокирующие работу потенциалзависимых ионных каналов. Таким образом, возможно еще одно состояние ионного канала –
- 28. Все блокаторы ионных каналов действуют одинаково – встраиваются как пробка в просвете канала. Различия между блокаторами
- 29. Порообразующая часть ионного канала может представлять собой 1) единый полипептид, организованный в виде нескольких идентичных трансмембранных
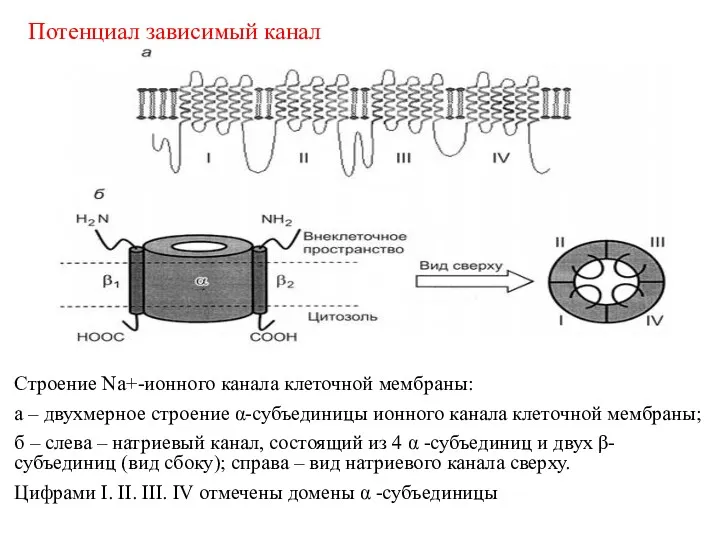
- 30. Строение Na+-ионного канала клеточной мембраны: а – двухмерное строение α-субъединицы ионного канала клеточной мембраны; б –
- 31. Нарушение работы ионных каналов часто приводят к заболеваниям — каналопатиям. Основная причина таких нарушений — наследственные
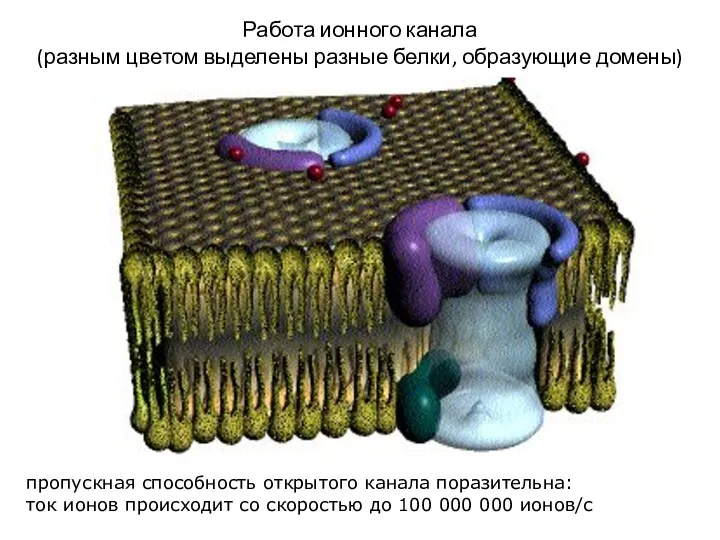
- 32. Работа ионного канала (разным цветом выделены разные белки, образующие домены) пропускная способность открытого канала поразительна: ток
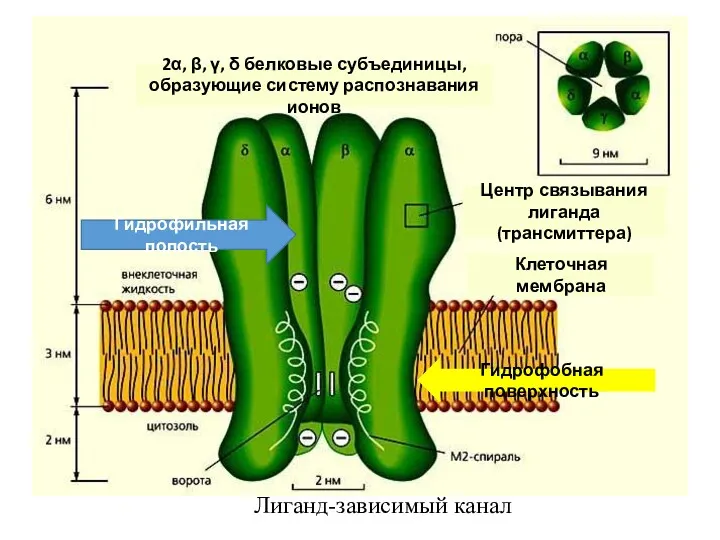
- 33. Лигандзависимые ионные каналы Формируются белковыми макромолекулами, одновременно выполняющими функцию ионных каналов и селективных рецепторов лигандов. Поэтому
- 34. Лиганд-зависимый канал Центр связывания лиганда (трансмиттера) Клеточная мембрана 2α, β, γ, δ белковые субъединицы, образующие систему
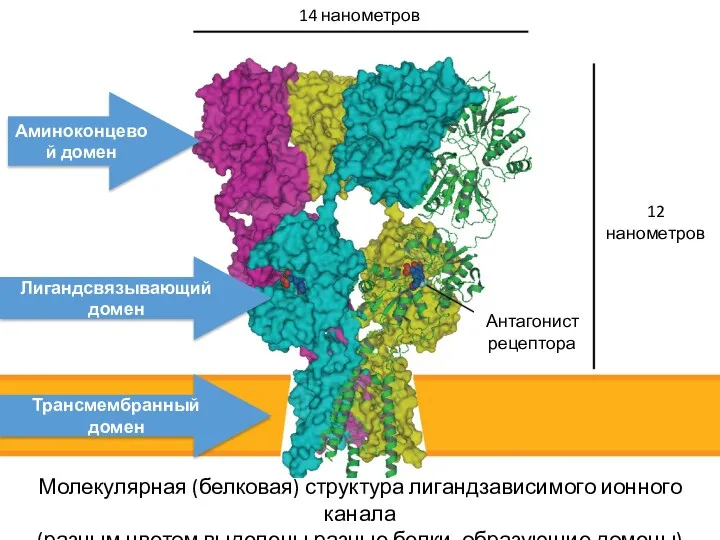
- 35. 14 нанометров 12 нанометров Антагонист рецептора Трансмембранный домен Лигандсвязывающий домен Аминоконцевой домен Молекулярная (белковая) структура лигандзависимого
- 36. Лигандзависимые ионные каналы обычно локализованы в постсинаптических мембранах нервных клеток и их отростков, а также мышечных
- 37. Лигандзависимые каналы могут изменять проницаемость для катионов Na+ и К+ или для К+ и анионов СI–.
- 38. Существуют медленные лигандзависимые ионные каналы. Их открытие реализуется через цепь последовательных событий: первичный медиатор (лиганд, нейромедиатор)
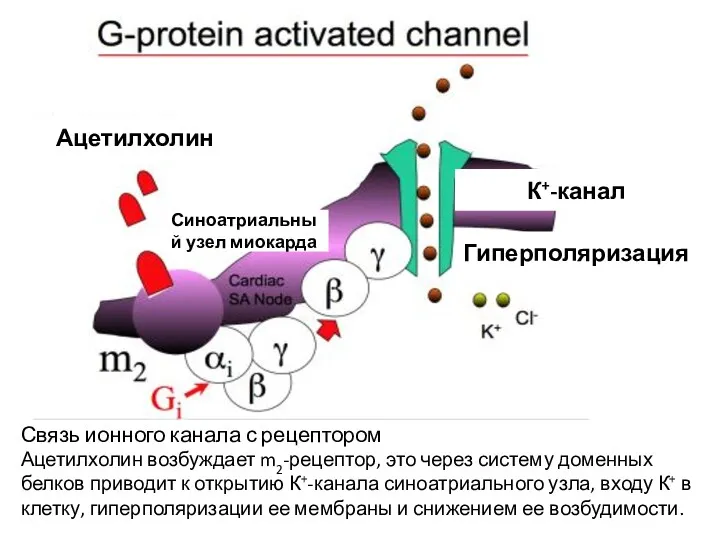
- 39. Ацетилхолин К+-канал Гиперполяризация Синоатриальный узел миокарда Связь ионного канала с рецептором Ацетилхолин возбуждает m2-рецептор, это через
- 40. Особым типом лигандзависимых каналов являются каналы, локализованные в мембранах эндоплазматического ретикулума гладкомышечной клетки. Их лигандом является
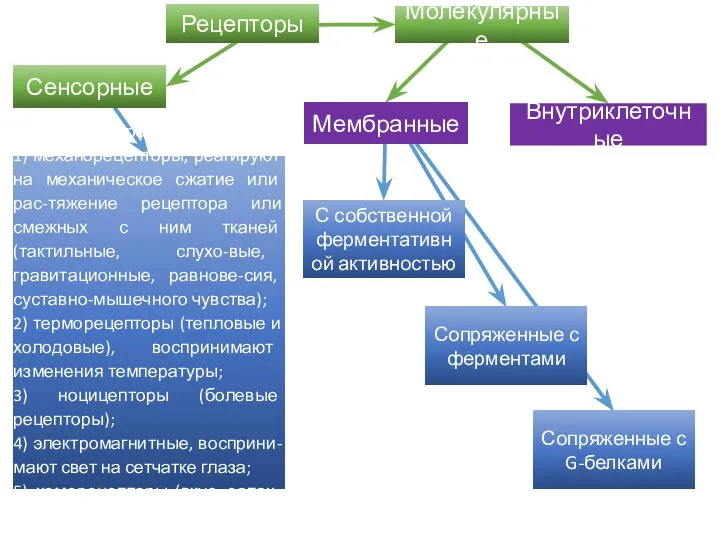
- 41. Рецепторы РЕЦЕПЦИЯ – процесс восприятия и трансформации (преобразования) энергии внешнего раздражителя в нервный импульс или сложную
- 42. Сенсорные Мембранные Внутриклеточные Специализированные клетки: 1) механорецепторы, реагируют на механическое сжатие или рас-тяжение рецептора или смежных
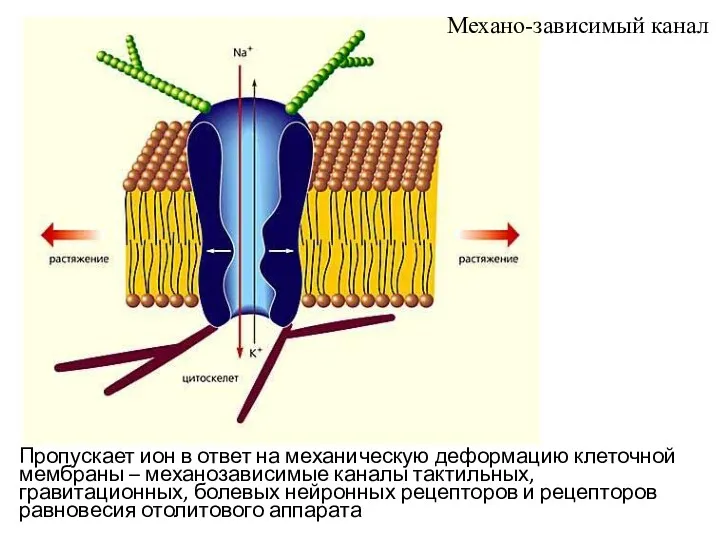
- 43. Пропускает ион в ответ на механическую деформацию клеточной мембраны – механозависимые каналы тактильных, гравитационных, болевых нейронных
- 44. Сенсорные рецепторы
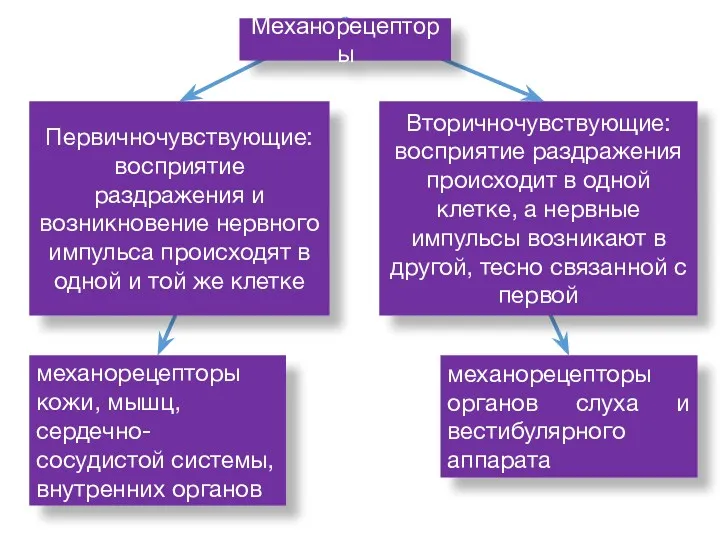
- 45. механорецепторы кожи, мышц, сердечно-сосудистой системы, внутренних органов механорецепторы органов слуха и вестибулярного аппарата Механорецепторы Вторичночувствующие: восприятие
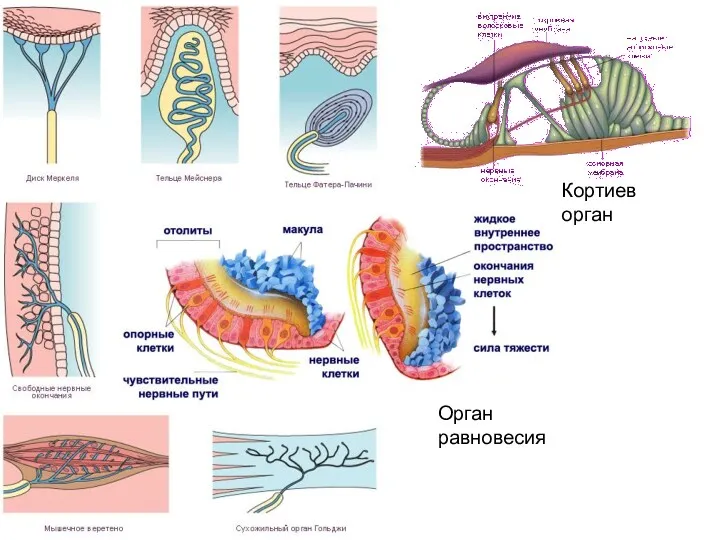
- 46. Кортиев орган Орган равновесия
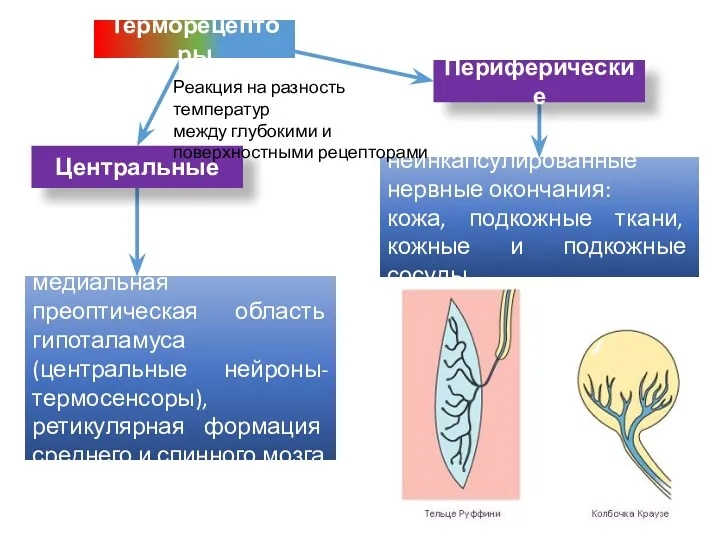
- 47. Периферические неинкапсулированные нервные окончания: кожа, подкожные ткани, кожные и подкожные сосуды медиальная преоптическая область гипоталамуса (центральные
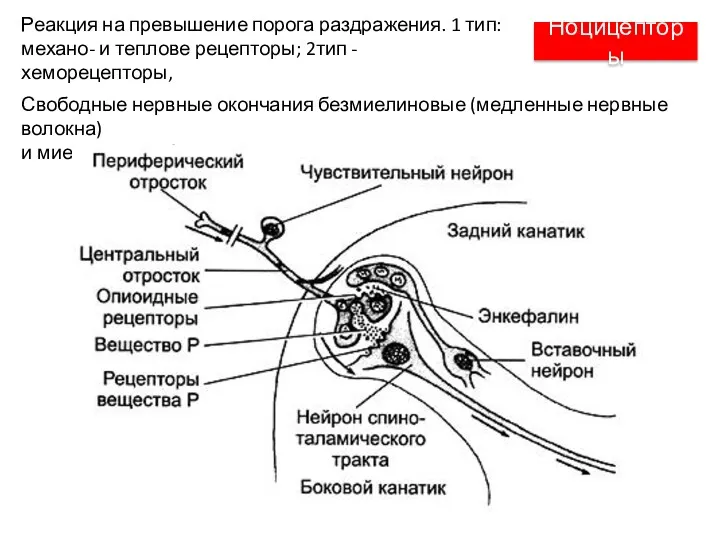
- 48. Ноцицепторы Свободные нервные окончания безмиелиновые (медленные нервные волокна) и миелиновые (быстрые нервные волокна) Реакция на превышение
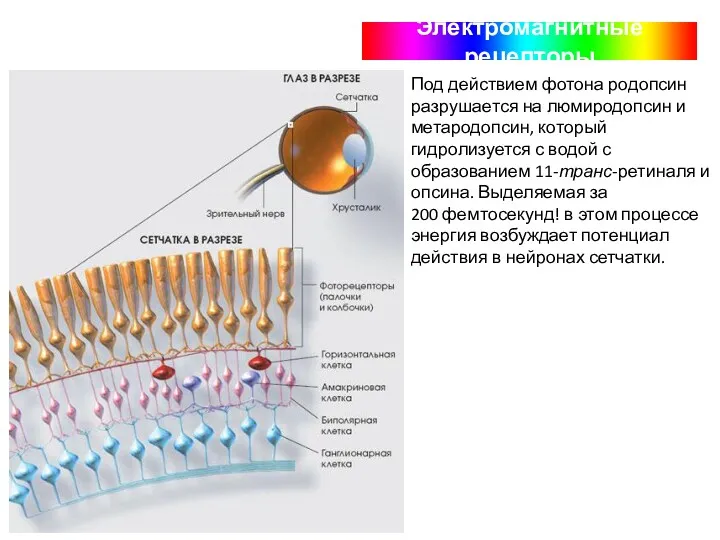
- 49. Электромагнитные рецепторы Под действием фотона родопсин разрушается на люмиродопсин и метародопсин, который гидролизуется с водой с
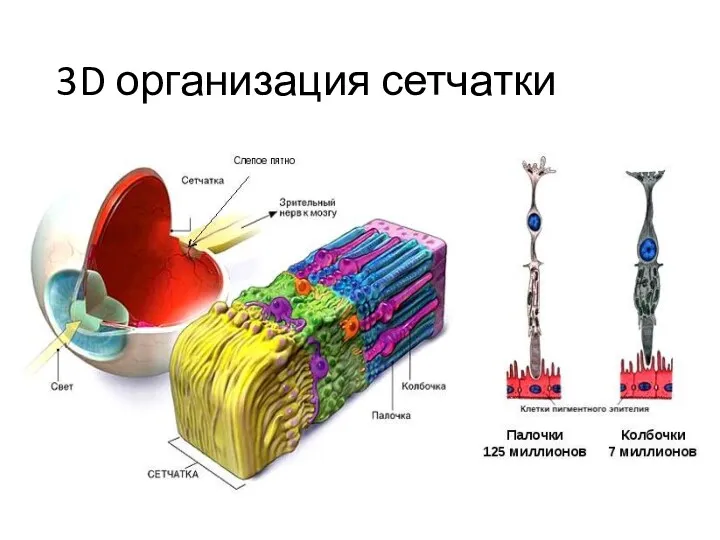
- 50. 3D организация сетчатки
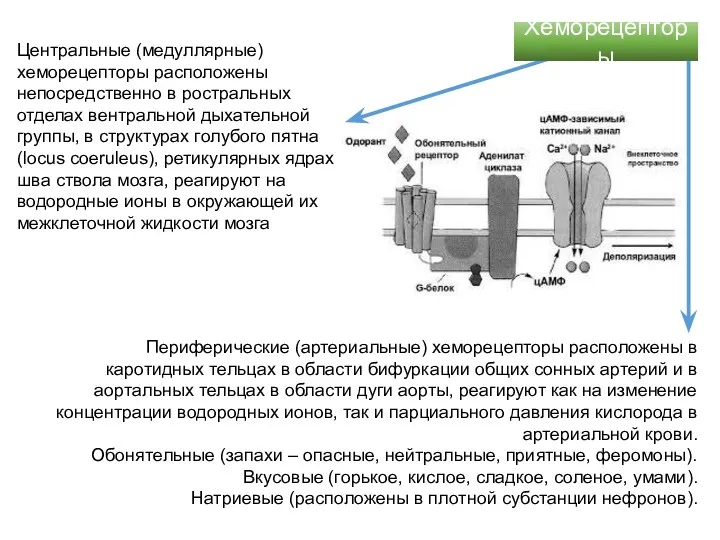
- 51. Центральные (медуллярные) хеморецепторы расположены непосредственно в ростральных отделах вентральной дыхательной группы, в структурах голубого пятна (locus
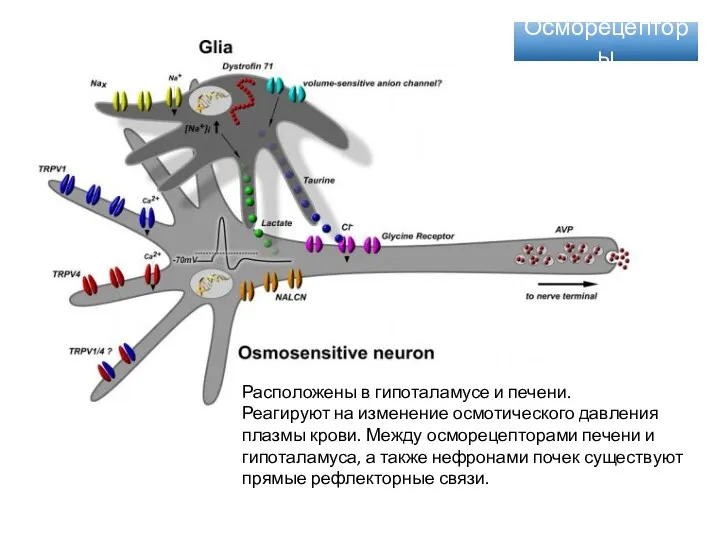
- 52. Осморецепторы Расположены в гипоталамусе и печени. Реагируют на изменение осмотического давления плазмы крови. Между осморецепторами печени
- 53. Молекулярные рецепторы
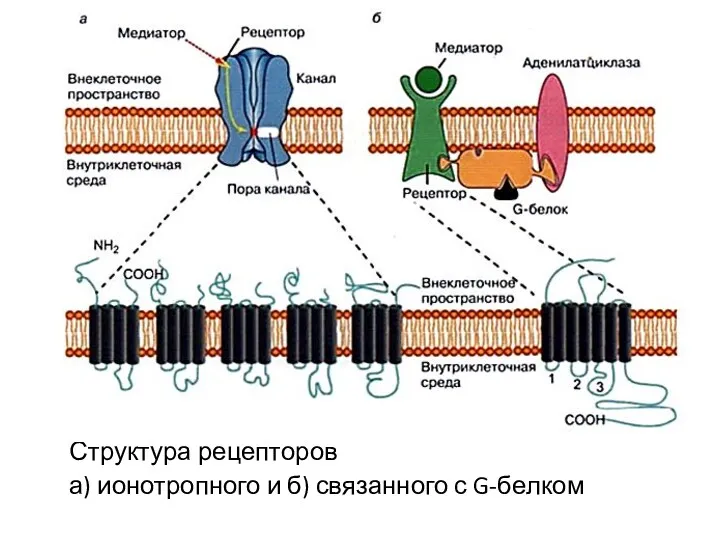
- 55. Структура рецепторов а) ионотропного и б) связанного с G-белком
- 56. Мембранные рецепторы сопряженные с ионными каналами Механизм работы: Активация рецептора Открытие ионного канала Изменение электрического потенциала
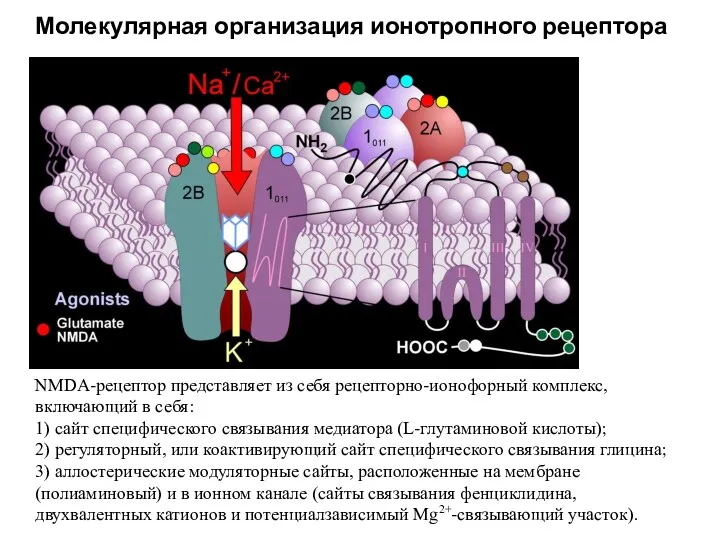
- 57. NMDA-рецептор представляет из себя рецепторно-ионофорный комплекс, включающий в себя: 1) сайт специфического связывания медиатора (L-глутаминовой кислоты);
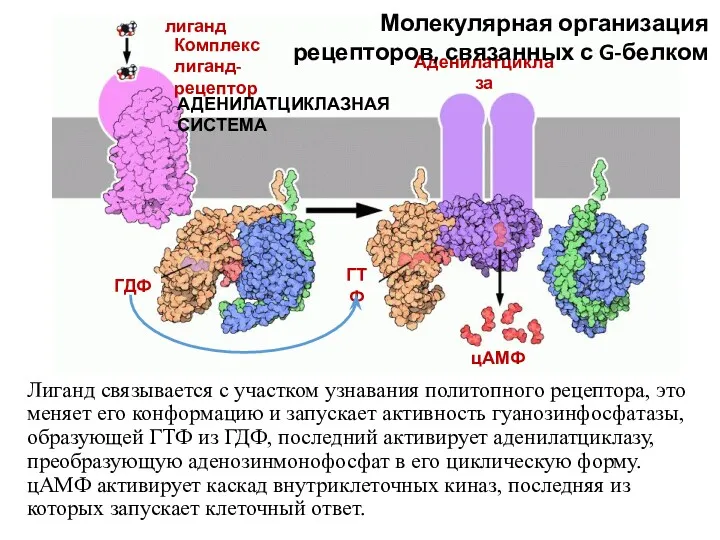
- 58. Мембранные рецепторы сопряженные с G-белками Механизм работы: Активация рецептора Активация G–белка Активация фермента, катализирующего образование второго
- 59. Лиганд связывается с участком узнавания политопного рецептора, это меняет его конформацию и запускает активность гуанозинфосфатазы, образующей
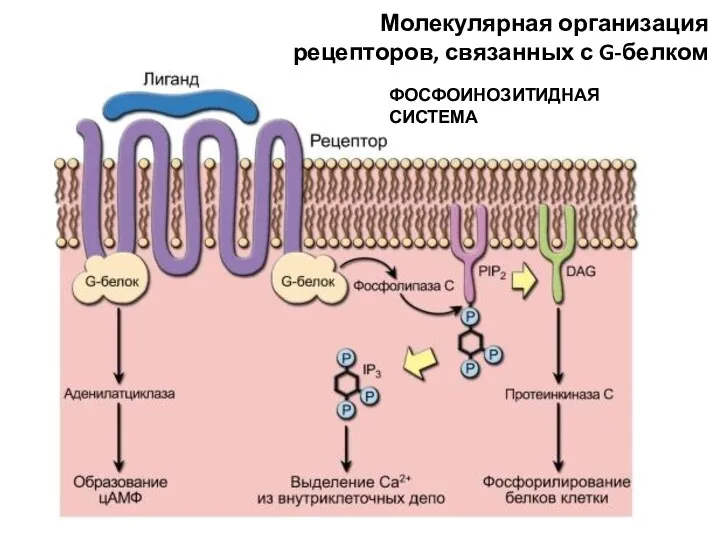
- 60. Молекулярная организация рецепторов, связанных с G-белком ФОСФОИНОЗИТИДНАЯ СИСТЕМА
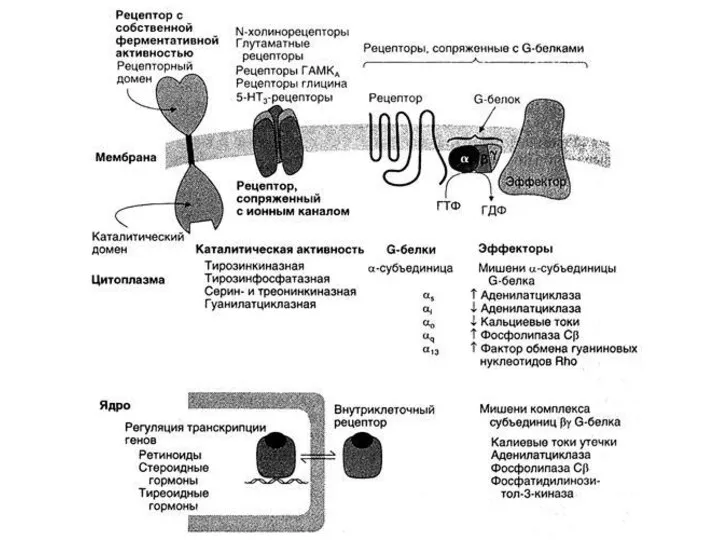
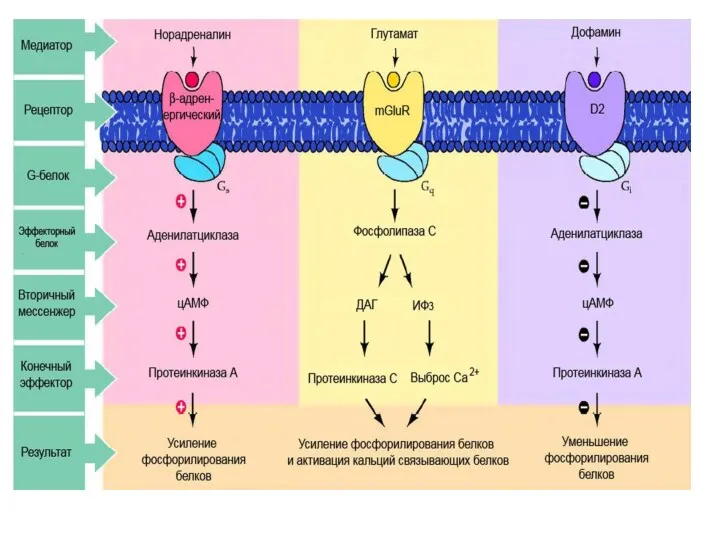
- 61. G-белки двух типов: GS – стимулирующие клеточный ответ GI – ингибирующие клеточный ответ Лиганды (первичные посредники)
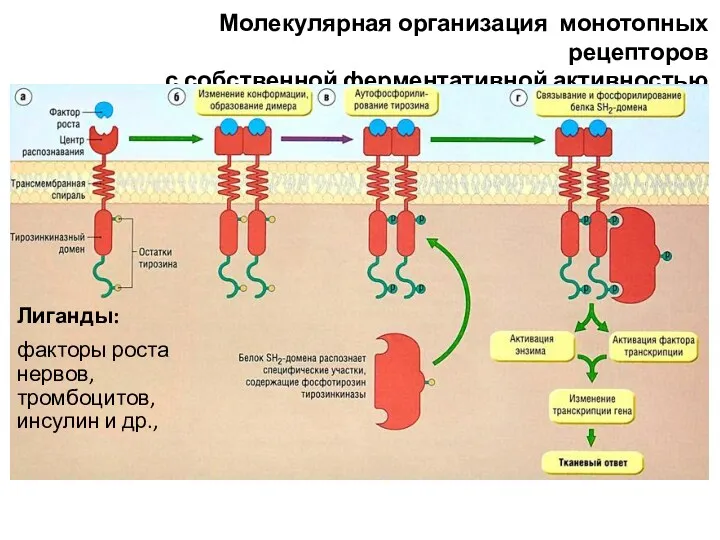
- 63. Молекулярная организация монотопных рецепторов с собственной ферментативной активностью Лиганды: факторы роста нервов, тромбоцитов, инсулин и др.,
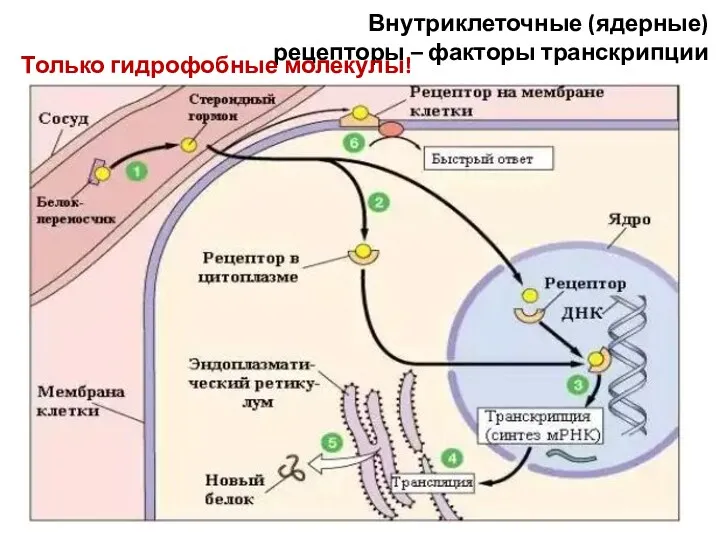
- 64. Внутриклеточные (ядерные) рецепторы – факторы транскрипции Только гидрофобные молекулы!
- 66. Скачать презентацию


























 Молекулярно-генетические механизмы развития корня
Молекулярно-генетические механизмы развития корня Интерсекс. Терминология и идентичность. Гендерная идентичность
Интерсекс. Терминология и идентичность. Гендерная идентичность Хромосомная теория наследственности. Сцепленное наследование
Хромосомная теория наследственности. Сцепленное наследование Теория И.П. Павлова о типах высшей нервной деятельности
Теория И.П. Павлова о типах высшей нервной деятельности Строение семян двудольных и однодольных растений
Строение семян двудольных и однодольных растений Тонкий кишечник
Тонкий кишечник The muscular system
The muscular system Мы - друзья пернатых
Мы - друзья пернатых Вода - основной источник жизни и здоровья
Вода - основной источник жизни и здоровья Асқазан. Дамуы
Асқазан. Дамуы Різноманітність ссавців
Різноманітність ссавців Биологические ритмы
Биологические ритмы 7 Б класс. Принял эстафету
7 Б класс. Принял эстафету 1 апреля – Международный день птиц
1 апреля – Международный день птиц Проверка знаний
Проверка знаний Внутрішня будова ссавців
Внутрішня будова ссавців Физиология сенсорных систем
Физиология сенсорных систем Квіткові рослини
Квіткові рослини Урок биологии Многообразие ракообразных с презентацией в 7 классе по учебнику Н.И.Сонина
Урок биологии Многообразие ракообразных с презентацией в 7 классе по учебнику Н.И.Сонина Водоросли. Особенности строения, питания, размножения
Водоросли. Особенности строения, питания, размножения Внеклассное мероприятие по биологии в 7-8 классах на тему: Мы- за здоровье!
Внеклассное мероприятие по биологии в 7-8 классах на тему: Мы- за здоровье! Репликация ДНК. (Лекция 3)
Репликация ДНК. (Лекция 3) Витамины
Витамины Фиалка домашняя
Фиалка домашняя Мегаспорогенез және микроспорогенез
Мегаспорогенез және микроспорогенез Бактериофаги. Основная роль
Бактериофаги. Основная роль Урок-игра по теме Системы органов животных
Урок-игра по теме Системы органов животных Полевые цветы. Фото
Полевые цветы. Фото