Содержание
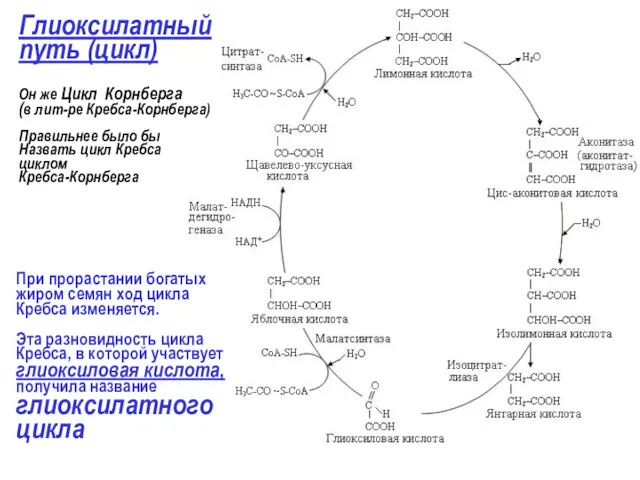
- 2. Глиоксилатный путь (цикл) Он же Цикл Корнберга (в лит-ре Кребса-Корнберга) Правильнее было бы Назвать цикл Кребса
- 3. Значение глиоксилатного цикла - НАДН может окисляться с образованием трех молекул АТФ. - сукцинат (янтарная кислота)
- 4. ЭЛЕКТРОН-ТРАНСПОРТНАЯ ЦЕПЬ ДЫХАНИЯ Энергия, которая освобождается при разрушении дыхательного субстрата, запасается частично в виде АТФ, а
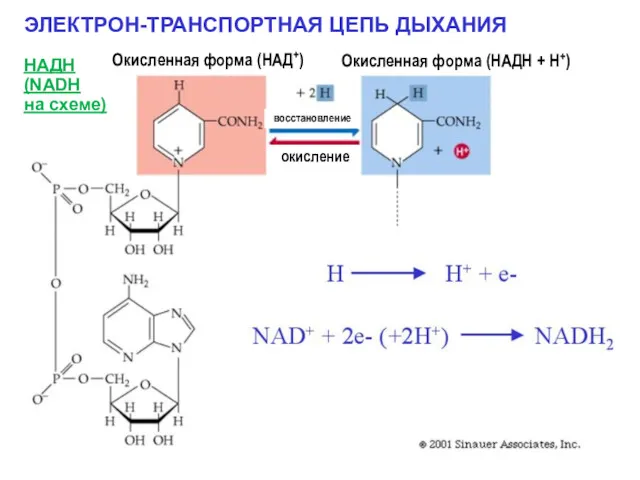
- 5. ЭЛЕКТРОН-ТРАНСПОРТНАЯ ЦЕПЬ ДЫХАНИЯ НАДН (NADH на схеме) Окисленная форма (НАД+) Окисленная форма (НАДН + Н+) окисление
- 6. Электрон-транспортная цепь (ЭТЦ) расположена к кристах митохондрий. Большинство её компонентов белки, которые объеденены в сложные белковые
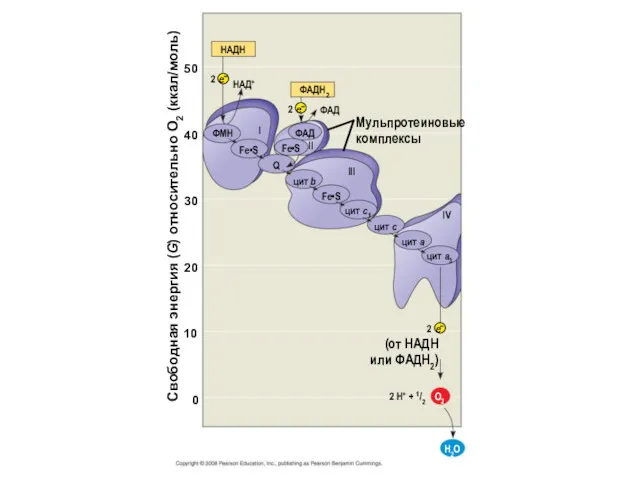
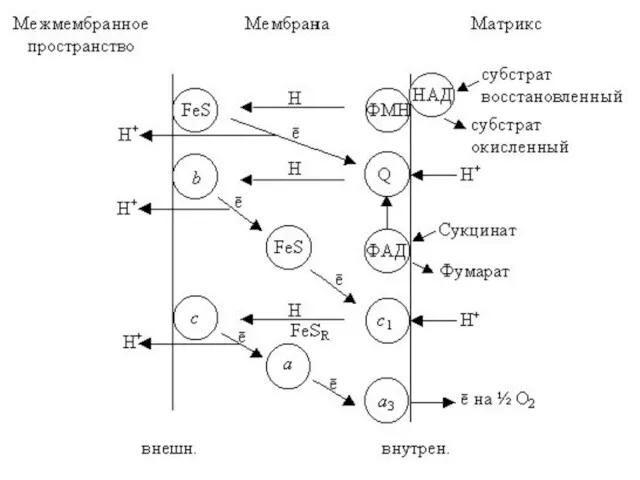
- 7. НАДH НАД+ 2 ФAДH2 2 ФAД Мульпротеиновые комплексы ФАД Fe•S ФМН Fe•S Q Fe•S Ι цит
- 8. Во время дыхания большая часть энергии течет в следующем направлении: Глюкоза - НAДH – ЭТЦ –
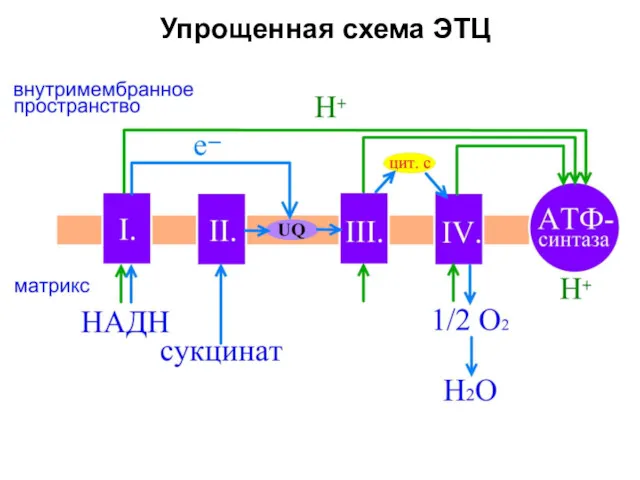
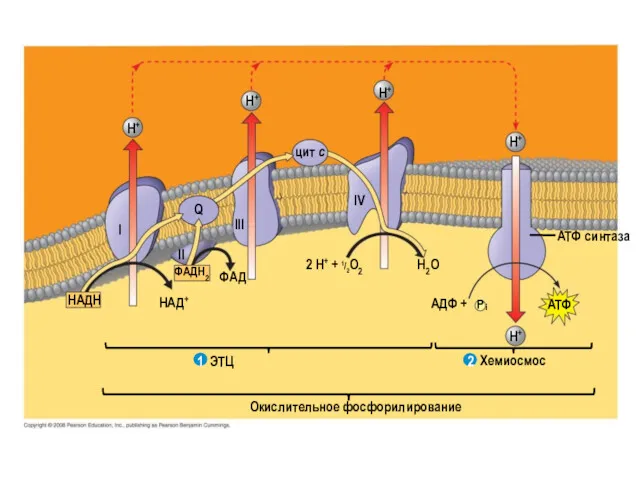
- 9. Упрощенная схема ЭТЦ
- 10. H+ H+ H+ цит c Q Ι ΙΙ ΙΙΙ ΙV ФАДH2 ФАД НАД+ НАДН ЭТЦ 2
- 11. Комплексы ЭТЦ
- 12. Комплексы ЭТЦ
- 13. Комплексы ЭТЦ
- 14. Комплексы ЭТЦ
- 15. Комплексы ЭТЦ
- 16. Комплексы ЭТЦ Комплекс I переносит электроны от НАД(Ф)Н к убихинону Q. Его субстратом служит молекула внутримитохондриального
- 17. Комплексы ЭТЦ Комплекс II катализирует окисление сукцината убихиноном. Эту функцию выполняет флавиновая (ФАД-зависимая) сукцинат – убихинон-оксидоредуктаза,
- 18. Комплексы ЭТЦ Комплекс III переносит электроны восстановленного убихинона к цитохрому с1, т. е. функционирует как убихинон
- 19. В комплексе IV электроны переносятся от цитохрома с к кислороду, т. е. этот комплекс является цитохром
- 20. Все компоненты цепи, за исключением убихинона представляют собой белки с характерными простетическими группами. В состав цепи
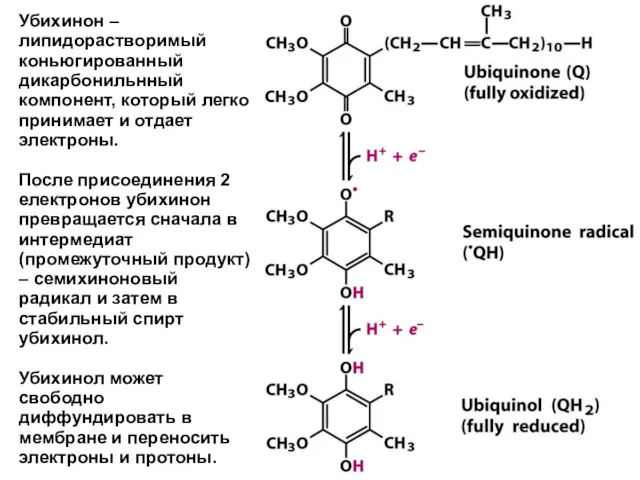
- 22. Убихинон – липидорастворимый коньюгированный дикарбонильнный компонент, который легко принимает и отдает электроны. После присоединения 2 електронов
- 23. Комплексы ЭТЦ Комплекс I переносит электроны от НАД(Ф)Н к убихинону Q. Его субстратом служит молекула внутримитохондриального
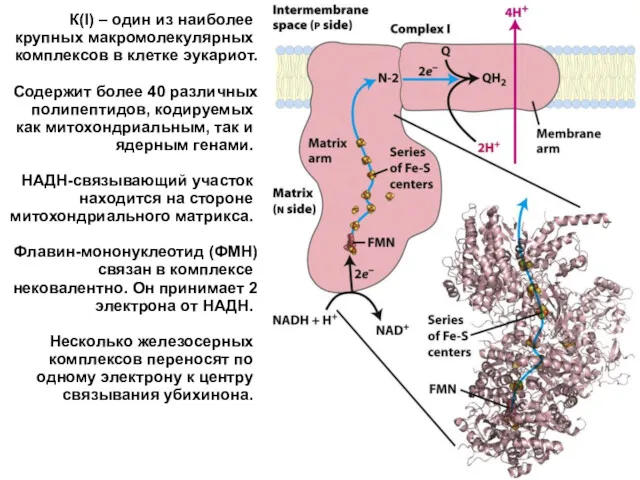
- 24. К(I) – один из наиболее крупных макромолекулярных комплексов в клетке эукариот. Содержит более 40 различных полипептидов,
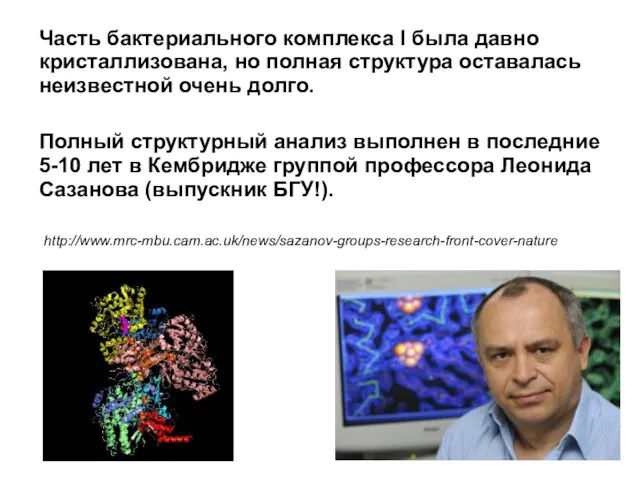
- 25. Часть бактериального комплекса I была давно кристаллизована, но полная структура оставалась неизвестной очень долго. Полный структурный
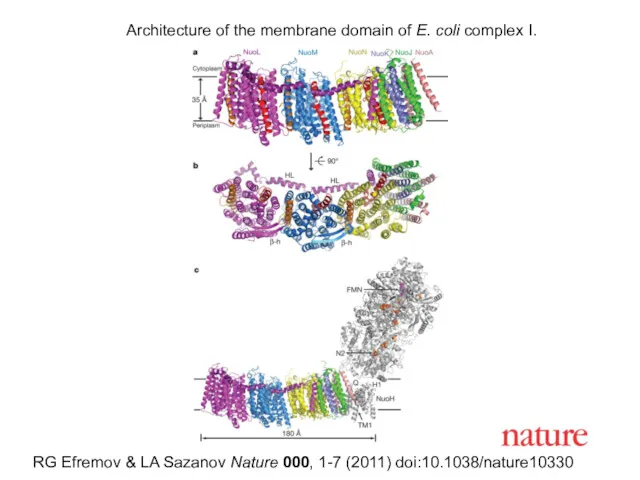
- 26. RG Efremov & LA Sazanov Nature 000, 1-7 (2011) doi:10.1038/nature10330 Architecture of the membrane domain of
- 27. НАД(Ф)Н: убихинон-оксидоредуктаза функционирует как протонная помпа перенос 2 электронов от НАДН на убихинон сопровождается транспортом 2
- 28. Комплексы ЭТЦ Комплекс II катализирует окисление сукцината убихиноном. Эту функцию выполняет флавиновая (ФАД-зависимая) сукцинат – убихинон-оксидоредуктаза,
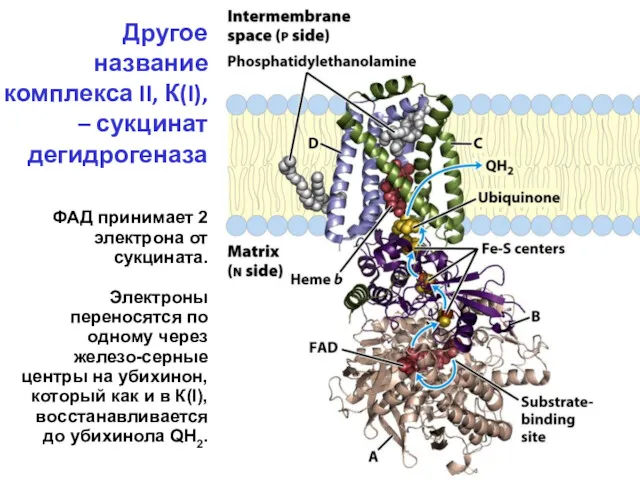
- 29. Другое название комплекса II, К(I), – сукцинат дегидрогеназа ФАД принимает 2 электрона от сукцината. Электроны переносятся
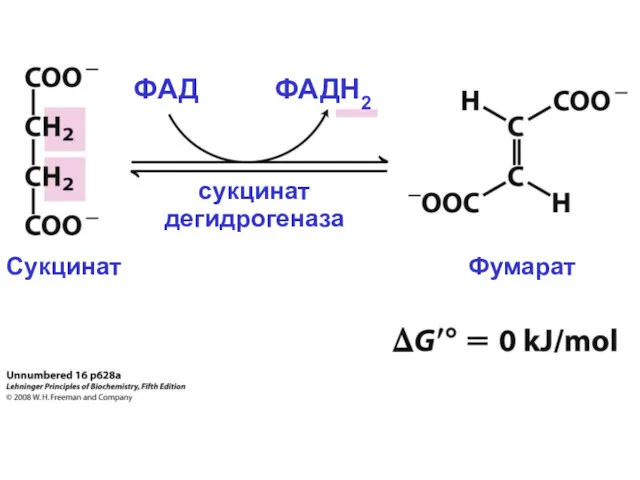
- 30. сукцинат дегидрогеназа ФАД ФАДН2 Сукцинат Фумарат
- 31. Комплексы ЭТЦ Комплекс III переносит электроны восстановленного убихинона к цитохрому с1, т. е. функционирует как убихинон
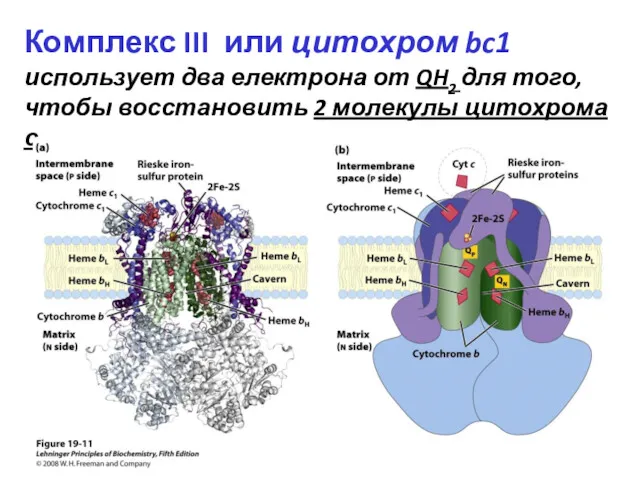
- 32. Комплекс III или цитохром bc1 использует два електрона от QH2 для того, чтобы восстановить 2 молекулы
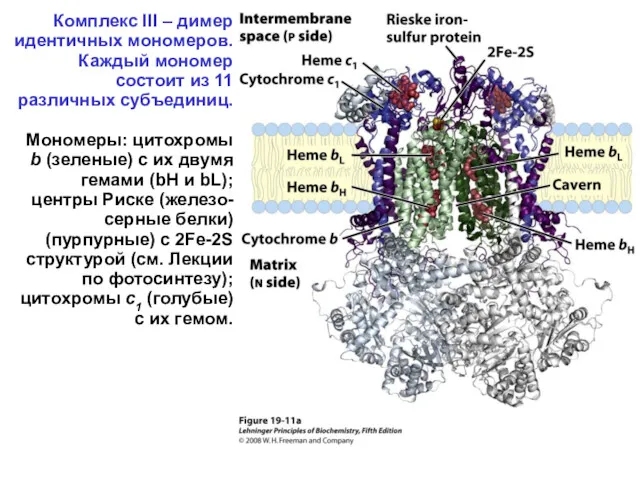
- 33. Комплекс III – димер идентичных мономеров. Каждый мономер состоит из 11 различных субъединиц. Мономеры: цитохромы b
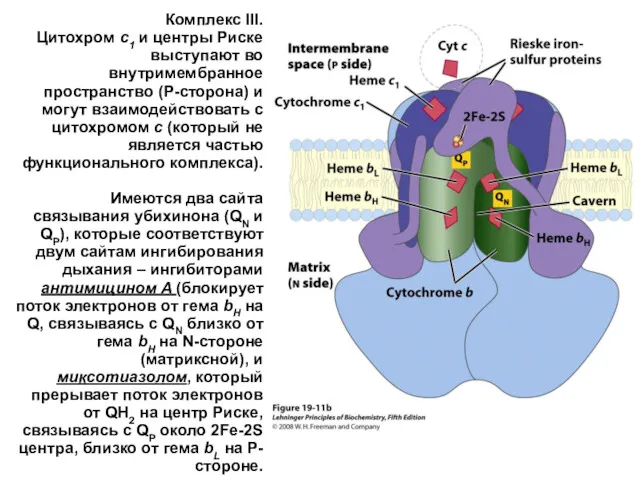
- 34. Комплекс III. Цитохром c1 и центры Риске выступают во внутримембранное пространство (P-сторона) и могут взаимодействовать с
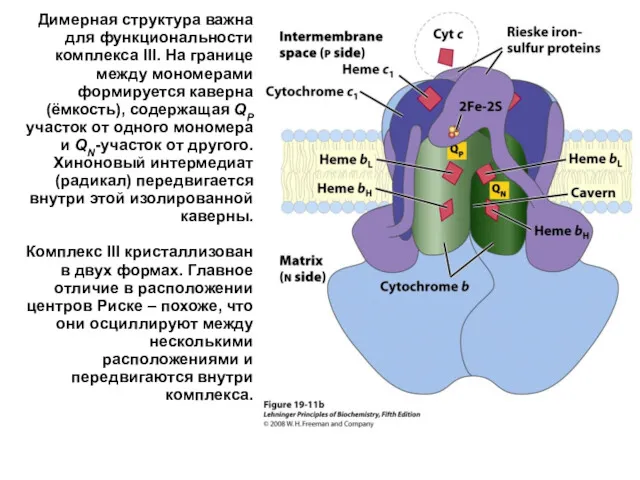
- 35. Димерная структура важна для функциональности комплекса III. На границе между мономерами формируется каверна (ёмкость), содержащая QP
- 36. В комплексе IV электроны переносятся от цитохрома с к кислороду, т. е. этот комплекс является цитохром
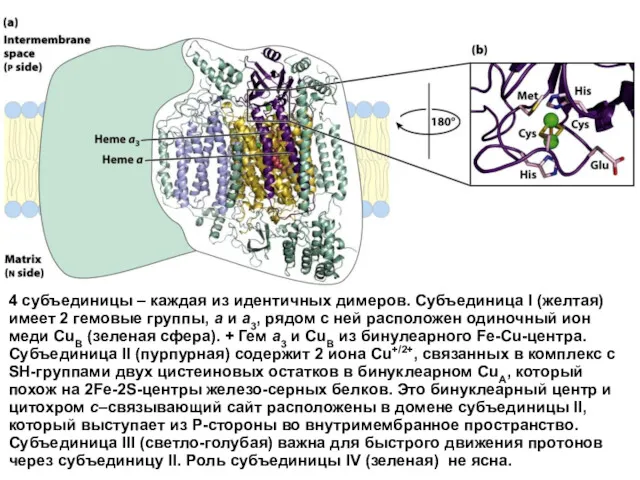
- 37. 4 субъединицы – каждая из идентичных димеров. Субъединица I (желтая) имеет 2 гемовые группы, a и
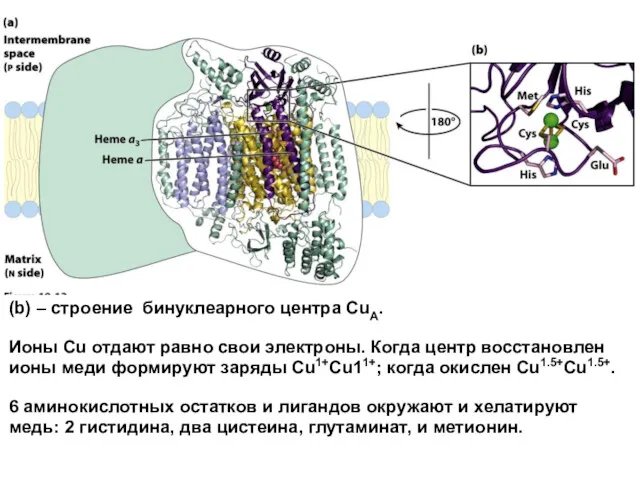
- 38. (b) – строение бинуклеарного центра CuA. Ионы Cu отдают равно свои электроны. Когда центр восстановлен ионы
- 39. Формула работы комплекса IV – «4 + 4 + 4» Четыре электрона используются для восстановления молекулы
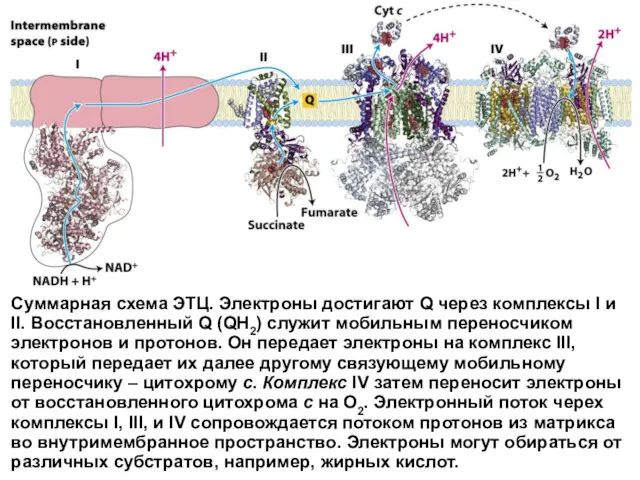
- 40. Суммарная схема ЭТЦ. Электроны достигают Q через комплексы I и II. Восстановленный Q (QH2) служит мобильным
- 41. Все компоненты цепи, за исключением убихинона представляют собой белки с характерными простетическими группами. В состав цепи
- 43. Скачать презентацию





















 Предмет та завдання ботаніки
Предмет та завдання ботаніки Жизнедеятельность организмов
Жизнедеятельность организмов Структура и организация генома, репликация ДНК
Структура и организация генома, репликация ДНК Остеоартросиндесмология. Виды соединения костей
Остеоартросиндесмология. Виды соединения костей Рацион возможностей нашей жизни
Рацион возможностей нашей жизни Периферический отдел нервной системы. Вегетативная нервная система
Периферический отдел нервной системы. Вегетативная нервная система Витамины
Витамины Технология выращивания овощных культур
Технология выращивания овощных культур Гипотезы секреции соляной кислоты
Гипотезы секреции соляной кислоты Электронный атлас по паразитологии. Раздел 2 Тип Ленточные черви. Часть 1 Сосальщики
Электронный атлас по паразитологии. Раздел 2 Тип Ленточные черви. Часть 1 Сосальщики Изменения в жизни домашних животных. Тред людей осенью. Урок 8
Изменения в жизни домашних животных. Тред людей осенью. Урок 8 Башкирский государственный природный заповедник
Башкирский государственный природный заповедник Защитим ель
Защитим ель Увеличительные приборы. Живые клетки
Увеличительные приборы. Живые клетки Многообразие микробного мира
Многообразие микробного мира ОГЭ по биологии 2019. Выполнение заданий №№ 25–28
ОГЭ по биологии 2019. Выполнение заданий №№ 25–28 Собаки: йоркширский терьер
Собаки: йоркширский терьер Животные зимой
Животные зимой Анатомия и физиология ЦНС. Свойства и принципы функционирования нервных центров. Строение СМ. Цереброспинальная жидкость
Анатомия и физиология ЦНС. Свойства и принципы функционирования нервных центров. Строение СМ. Цереброспинальная жидкость Железы внутренней секреции
Железы внутренней секреции Науки о человеке и их методы
Науки о человеке и их методы Обмен веществ и превращение энергии. Раздел 2
Обмен веществ и превращение энергии. Раздел 2 Путешествие в удивительный мир растений
Путешествие в удивительный мир растений Adaptation
Adaptation Терінің қосалқы мүшелері: тері және май бездері, шаш, тырнақ
Терінің қосалқы мүшелері: тері және май бездері, шаш, тырнақ Пресноводные рыбы
Пресноводные рыбы Эмбриональный период развития человека
Эмбриональный период развития человека урок биологии в 7 классе Внешнее и внутреннее строение насекомых
урок биологии в 7 классе Внешнее и внутреннее строение насекомых