Содержание
- 2. - Гидроксикарбонильные соединения (оксиальдегиды, оксикетоны) глицериновый альдегид диоксиацетон
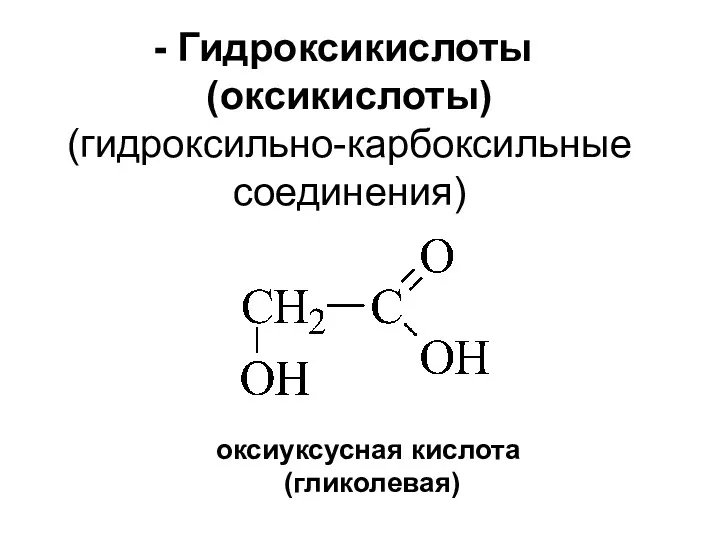
- 3. Гидроксикислоты (оксикислоты) (гидроксильно-карбоксильные соединения) оксиуксусная кислота (гликолевая)
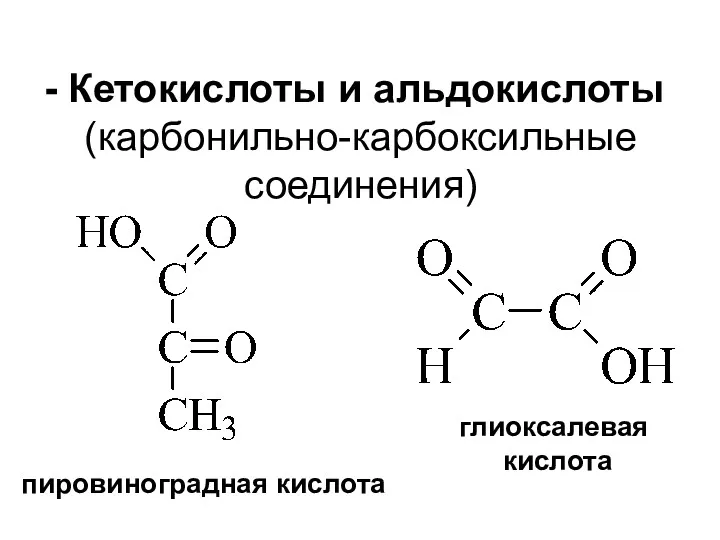
- 4. Кетокислоты и альдокислоты (карбонильно-карбоксильные соединения) пировиноградная кислота глиоксалевая кислота
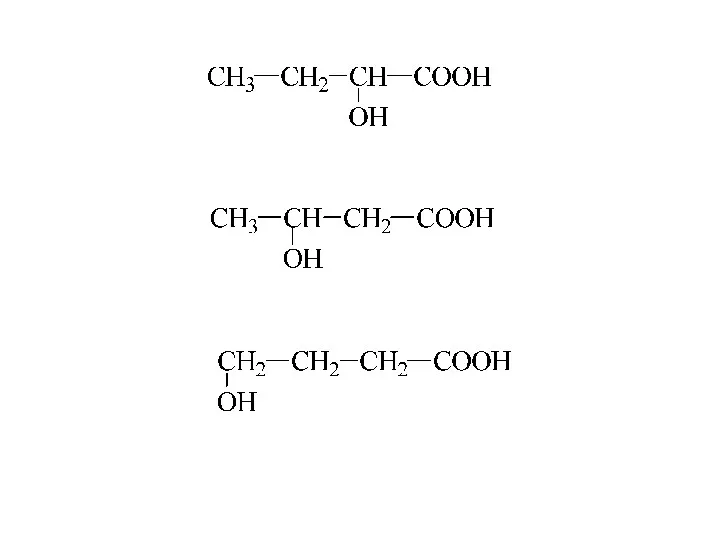
- 5. Гидроксикислоты
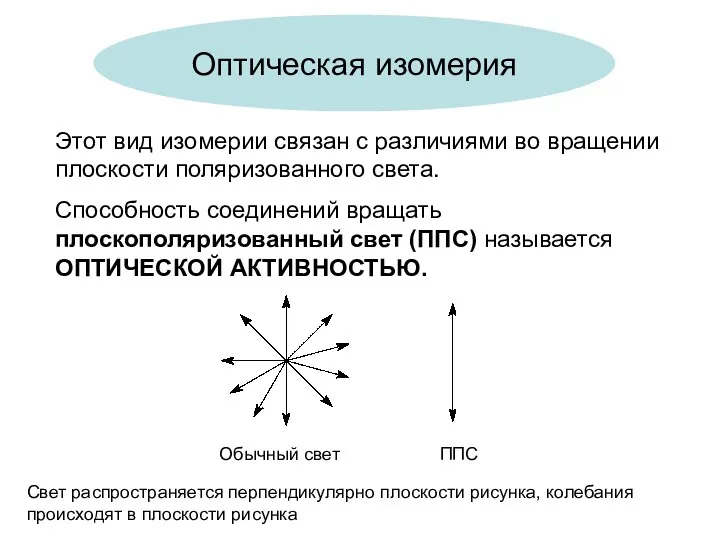
- 8. Оптическая изомерия Этот вид изомерии связан с различиями во вращении плоскости поляризованного света. Способность соединений вращать
- 9. Оптически активным веществом является вещество, которое вращает плоскость поляризованного света. Когда луч такого света, колебания которого
- 10. Оптически активные соединения имеют асимметрический атом углерода – атом, который связан с 4 различными атомами или
- 11. Связь пространственного строения соединений с их биологической активностью Биохимические процессы стереоспецифичны: в реакцию вовлекаются определённые стереоизомеры
- 12. Связь пространственного строения соединений с их биологической активностью Многие лекарственные вещества проявляют фармакологический эффект при взаимодействии
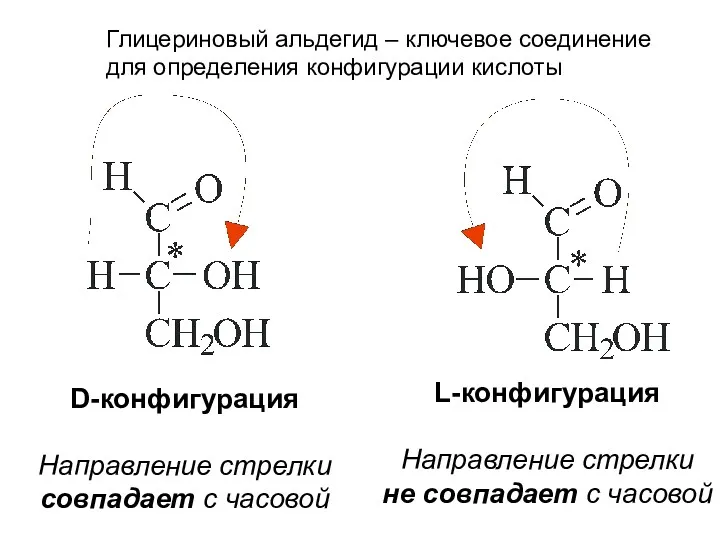
- 13. D-конфигурация Направление стрелки совпадает с часовой L-конфигурация Направление стрелки не совпадает с часовой Глицериновый альдегид –
- 14. «+» - правое вращение «-» - левое вращение
- 15. D (-) D (-) L (+)
- 16. Рацемическая смесь Рацемическая смесь
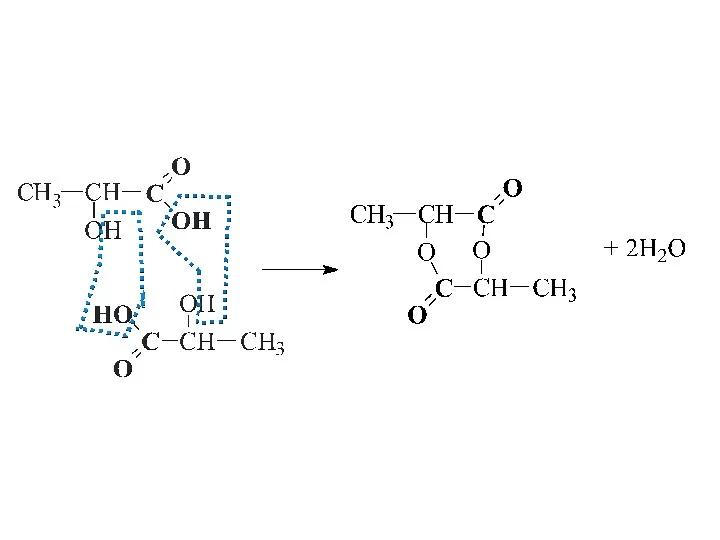
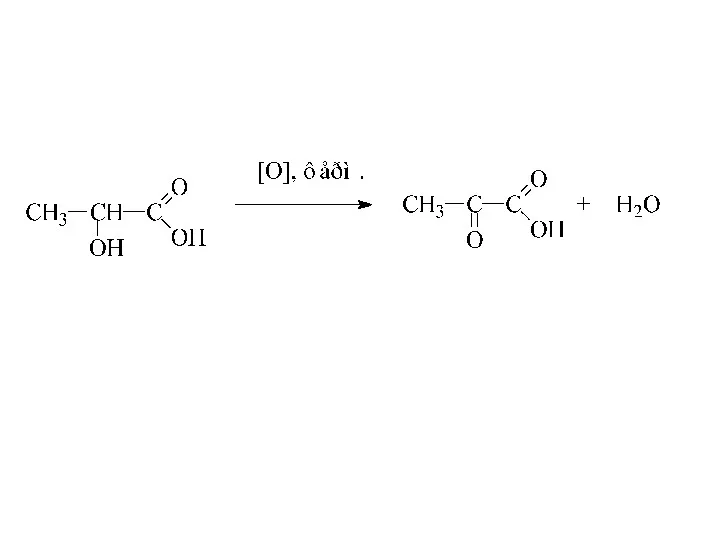
- 17. Специфические свойства оксикислот
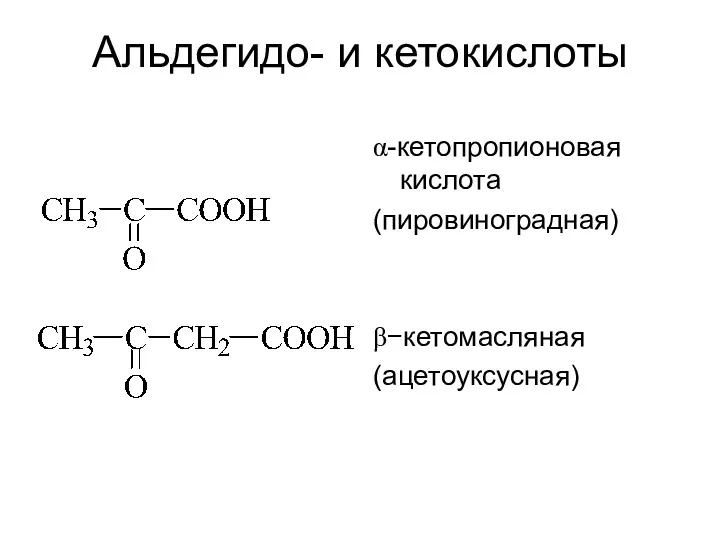
- 21. Альдегидо- и кетокислоты α-кетопропионовая кислота (пировиноградная) β−кетомасляная (ацетоуксусная)
- 22. кетоянтарная (щавелевоуксусная) α−кетоглутаровая
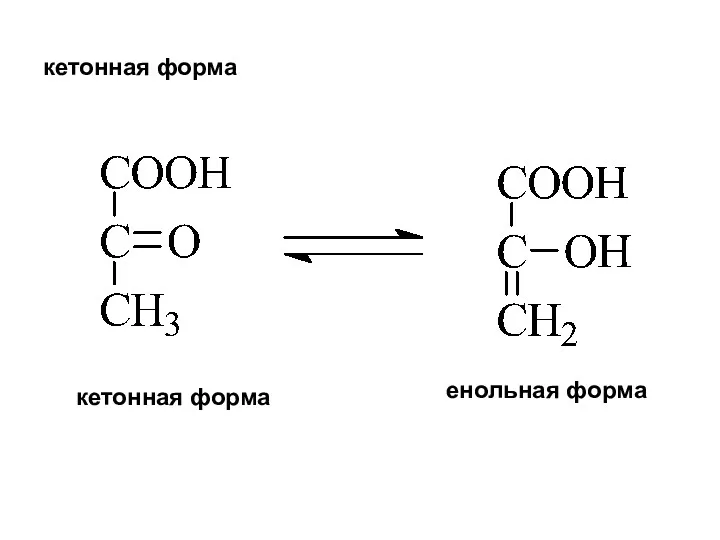
- 23. кетонная форма кетонная форма енольная форма
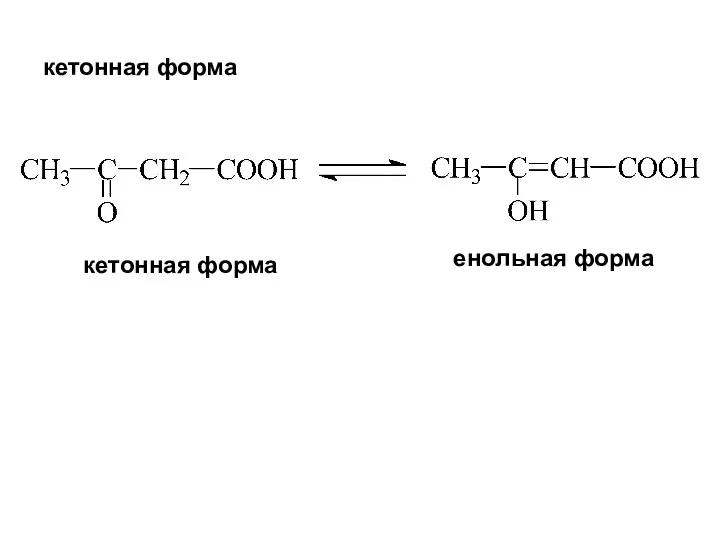
- 26. кетонная форма кетонная форма енольная форма
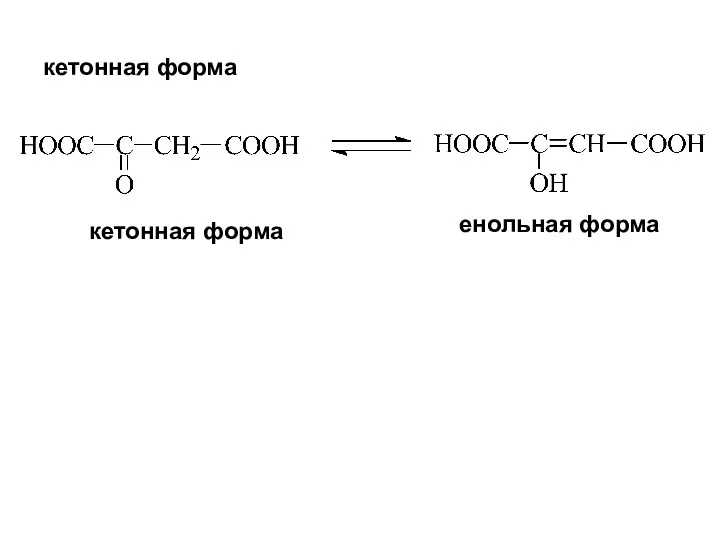
- 27. кетонная форма кетонная форма енольная форма
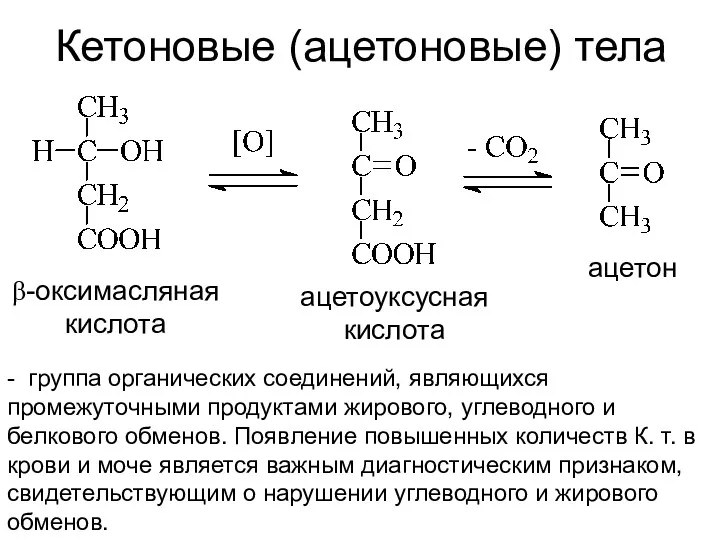
- 28. Кетоновые (ацетоновые) тела β-оксимасляная кислота ацетоуксусная кислота ацетон - группа органических соединений, являющихся промежуточными продуктами жирового,
- 29. Кето́новые тела́ (синоним ацетоновые тела) группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов.
- 30. УГЛЕВОДЫ
- 31. Углеводы Входят в состав клеток и тканей всех растительных и животных организмов. По массе составляют основную
- 32. Углеводы Источники энергии в метаболических процессах (крахмал, гликоген) Структурные компоненты клеточных стенок (целлюлоза, хитин и др.)
- 33. Образуются в растениях в процессе фотосинтеза из диоксида углерода и воды. Животные организмы не способны синтезировать
- 34. Класс углеводов (сахаров, карбогидратов) объединяет соединения, имеющие состав СnH2nOn и обладающие при этом весьма разнообразными свойствами.
- 36. По способности к гидролизу: - Моносахариды (простые сахара, монозы) не гидролизуются с образованием более простых углеводов.
- 37. Моносахариды Гетерофункциональные соединения, содержат одновременно карбонильную и несколько гидроксильных групп: - полигидроксиальдегиды (альдозы) - полигидроксикетоны (кетозы)
- 38. Все моносахариды представляют собой кристаллические вещества, хорошо растворимые в воде и обладающие, как правило, сладким вкусом.
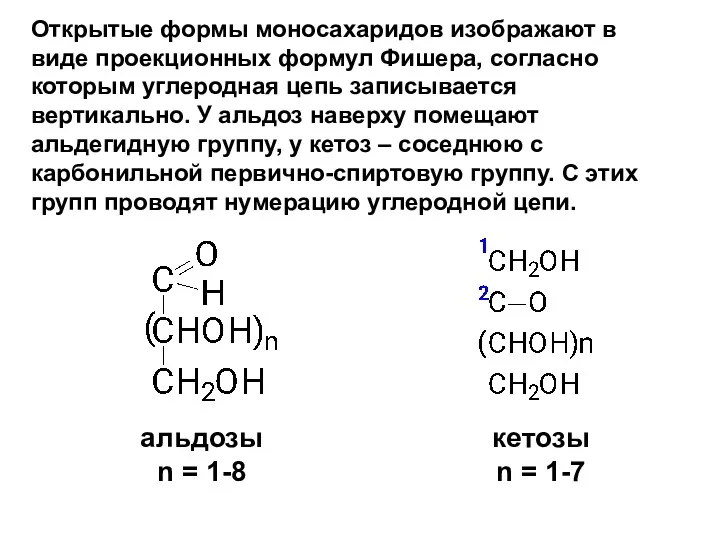
- 39. Открытые формы моносахаридов изображают в виде проекционных формул Фишера, согласно которым углеродная цепь записывается вертикально. У
- 40. В зависимости от длины углеродной цепи (3 – 10 атомов): - триозы - тетрозы - пентозы
- 41. Наличие в молекулах моносахаридов нескольких центров хиральности – причина существования большого числа стереоизомеров, соответствующих одной и
- 42. Альдогексоза HOCH2(*CHOH)4CHO число стереоизомеров = 24 = 16 (8 пар энантиомеров) В биологических средах преимущественно распространены
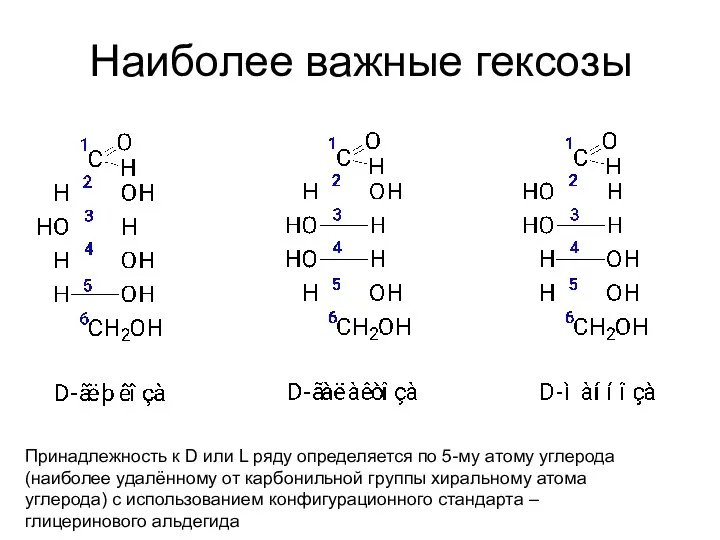
- 43. Наиболее важные гексозы Принадлежность к D или L ряду определяется по 5-му атому углерода (наиболее удалённому
- 44. Наиболее важные гексозы
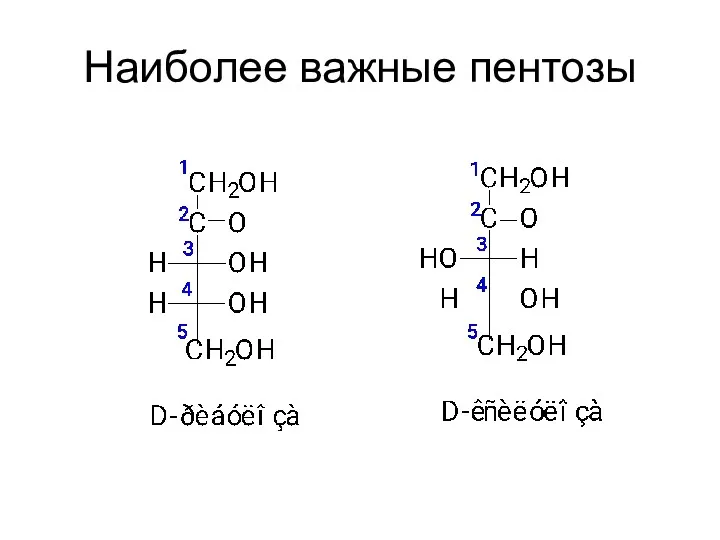
- 45. Наиболее важные пентозы
- 46. Наиболее важные пентозы
- 47. Циклические формы - по химической природе являются циклическими полуацеталями. Моносахариды за счет внутримолекулярного взаимодействия сближенных в
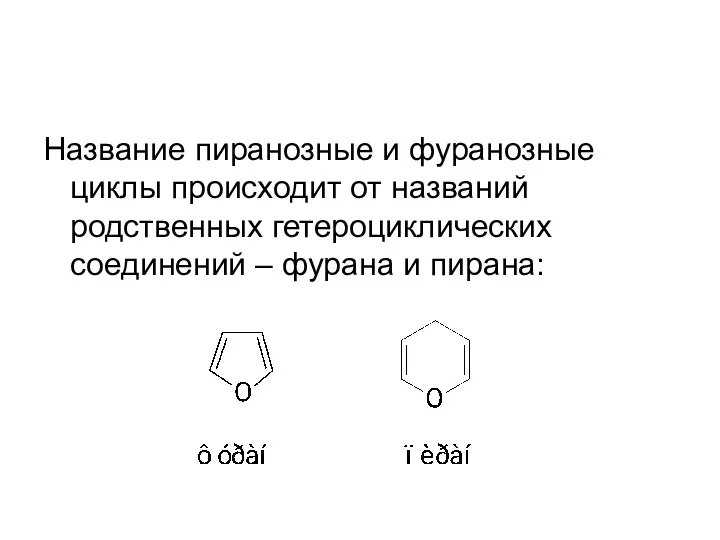
- 48. Название пиранозные и фуранозные циклы происходит от названий родственных гетероциклических соединений – фурана и пирана:
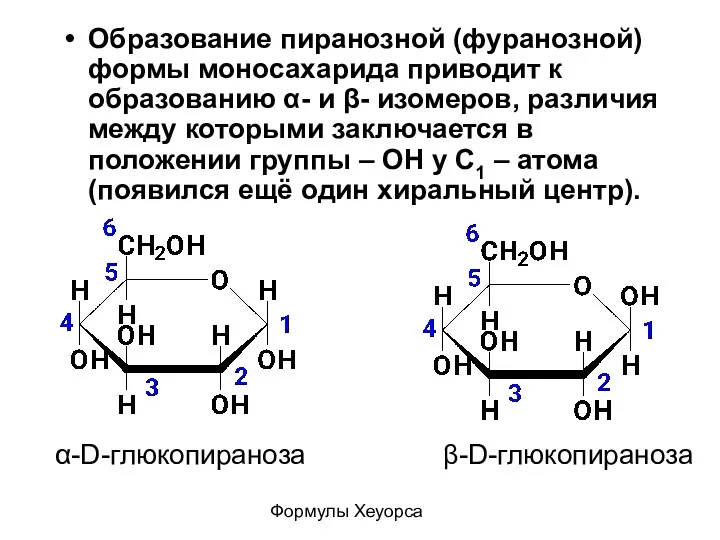
- 49. Образование пиранозной (фуранозной) формы моносахарида приводит к образованию α- и β- изомеров, различия между которыми заключается
- 50. Появившаяся дополнительная гидроксильная группа, связанная с С1 – атомом, называется гликозидной (полуацетальной). По свойствам она значительно
- 51. В растворах сахаров при стоянии наблюдается изменение угла отклонения плоскости поляризованного света, т.е. изменение оптической активности
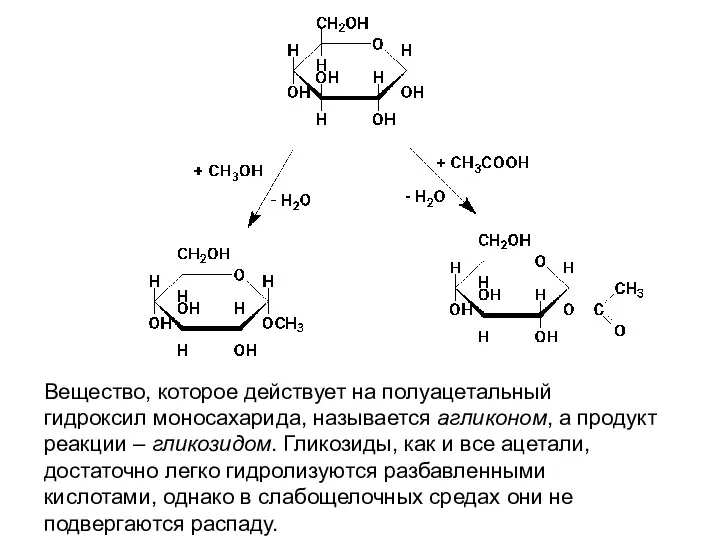
- 52. ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ I. Химические реакции с участием гидроксильных групп. I.1. Полуацетальный гидроксил непрочно связан с
- 53. Вещество, которое действует на полуацетальный гидроксил моносахарида, называется агликоном, а продукт реакции – гликозидом. Гликозиды, как
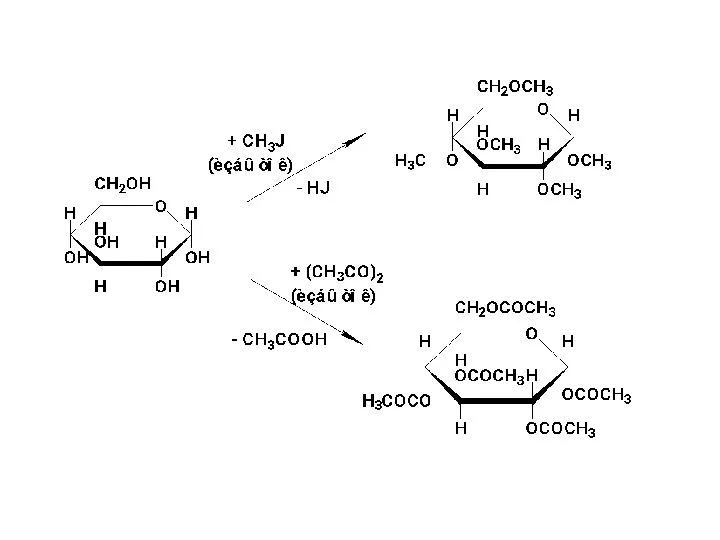
- 54. I.2. При определённых условиях в реакцию вступает не только полуацетальный гидроксил, но и имеющиеся в молекуле
- 56. Наибольшее значение среди эфиров моносахаридов имеют эфиры фосфорной кислоты – фосфаты. Они содержатся во всех растительных
- 57. I.3. Образование аминосахаров замещением гидроксильной группы на аминогруппу α−глюкоза глюкозамин
- 58. Ацетилирование аминосахаров глюкозамин ацетилированный глюкозамин Входит в состав опорных тканей и роговицы глаз
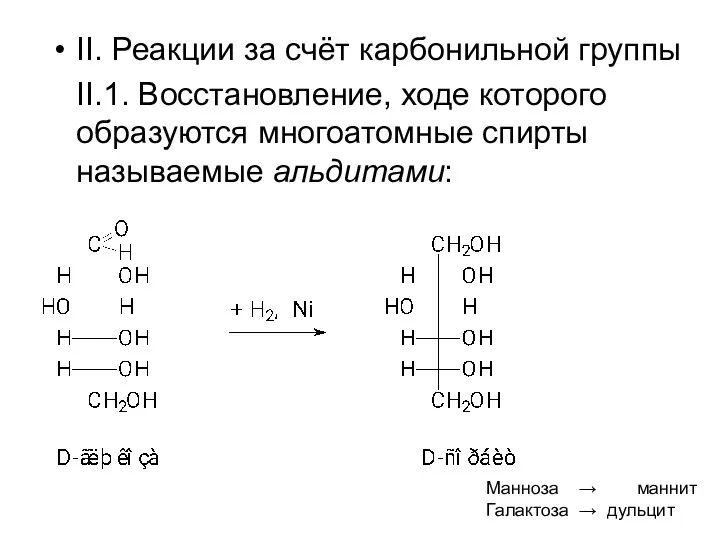
- 59. II. Реакции за счёт карбонильной группы II.1. Восстановление, ходе которого образуются многоатомные спирты называемые альдитами: Манноза
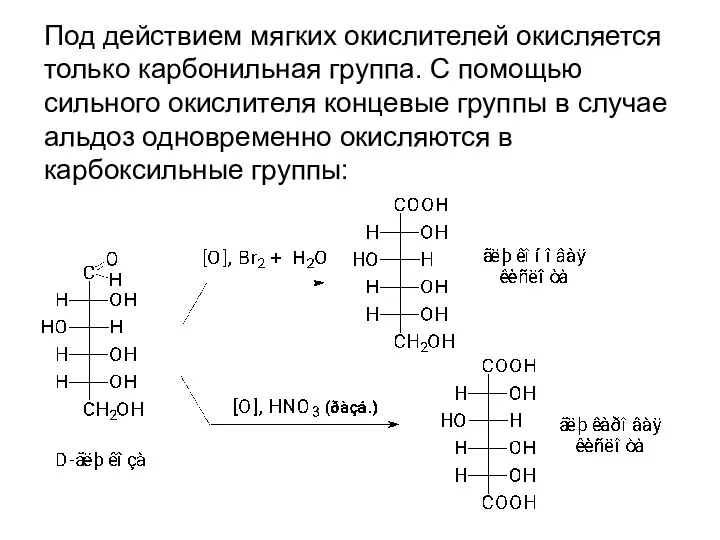
- 60. II.2. Окисление - важная реакция в химии углеводов. Его используют для получения ряда соединений в структурных
- 61. Под действием мягких окислителей окисляется только карбонильная группа. С помощью сильного окислителя концевые группы в случае
- 63. Скачать презентацию







































 Сходства и различия клеток растений, животных и грибов
Сходства и различия клеток растений, животных и грибов Использование дрожжевых грибов для производства разных групп продуктов
Использование дрожжевых грибов для производства разных групп продуктов Открытое мероприятие по профилактике вредных привычек
Открытое мероприятие по профилактике вредных привычек Бактерії - прокаріотичні одноклітинні мікроорганізми
Бактерії - прокаріотичні одноклітинні мікроорганізми Влияние ГМО на организм человека
Влияние ГМО на организм человека Общая физиология сенсорных систем
Общая физиология сенсорных систем Половое поведение животных
Половое поведение животных Дыхание растений
Дыхание растений Круговорот кислорода в природе
Круговорот кислорода в природе Звёздный час. Загадки о животных и растениях
Звёздный час. Загадки о животных и растениях Популяция. Популяционная генетика
Популяция. Популяционная генетика Сахароза. Дисахариды (олигосахариды)
Сахароза. Дисахариды (олигосахариды) Клетки и их разнообразие в многоклеточном организме
Клетки и их разнообразие в многоклеточном организме Основы гистологии. Виды тканей
Основы гистологии. Виды тканей An introduction to metabolism
An introduction to metabolism Глюкоза. Молекулярна формула. Фізичні та хімічні властивості глюкози. Поширення в природі
Глюкоза. Молекулярна формула. Фізичні та хімічні властивості глюкози. Поширення в природі 20231101_vestniki_vesny_viktorina
20231101_vestniki_vesny_viktorina Глаз
Глаз Cattle breeds
Cattle breeds Как зимой помочь птицам (урок окружающего мира, 1 класс)
Как зимой помочь птицам (урок окружающего мира, 1 класс) Эффективный способ посадки картофеля
Эффективный способ посадки картофеля Мы говорим Нет алкоголю!
Мы говорим Нет алкоголю! Физиология растений. Механизмы поступления воды в растительную клетку. Дальний транспорт воды в растении
Физиология растений. Механизмы поступления воды в растительную клетку. Дальний транспорт воды в растении Презентация по биологии для 9 класса по теме:Метаболизм. Энергетический обмен.
Презентация по биологии для 9 класса по теме:Метаболизм. Энергетический обмен. Животные Антарктиды
Животные Антарктиды Красная книга Удмуртии. Животные
Красная книга Удмуртии. Животные Кератин в волосах и восстановление волос
Кератин в волосах и восстановление волос Катархей. Архей
Катархей. Архей