Содержание
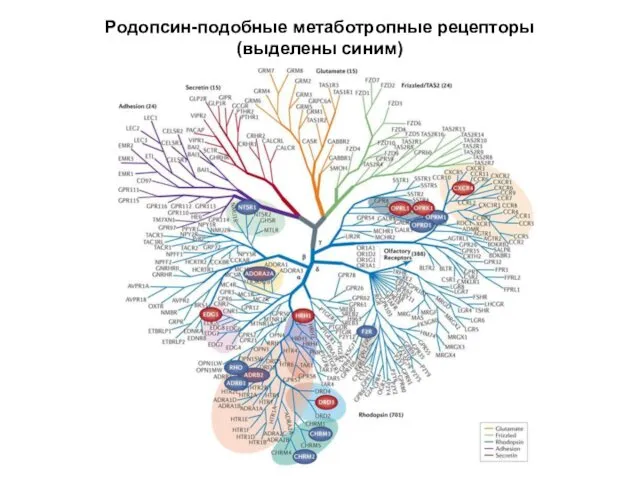
- 2. Родопсин-подобные метаботропные рецепторы (выделены синим)
- 3. Ацетилхолиновые метаботропные рецепторы Агонисты: АцХ, карбахол, мускарин Антагонисты: атропин, скополамин, галламин мАцХР локализованы в мембранах различных
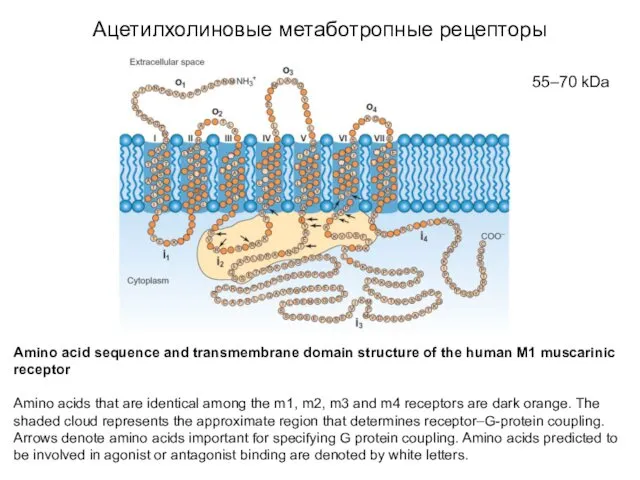
- 4. Ацетилхолиновые метаботропные рецепторы Аmino acid sequence and transmembrane domain structure of the human M1 muscarinic receptor
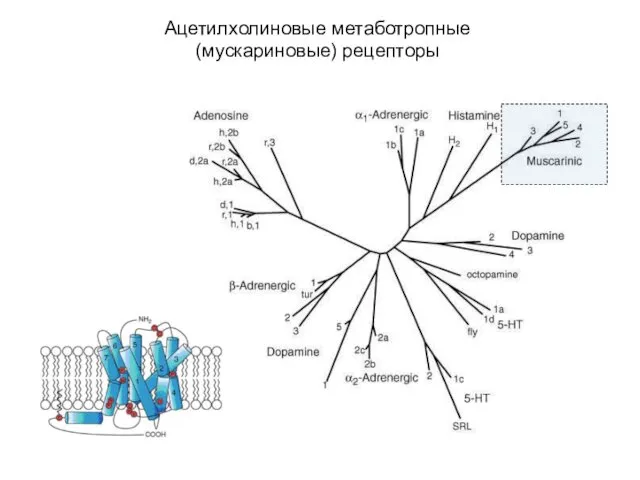
- 5. Ацетилхолиновые метаботропные (мускариновые) рецепторы
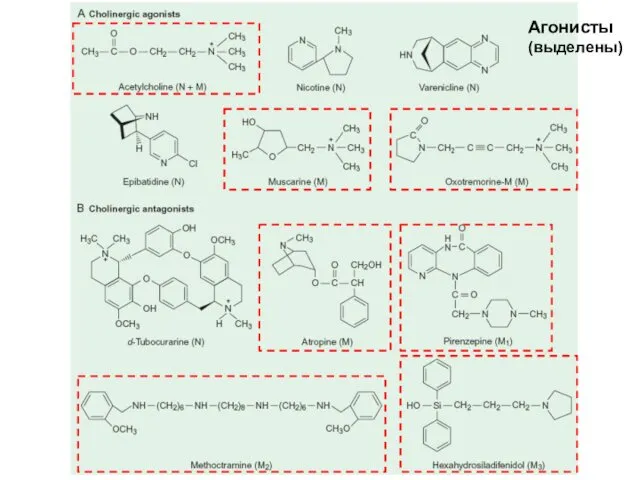
- 6. Агонисты (выделены)
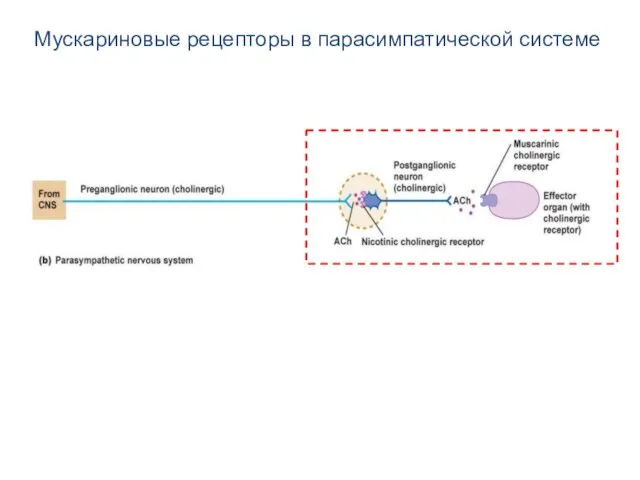
- 7. Мускариновые рецепторы в парасимпатической системе
- 8. Ацетилхолиновые метаботропные рецепторы
- 9. Ацетилхолиновые метаботропные рецепторы Выделено 5 подтипов мускариновых рецепторов - М(1-5)
- 10. Ацетилхолиновые метаботропные рецепторы Выделено 5 подтипов мускариновых рецепторов - мАцХР(1-5)
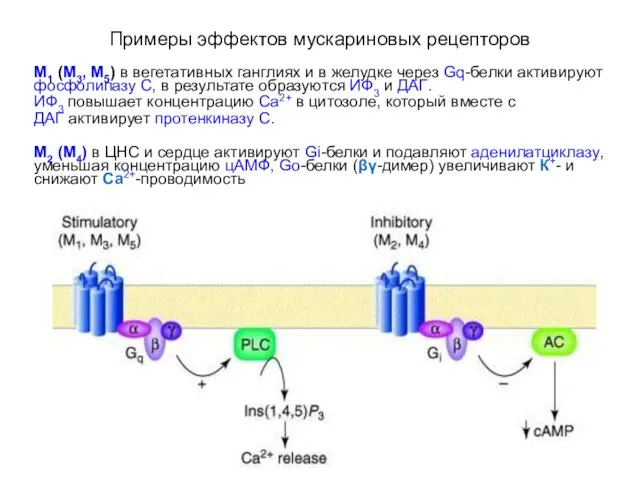
- 11. Примеры эффектов мускариновых рецепторов М1 (М3, М5) в вегетативных ганглиях и в желудке через Gq-белки активируют
- 12. Примеры эффектов мускариновых рецепторов M1 receptor This receptor is found mediating slow EPSP at the ganglion
- 13. Примеры эффектов мускариновых рецепторов M3 receptor The M3 muscarinic receptors are located at many places in
- 14. Примеры эффектов мускариновых рецепторов M4 receptor M4 receptors are found in the CNS. Receptors work via
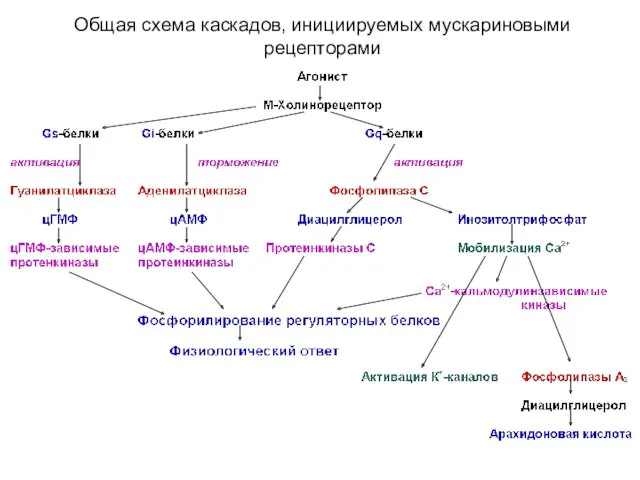
- 15. Общая схема каскадов, инициируемых мускариновыми рецепторами
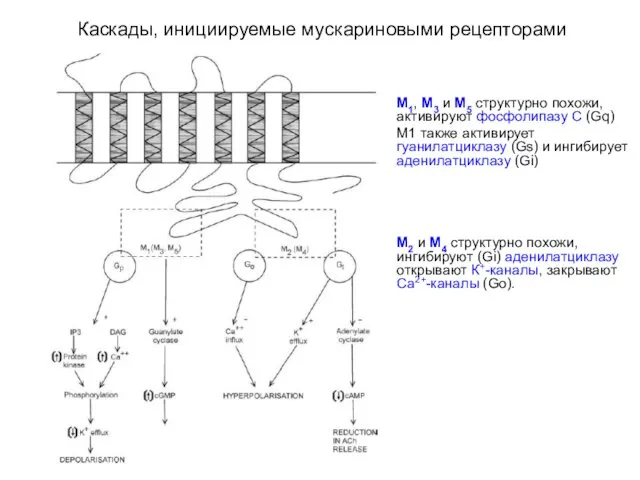
- 16. Каскады, инициируемые мускариновыми рецепторами М1, М3 и М5 структурно похожи, активируют фосфолипазу С (Gq) М1 также
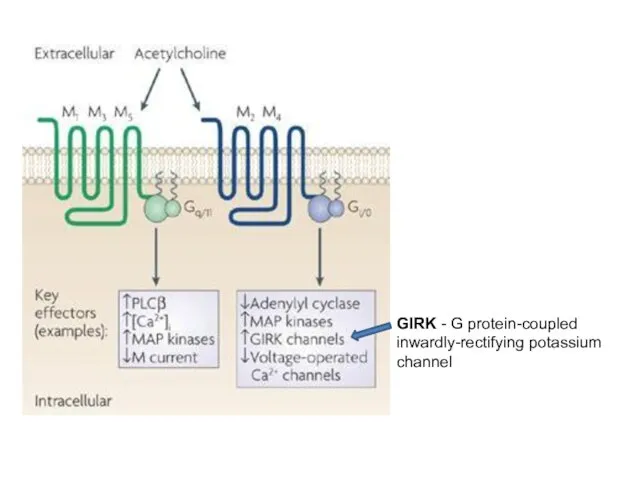
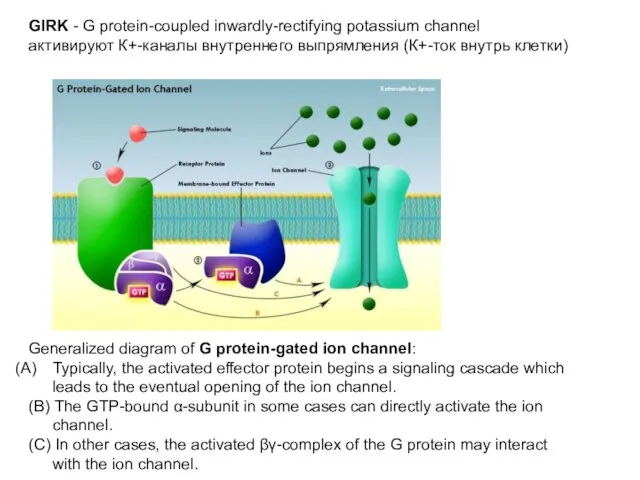
- 17. GIRK - G protein-coupled inwardly-rectifying potassium channel
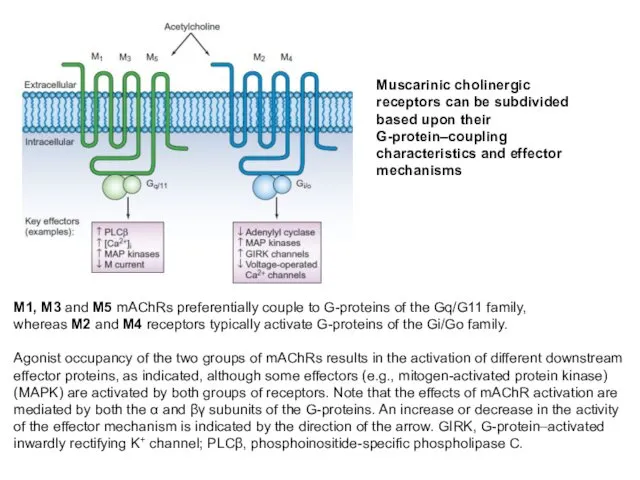
- 18. M1, M3 and M5 mAChRs preferentially couple to G-proteins of the Gq/G11 family, whereas M2 and
- 19. Ацетилхолиновые метаботропные рецепторы: эффекты активации The M1, M3 and M5 mAChRs preferentially couple to G-proteins of
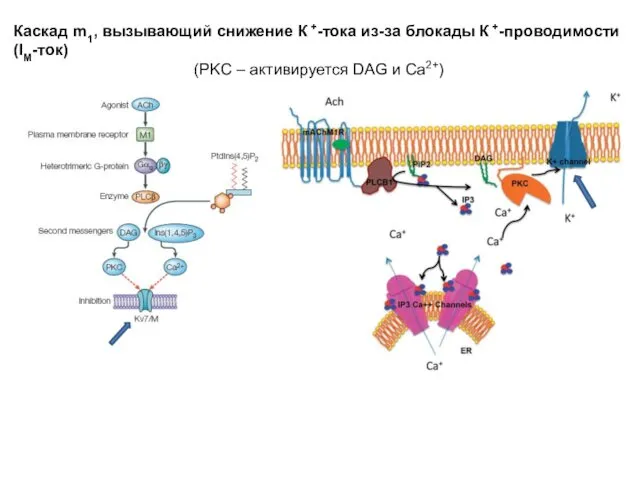
- 20. Каскад m1, вызывающий снижение К +-тока из-за блокады К +-проводимости (IM-ток) (PKC – активируется DAG и
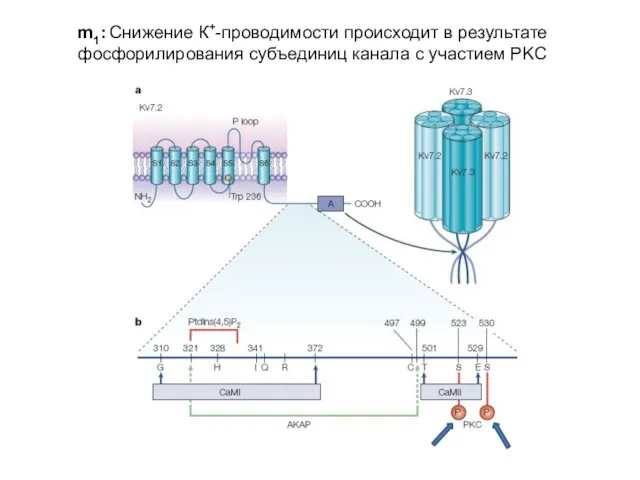
- 21. m1: Снижение К+-проводимости происходит в результате фосфорилирования субъединиц канала с участием PKC
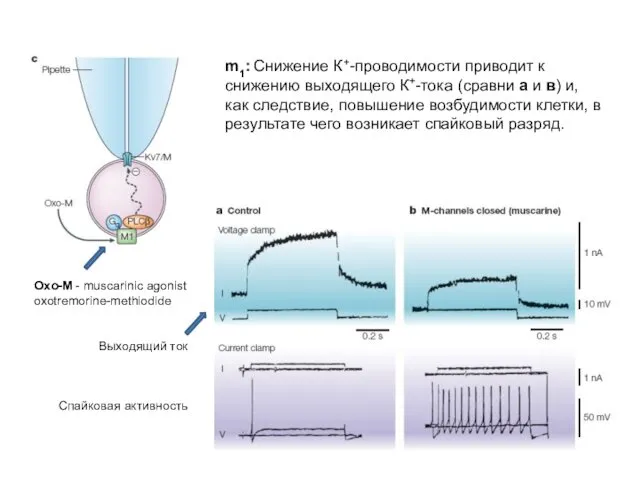
- 22. m1: Снижение К+-проводимости приводит к снижению выходящего К+-тока (сравни а и в) и, как следствие, повышение
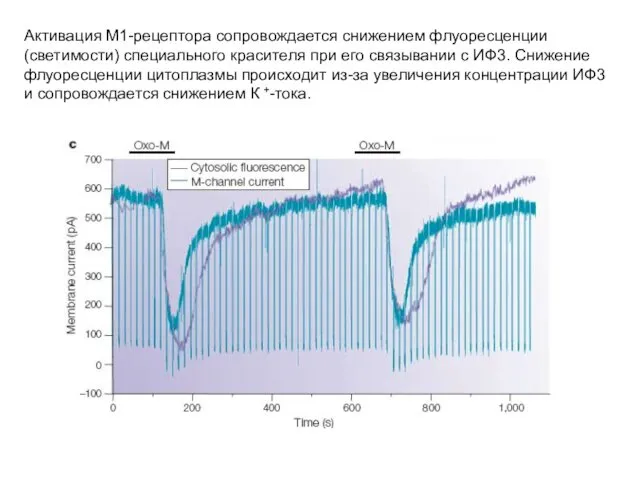
- 23. Активация М1-рецептора сопровождается снижением флуоресценции (светимости) специального красителя при его связывании с ИФ3. Снижение флуоресценции цитоплазмы
- 24. Ацетилхолиновые метаботропные рецепторы: эффекты активации One of the major consequences of the activation of either M2
- 25. Generalized diagram of G protein-gated ion channel: Typically, the activated effector protein begins a signaling cascade
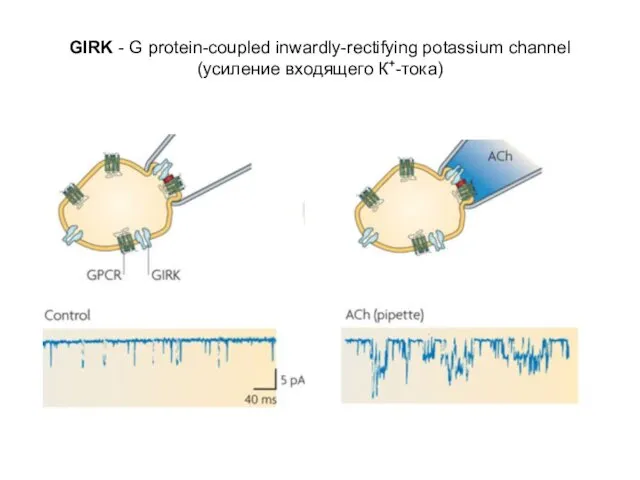
- 26. GIRK - G protein-coupled inwardly-rectifying potassium channel (усиление входящего К+-тока)
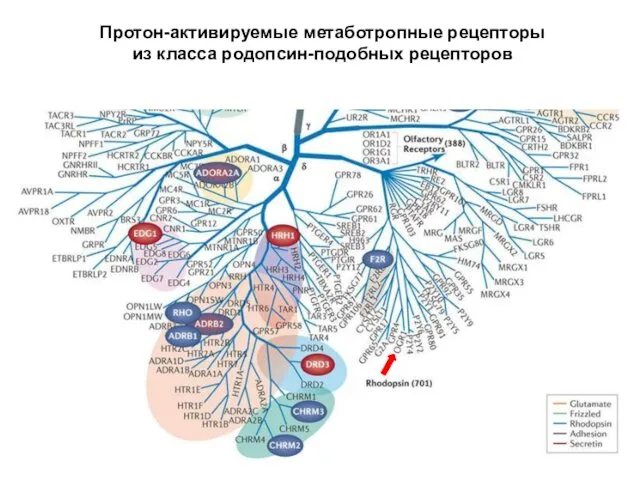
- 27. Протон-активируемые метаботропные рецепторы из класса родопсин-подобных рецепторов
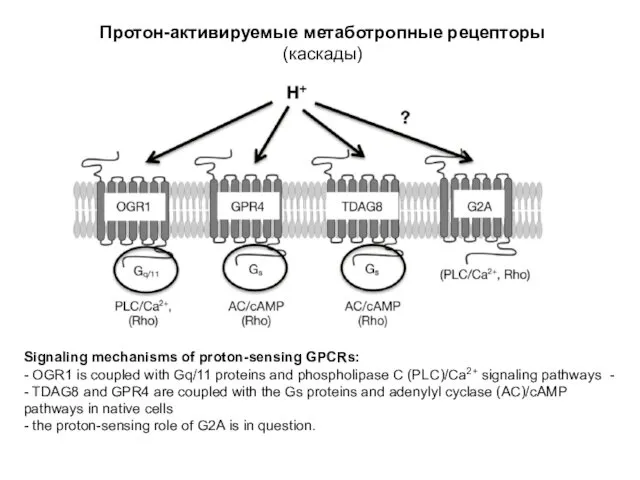
- 28. Протон-активируемые метаботропные рецепторы (каскады) Signaling mechanisms of proton-sensing GPCRs: - OGR1 is coupled with Gq/11 proteins
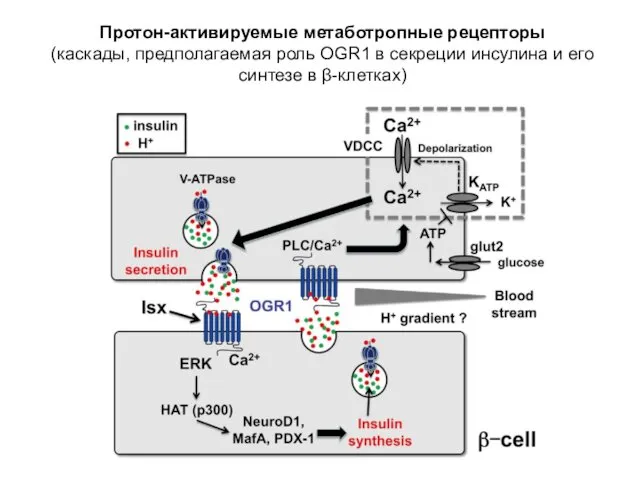
- 29. Протон-активируемые метаботропные рецепторы (каскады, предполагаемая роль OGR1 в секреции инсулина и его синтезе в β-клетках)
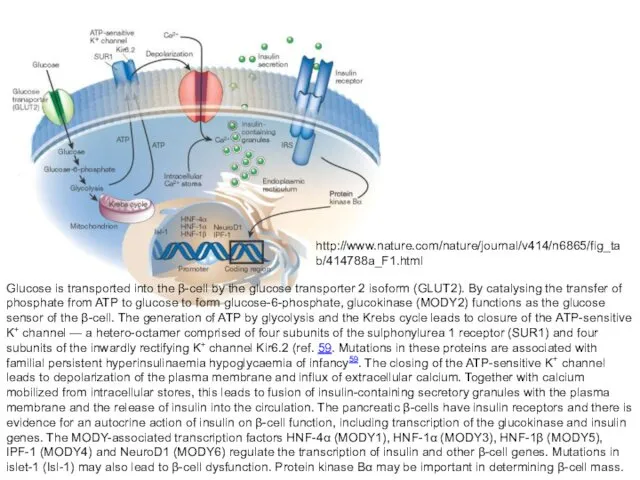
- 30. Glucose is transported into the β-cell by the glucose transporter 2 isoform (GLUT2). By catalysing the
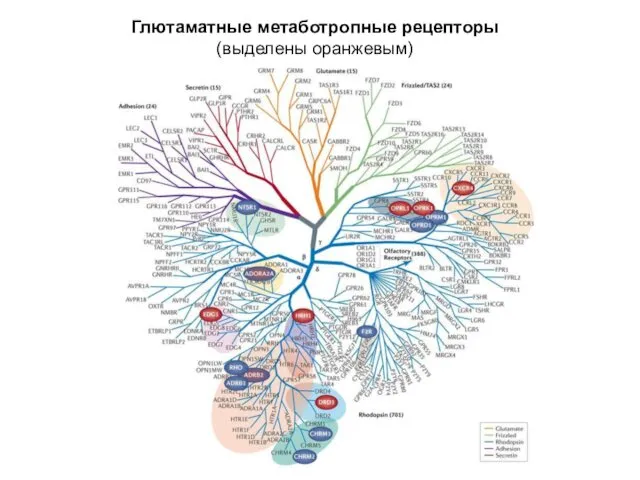
- 31. Глютаматные метаботропные рецепторы (выделены оранжевым)
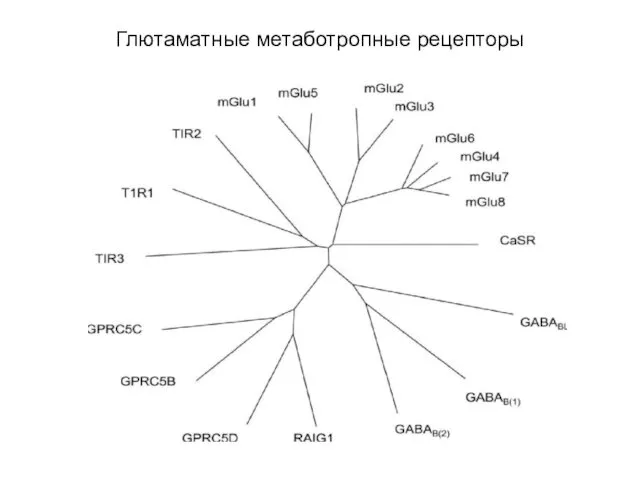
- 32. Глютаматные метаботропные рецепторы
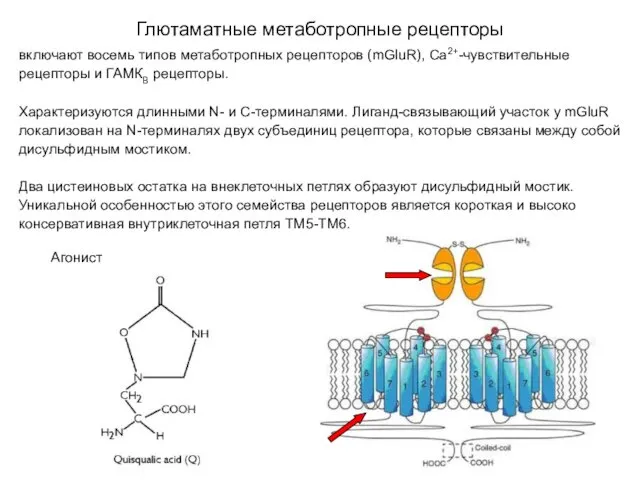
- 33. Глютаматные метаботропные рецепторы включают восемь типов метаботропных рецепторов (mGluR), Са2+-чувствительные рецепторы и ГАМКВ рецепторы. Характеризуются длинными
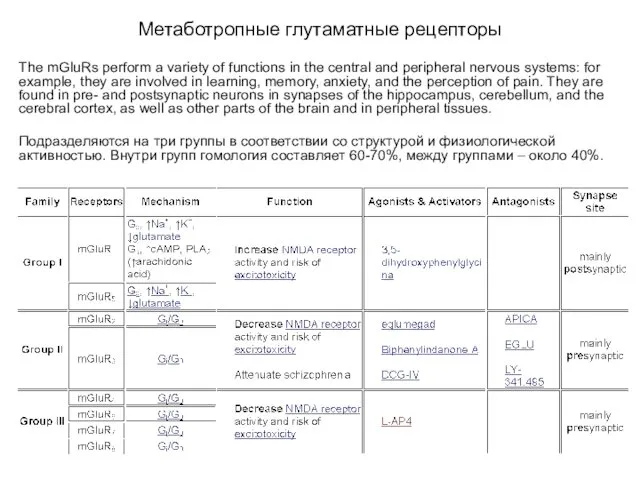
- 34. Метаботропные глутаматные рецепторы The mGluRs perform a variety of functions in the central and peripheral nervous
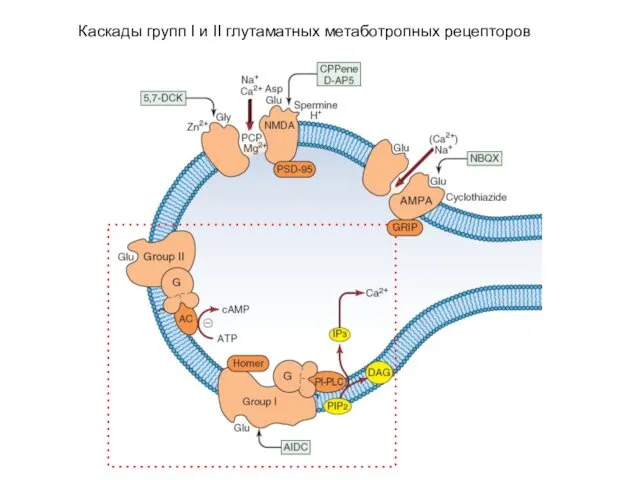
- 35. Каскады групп I и II глутаматных метаботропных рецепторов
- 36. Метаботропные глутаматные рецепторы Group I The mGluRs in group I, including mGluR1 and mGluR5, are stimulated
- 37. Метаботропные глутаматные рецепторы Group II & Group III The receptors in group II, including mGluRs 2
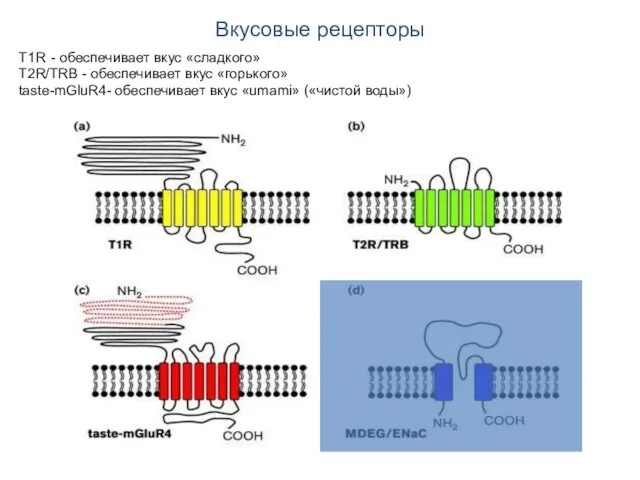
- 38. Вкусовые рецепторы T1R - обеспечивает вкус «сладкого» T2R/TRB - обеспечивает вкус «горького» taste-mGluR4- обеспечивает вкус «umami»
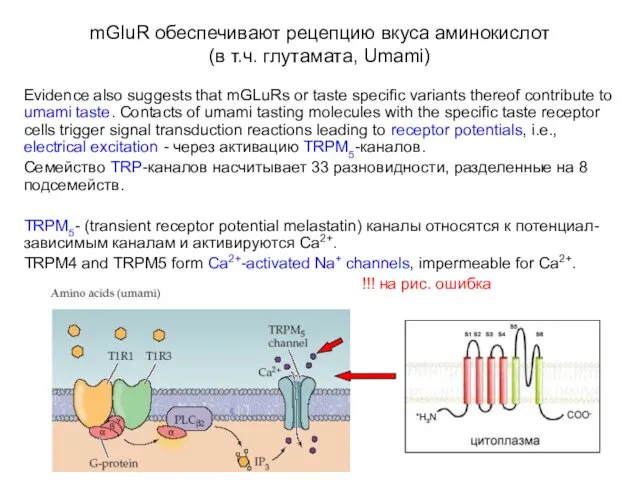
- 39. mGluR обеспечивают рецепцию вкуса аминокислот (в т.ч. глутамата, Umami) Evidence also suggests that mGLuRs or taste
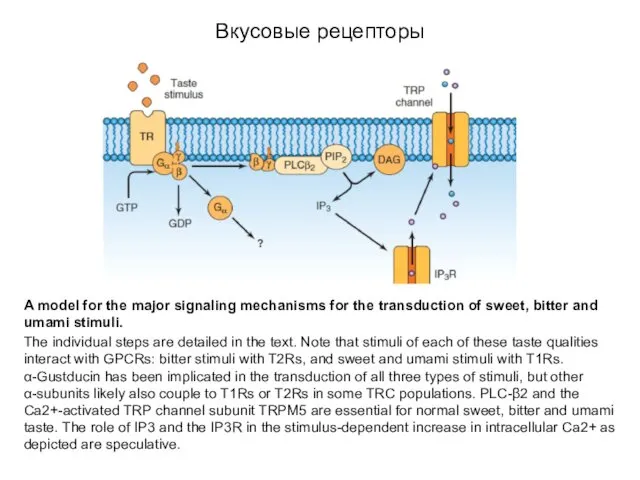
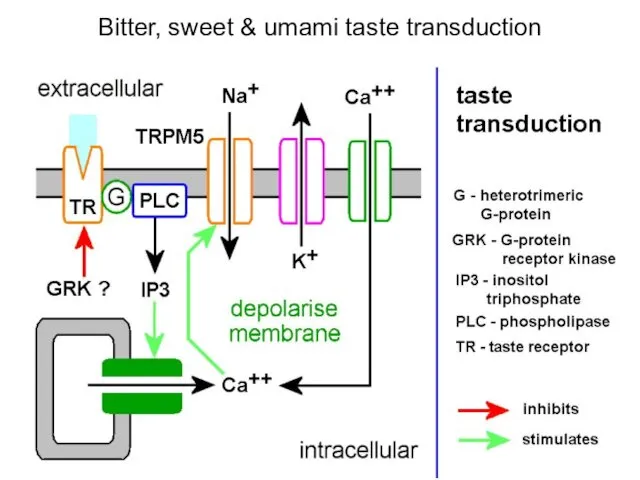
- 40. Вкусовые рецепторы A model for the major signaling mechanisms for the transduction of sweet, bitter and
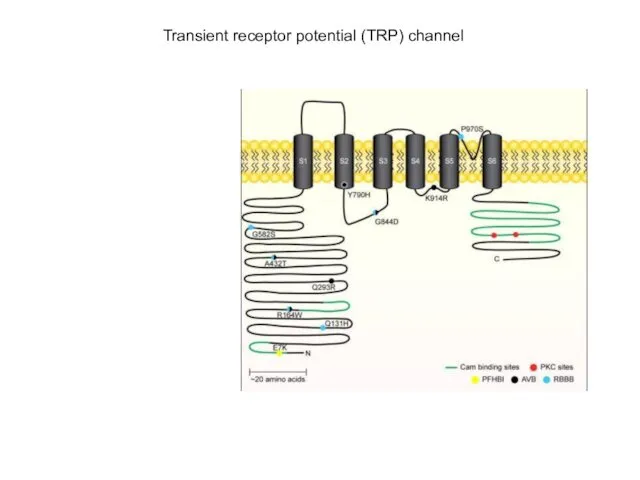
- 41. Transient receptor potential (TRP) channel
- 42. Bitter, sweet & umami taste transduction
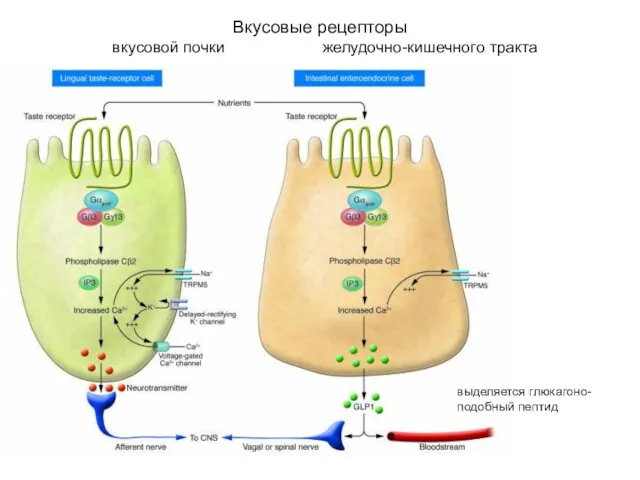
- 43. Вкусовые рецепторы вкусовой почки желудочно-кишечного тракта выделяется глюкагоно- подобный пептид
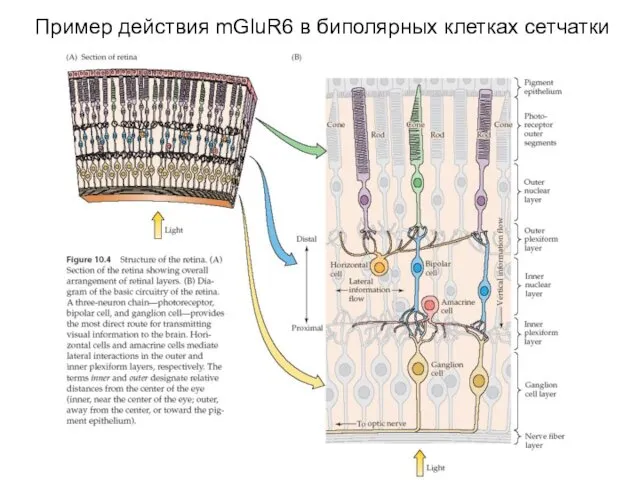
- 44. Пример действия mGluR6 в биполярных клетках сетчатки
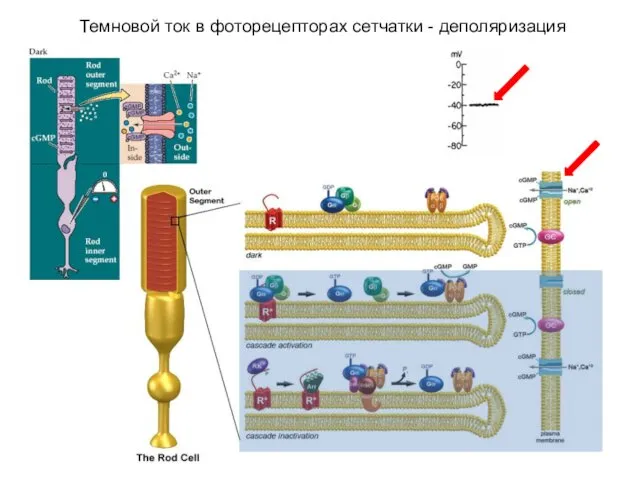
- 45. Темновой ток в фоторецепторах сетчатки - деполяризация
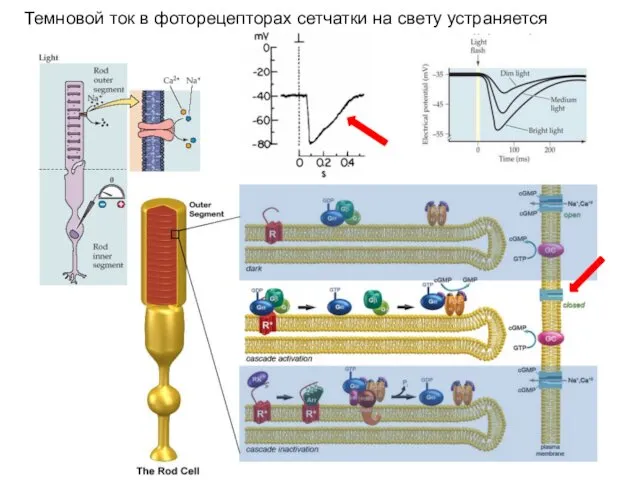
- 46. Темновой ток в фоторецепторах сетчатки на свету устраняется
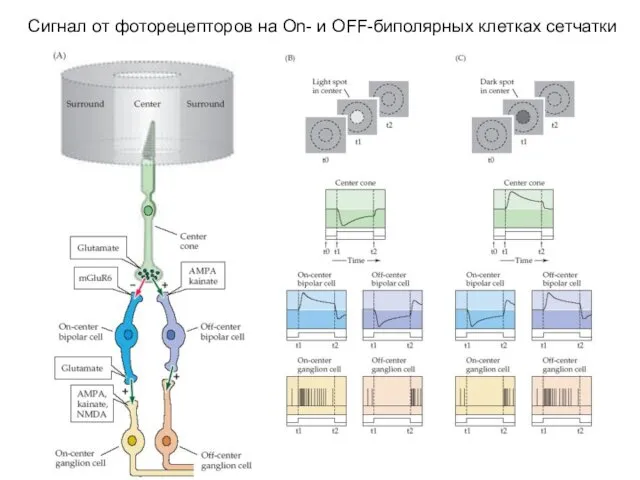
- 47. Сигнал от фоторецепторов на On- и OFF-биполярных клетках сетчатки
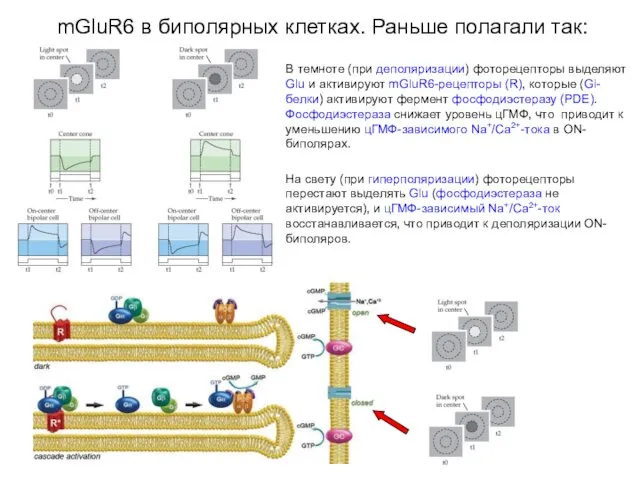
- 48. mGluR6 в биполярных клетках. Раньше полагали так: В темноте (при деполяризации) фоторецепторы выделяют Glu и активируют
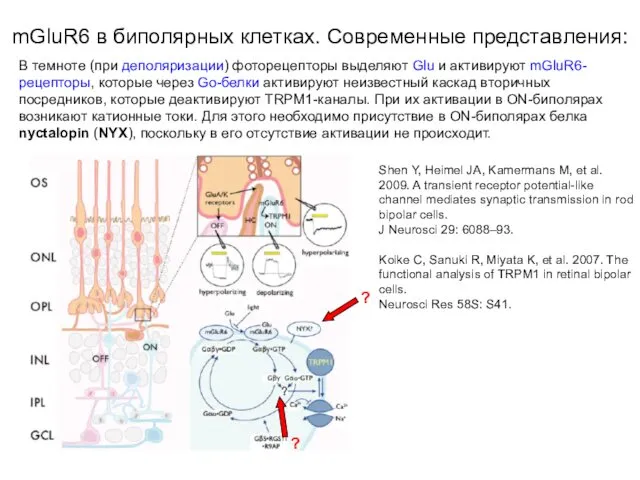
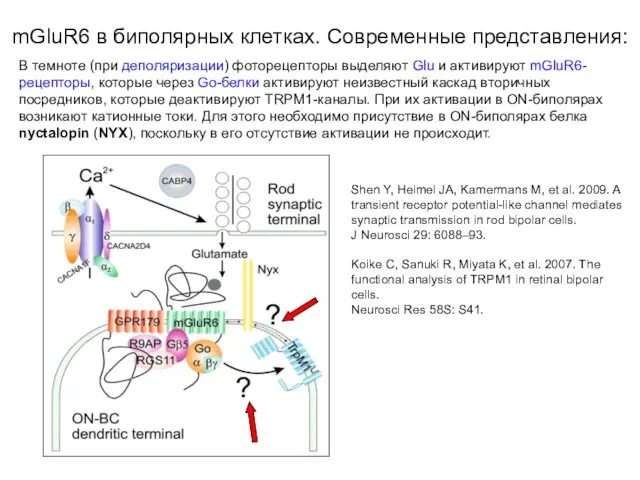
- 49. В темноте (при деполяризации) фоторецепторы выделяют Glu и активируют mGluR6-рецепторы (R), которые (Gi-белки) активируют фермент фосфодиэстеразу
- 50. В темноте (при деполяризации) фоторецепторы выделяют Glu и активируют mGluR6-рецепторы, которые через Go-белки активируют неизвестный каскад
- 51. В темноте (при деполяризации) фоторецепторы выделяют Glu и активируют mGluR6-рецепторы, которые через Go-белки активируют неизвестный каскад
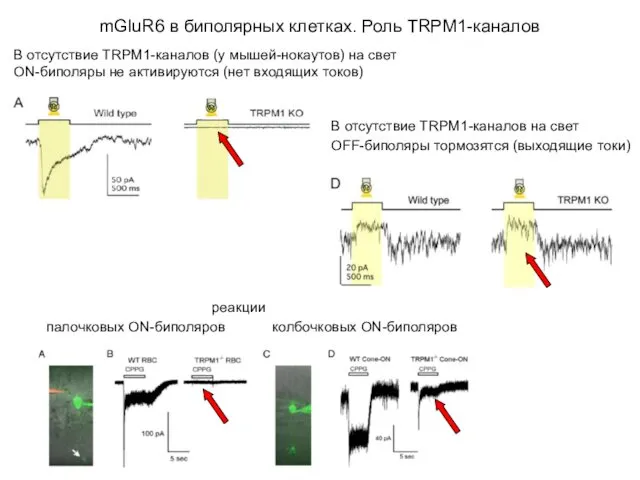
- 52. mGluR6 в биполярных клетках. Роль TRPM1-каналов В отсутствие TRPM1-каналов (у мышей-нокаутов) на свет ON-биполяры не активируются
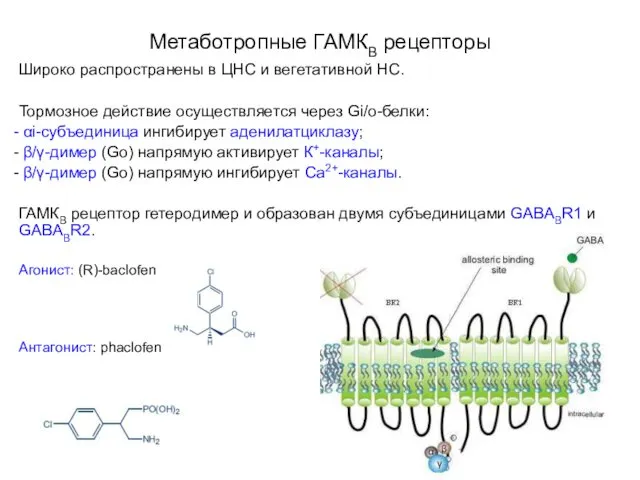
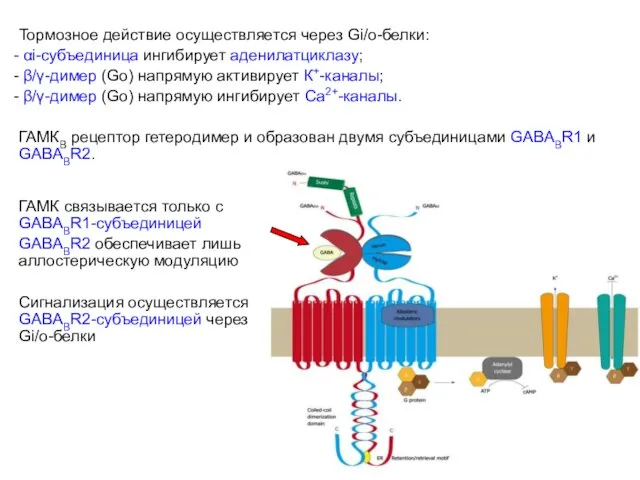
- 53. Метаботропные ГАМКВ рецепторы Широко распространены в ЦНС и вегетативной НС. Тормозное действие осуществляется через Gi/o-белки: αi-субъединица
- 54. Тормозное действие осуществляется через Gi/o-белки: αi-субъединица ингибирует аденилатциклазу; β/γ-димер (Go) напрямую активирует К+-каналы; β/γ-димер (Go) напрямую
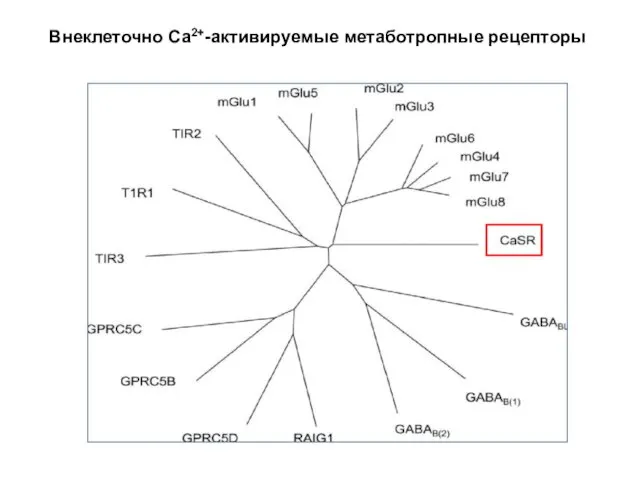
- 55. Внеклеточно Са2+-активируемые метаботропные рецепторы
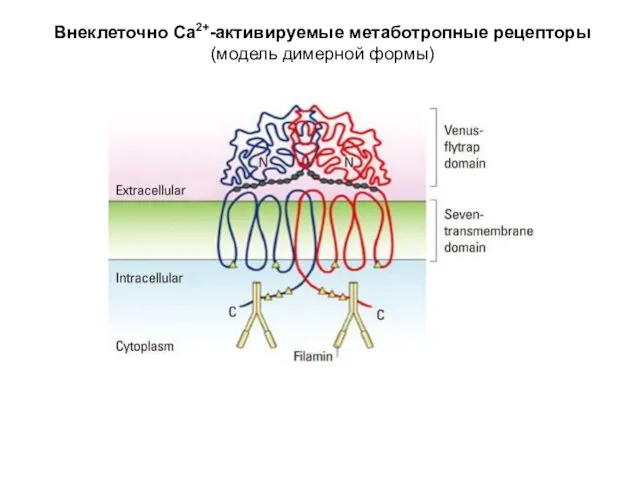
- 56. Внеклеточно Са2+-активируемые метаботропные рецепторы (модель димерной формы)
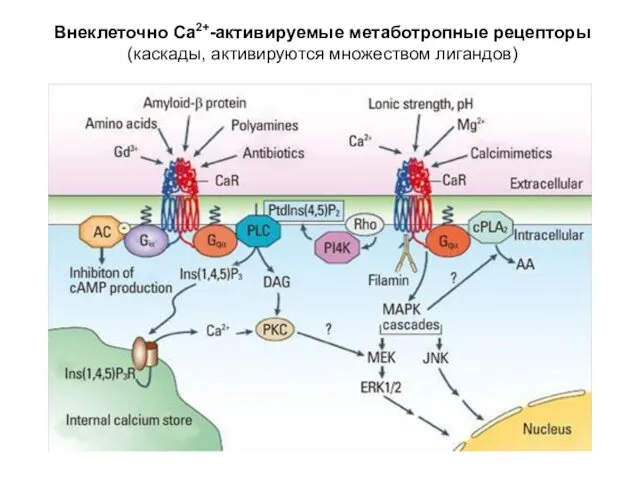
- 57. Внеклеточно Са2+-активируемые метаботропные рецепторы (каскады, активируются множеством лигандов)
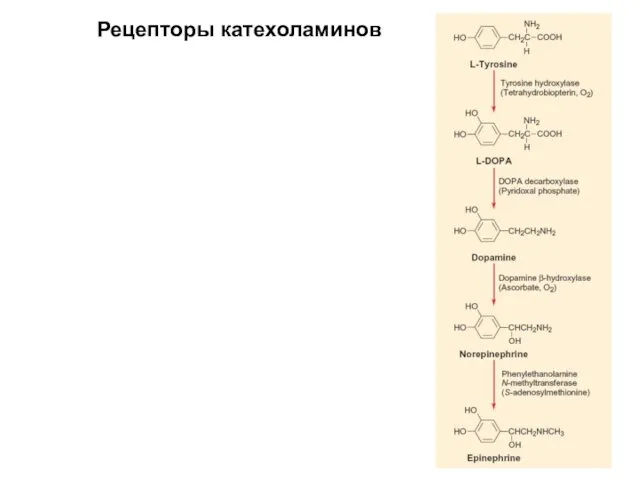
- 58. Рецепторы катехоламинов
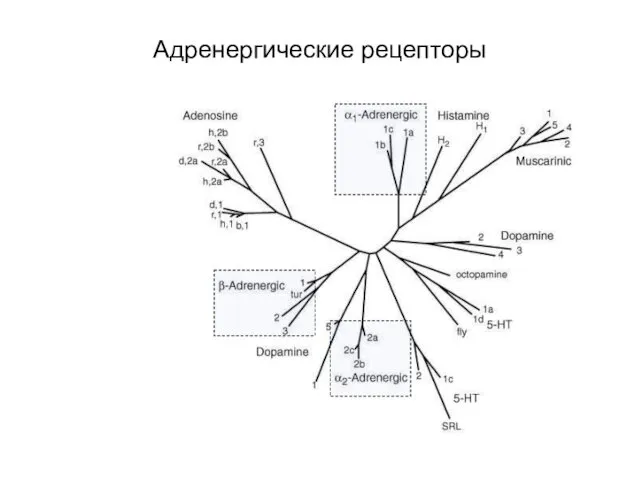
- 59. Адренергические рецепторы
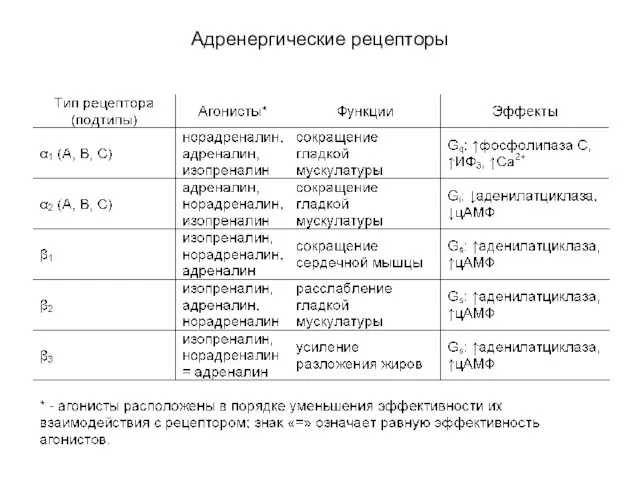
- 60. Адренергические рецепторы
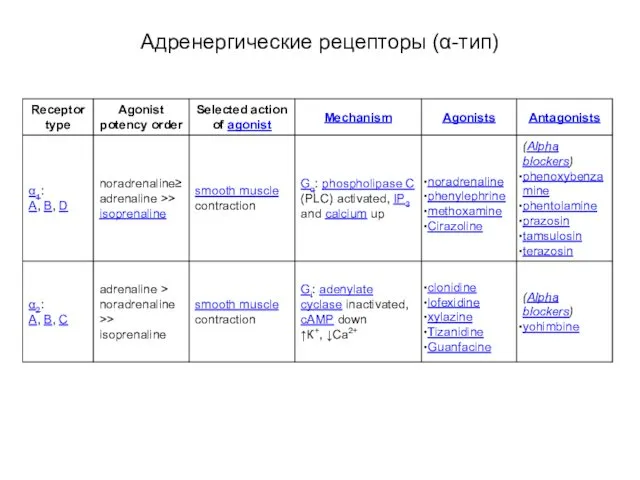
- 61. Адренергические рецепторы (α-тип)
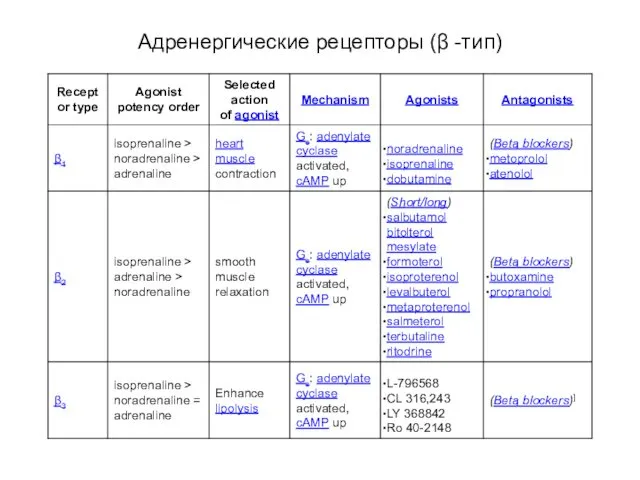
- 62. Адренергические рецепторы (β -тип)
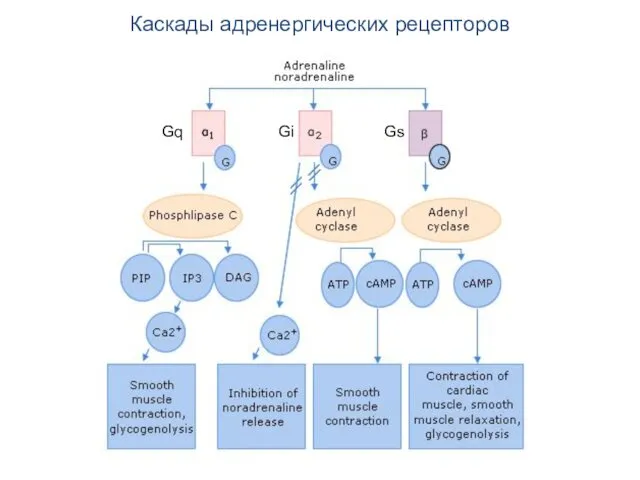
- 63. Каскады адренергических рецепторов Gq Gi Gs
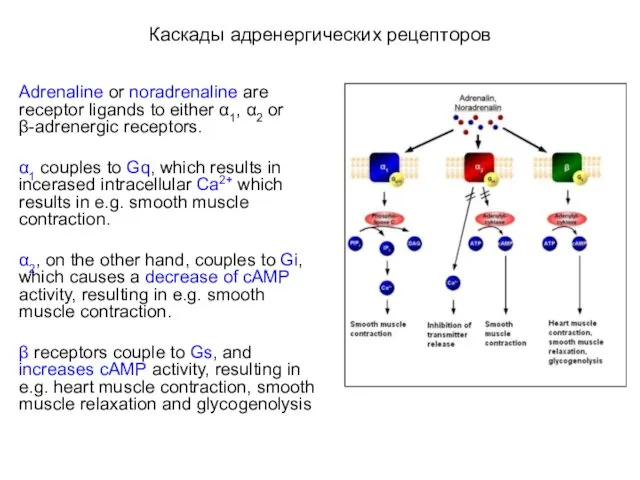
- 64. Каскады адренергических рецепторов Adrenaline or noradrenaline are receptor ligands to either α1, α2 or β-adrenergic receptors.
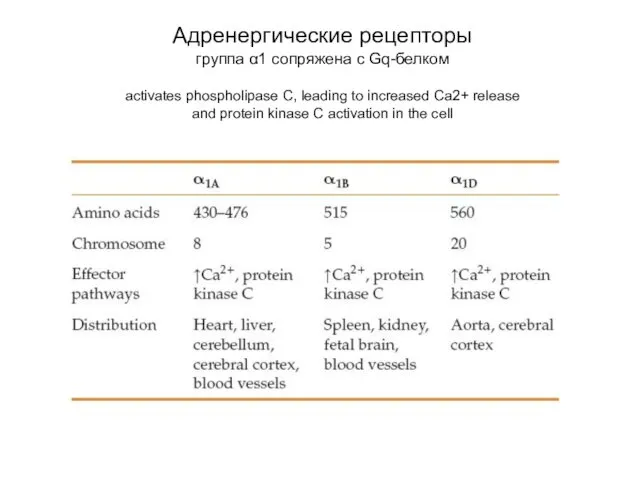
- 65. Адренергические рецепторы группа α1 сопряжена с Gq-белком activates phospholipase C, leading to increased Ca2+ release and
- 66. Адренергические рецепторы группа α2 сопряжена с Gi/Go-белками inhibit adenylyl cyclase and stimulate phospholipase A2 activities activation
- 67. Адренергические рецепторы группа β сопряжена с Gs-белком activate adenylyl cyclase activity
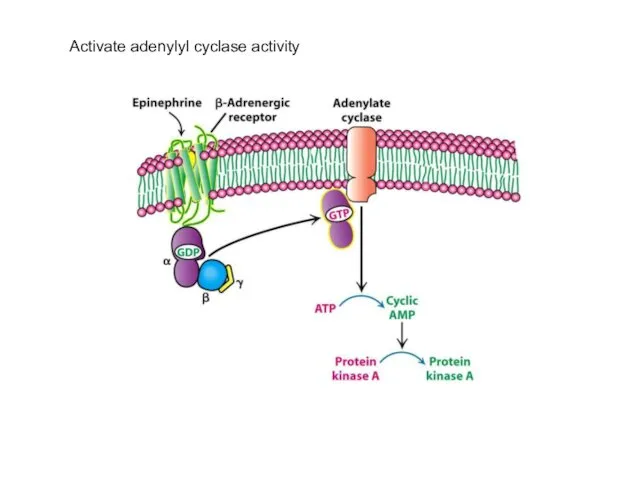
- 68. Activate adenylyl cyclase activity
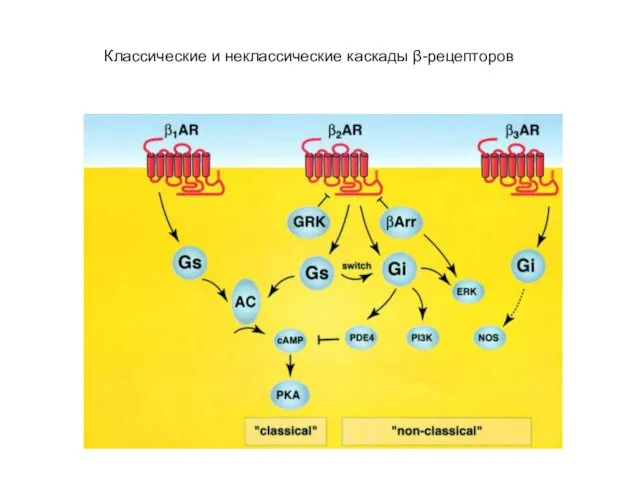
- 69. Классические и неклассические каскады β-рецепторов
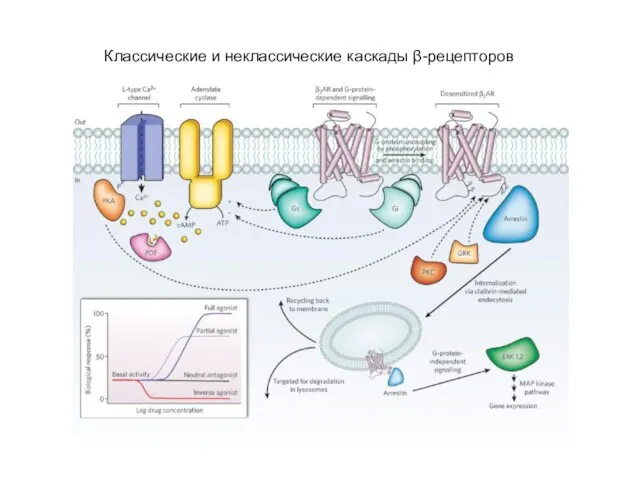
- 70. Классические и неклассические каскады β-рецепторов
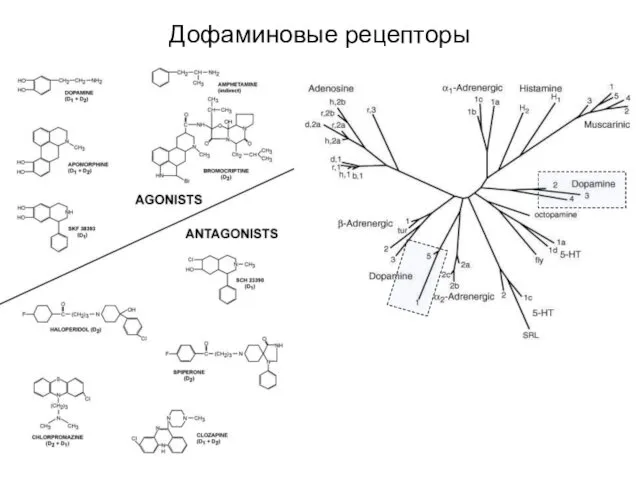
- 71. Дофаминовые рецепторы
- 72. Дофаминовые рецепторы: каскады подразделяют на два семейства: D1-like family (excitatory) D1 D5 D2-like family (inhibitory) D2
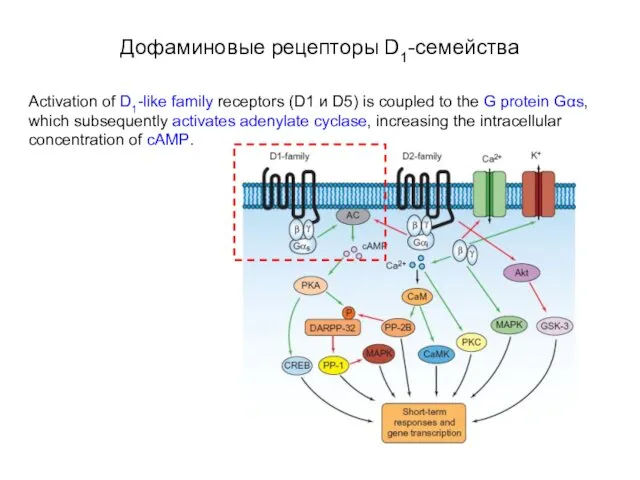
- 73. Дофаминовые рецепторы D1-семейства Activation of D1-like family receptors (D1 и D5) is coupled to the G
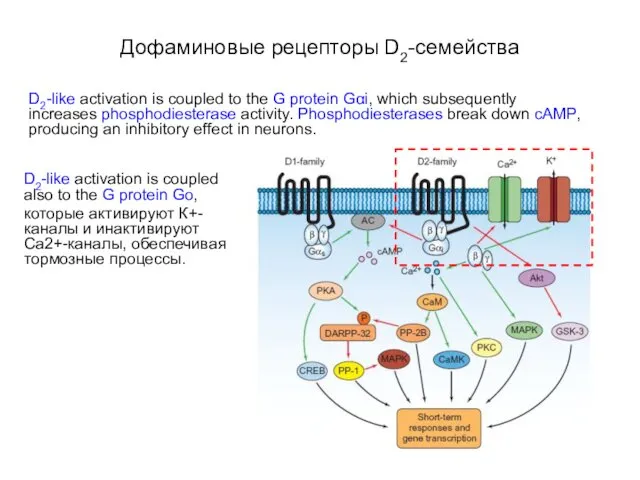
- 74. Дофаминовые рецепторы D2-семейства D2-like activation is coupled to the G protein Gαi, which subsequently increases phosphodiesterase
- 75. Дофаминовые рецепторы D2-семейства D2-like activation is coupled to the G protein Gαi, which subsequently increases phosphodiesterase
- 76. Дофаминовые рецепторы D2-семейства D3 Maximum expression of dopamine D3 receptors is noted in the islands of
- 77. Дофаминовые рецепторы: общая характеристика
- 78. Дофаминовые рецепторы: функции
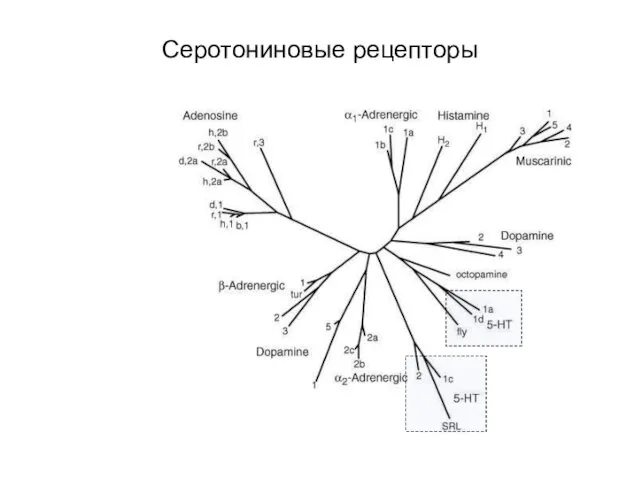
- 79. Серотониновые рецепторы
- 80. Серотониновые рецепторы
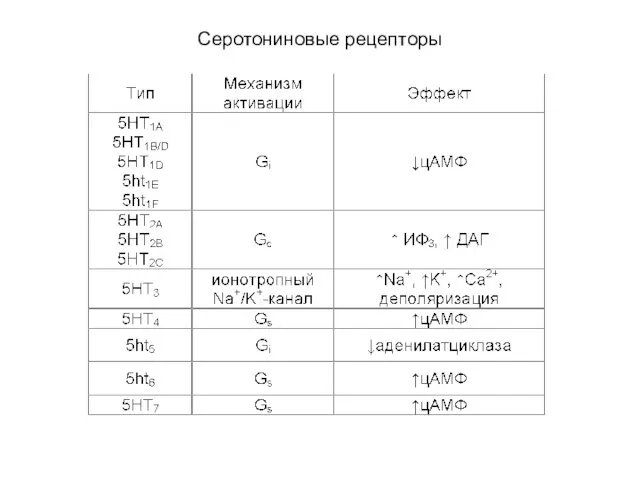
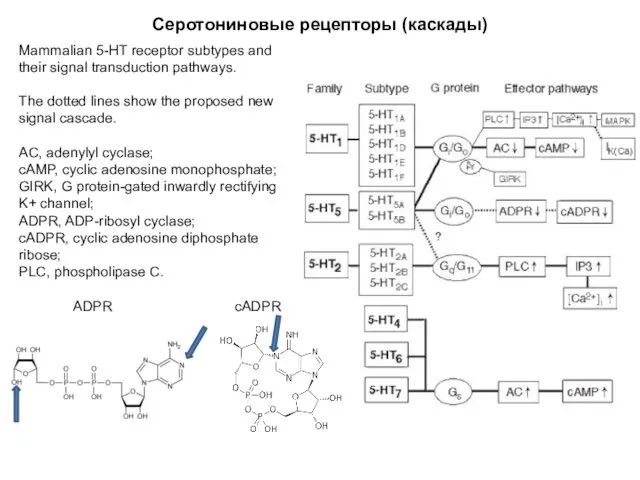
- 81. Серотониновые рецепторы (каскады) Mammalian 5-HT receptor subtypes and their signal transduction pathways. The dotted lines show
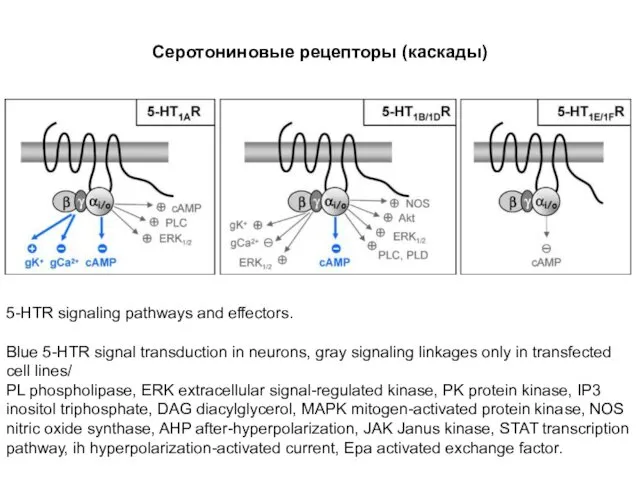
- 82. Серотониновые рецепторы (каскады) 5-HTR signaling pathways and effectors. Blue 5-HTR signal transduction in neurons, gray signaling
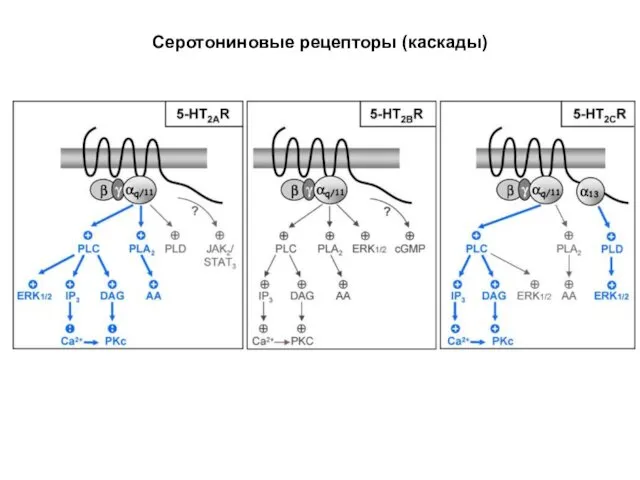
- 83. Серотониновые рецепторы (каскады)
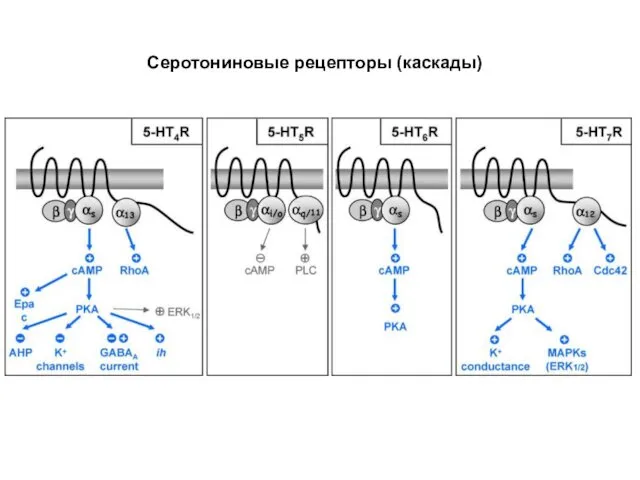
- 84. Серотониновые рецепторы (каскады)
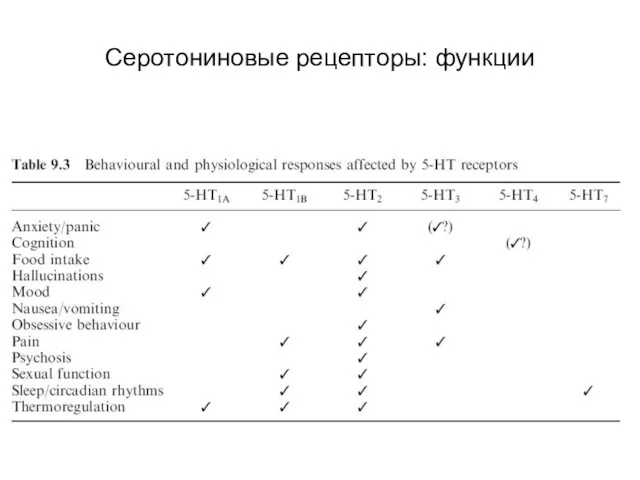
- 85. Серотониновые рецепторы: функции
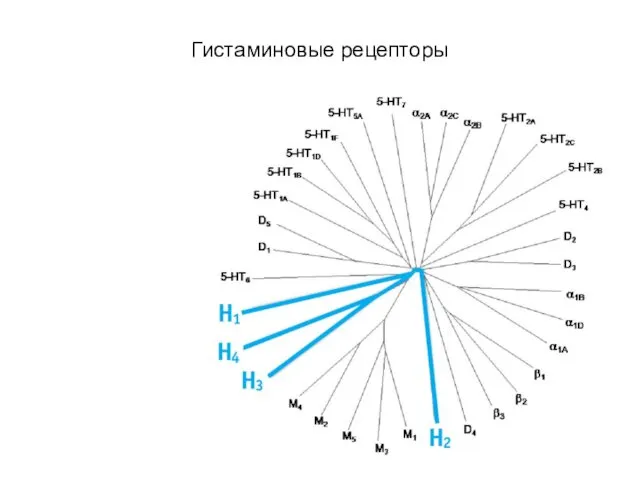
- 86. Гистаминовые рецепторы
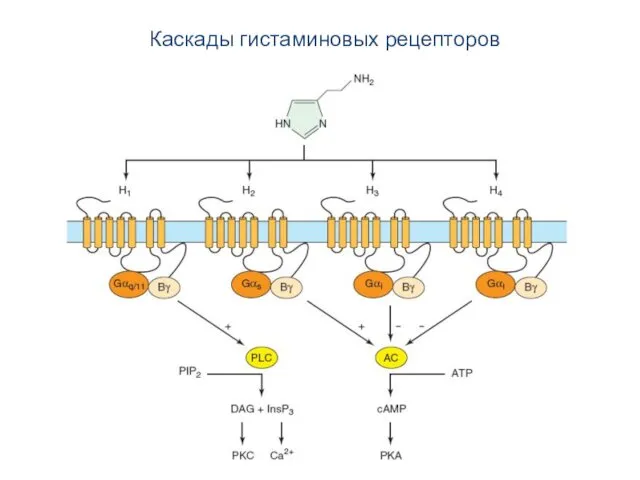
- 87. Каскады гистаминовых рецепторов
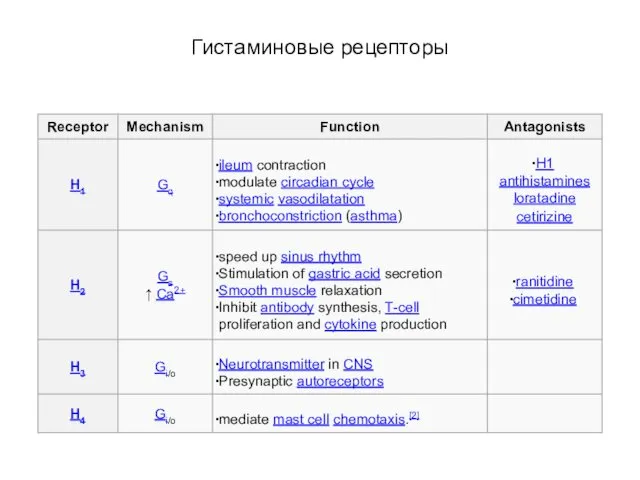
- 88. Гистаминовые рецепторы
- 89. Гистаминовые рецепторы H1 рецептор через Gq-белки активирует фосфолипазу С, вызывая синтез ИФ3. Это приводит к уменьшению
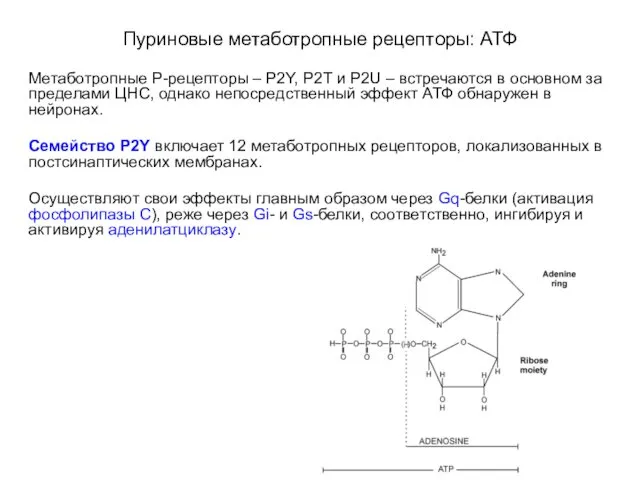
- 90. Пуриновые метаботропные рецепторы: АТФ Метаботропные Р-рецепторы – P2Y, P2T и P2U – встречаются в основном за
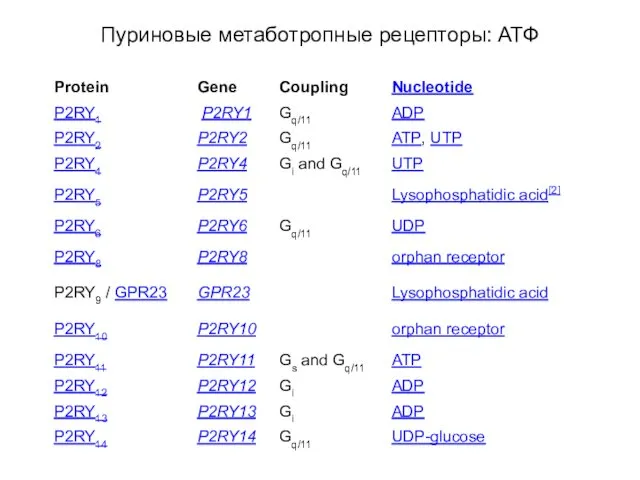
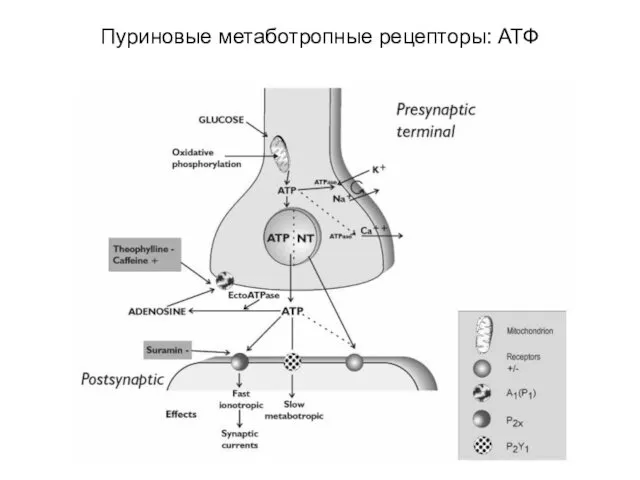
- 91. Пуриновые метаботропные рецепторы: АТФ
- 92. Пуриновые метаботропные рецепторы: АТФ
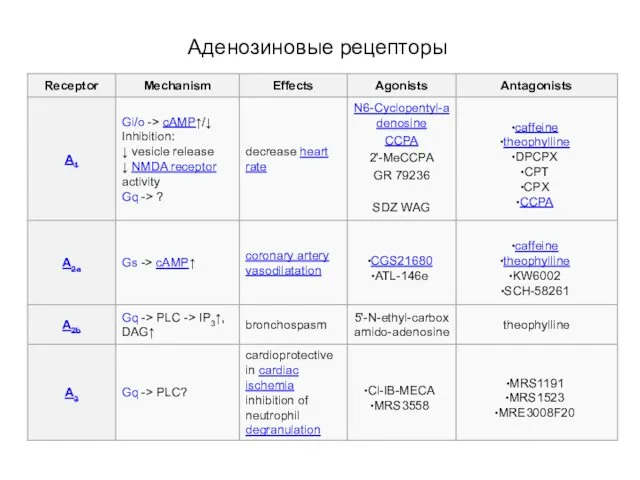
- 93. Аденозиновые рецепторы
- 94. Аденозиновые рецепторы
- 95. Пуриновые метаботропные рецепторы: аденозиновые Через пресинаптические А1-рецепторы (при сопряжении с Go-белками) аденозин может уменьшать синаптическое выделение
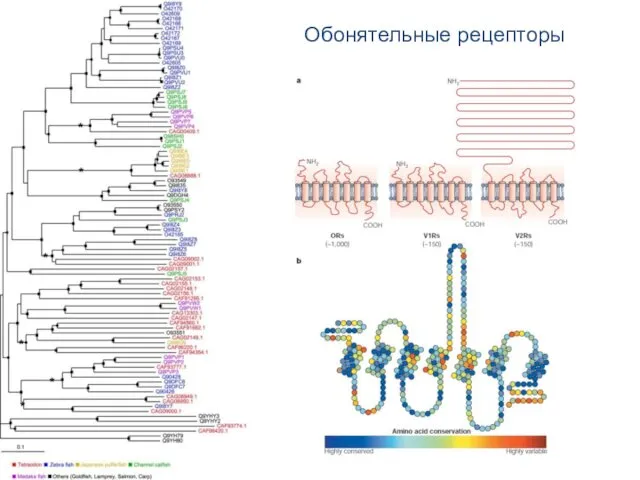
- 96. Обонятельные рецепторы
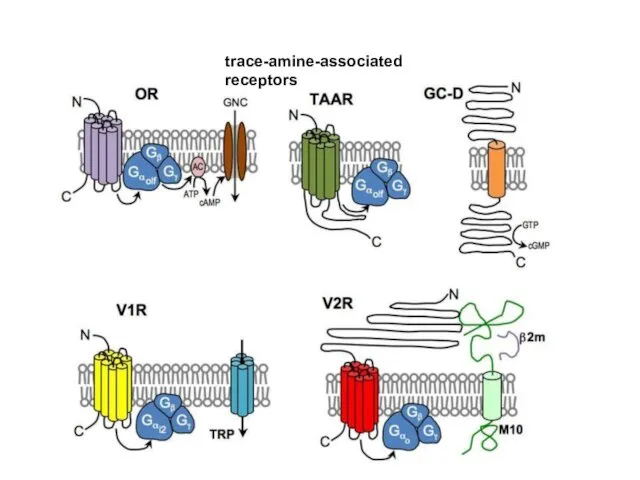
- 97. trace-amine-associated receptors
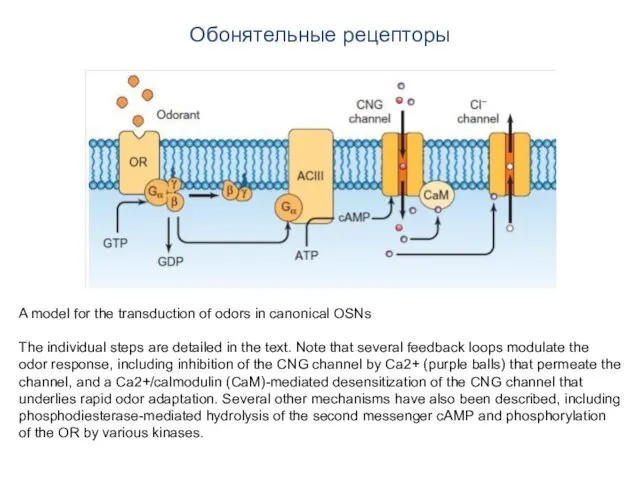
- 98. Обонятельные рецепторы A model for the transduction of odors in canonical OSNs The individual steps are
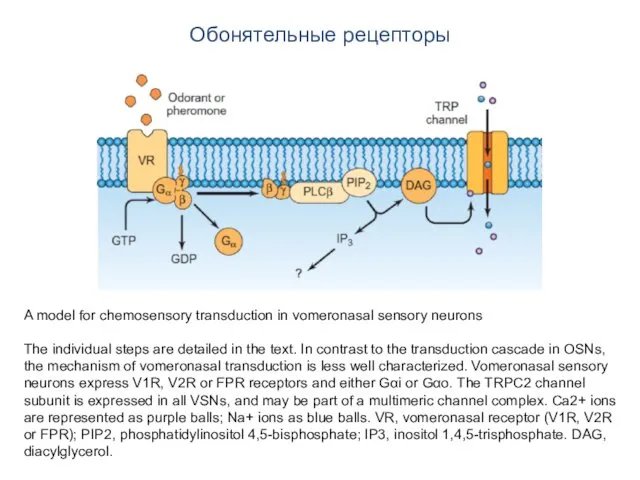
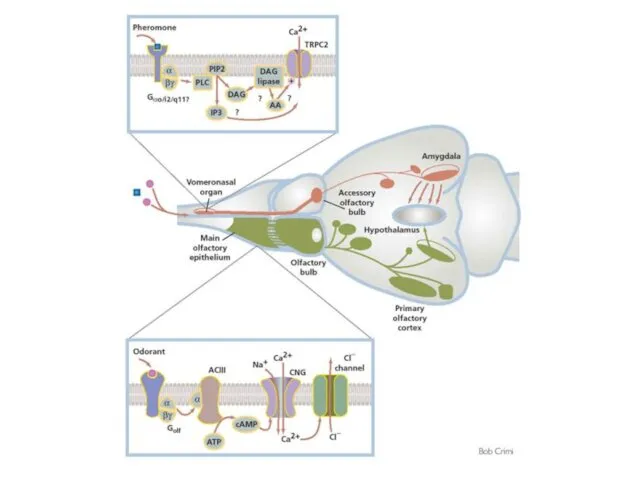
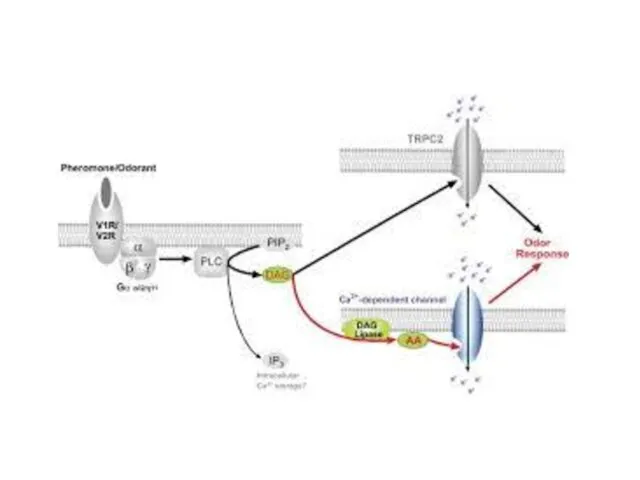
- 99. Обонятельные рецепторы A model for chemosensory transduction in vomeronasal sensory neurons The individual steps are detailed
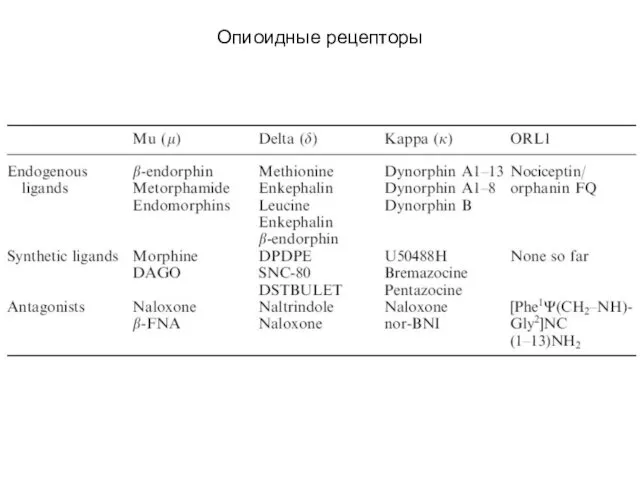
- 102. Опиоидные рецепторы μ-, δ-, κ- и ORL(opioid receptor-like)-рецепторы сопряжены с Gi/o-белками, которые обеспечивают закрытие Са2+-каналов (κ-рецепторы)
- 103. Опиоидные рецепторы
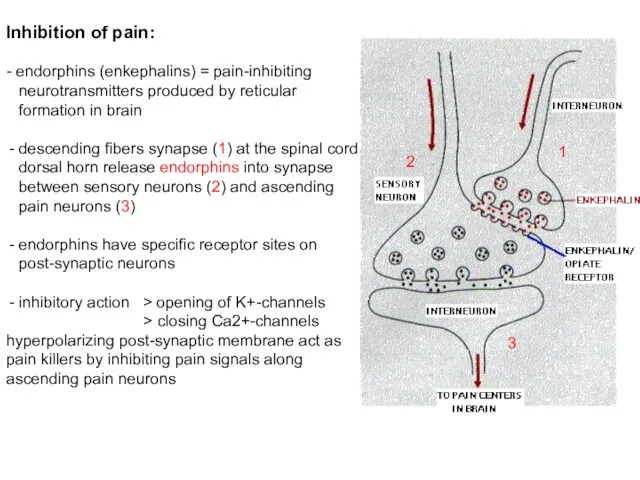
- 104. Inhibition of pain: - endorphins (enkephalins) = pain-inhibiting neurotransmitters produced by reticular formation in brain descending
- 105. Тахикинины Включают вещество Р (SP), нейрокинин А (NKA) и нейрокинин В (NKB). Афинность лигандов (в порядке
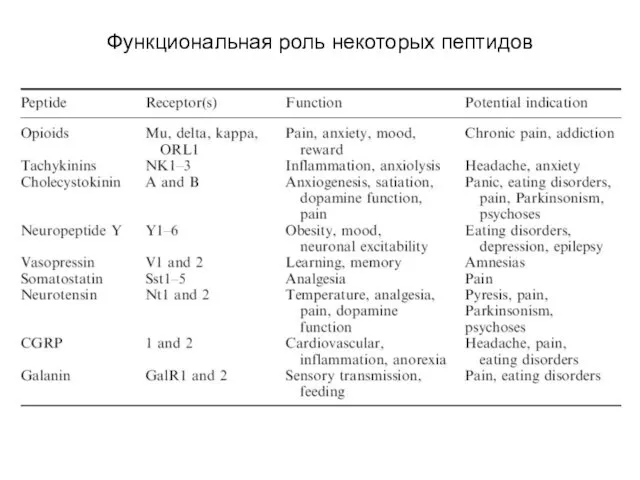
- 106. Функциональная роль некоторых пептидов
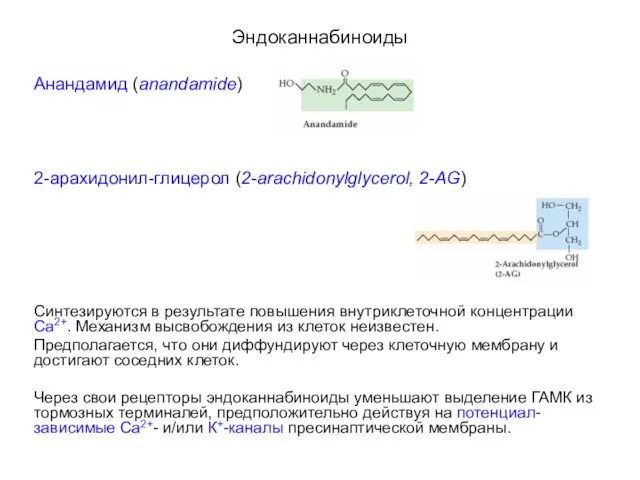
- 107. Эндоканнабиноиды Анандамид (anandamide) 2-арахидонил-глицерол (2-arachidonylglycerol, 2-AG) Синтезируются в результате повышения внутриклеточной концентрации Са2+. Механизм высвобождения из
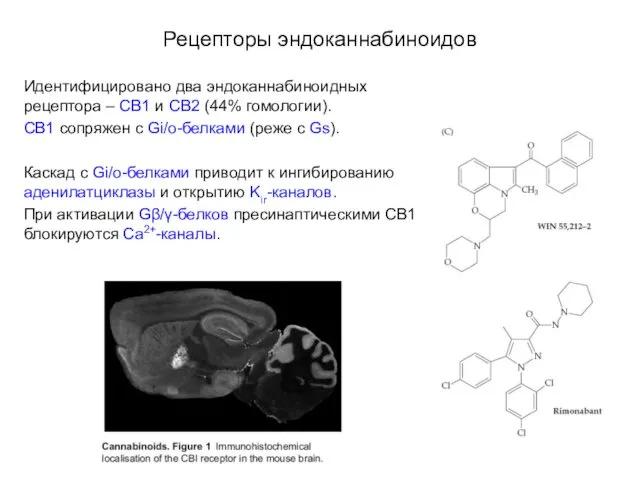
- 108. Рецепторы эндоканнабиноидов Идентифицировано два эндоканнабиноидных рецептора – СВ1 и СВ2 (44% гомологии). СВ1 сопряжен с Gi/o-белками
- 109. Рецепторы эндоканнабиноидов Идентифицировано два эндоканнабиноидных рецептора – СВ1 и СВ2 (44% гомологии). До недавнего времени считалось,
- 111. Скачать презентацию
























 Жасушаның негізгі компоненттерінің молекулярлық құрылысы және қызметі
Жасушаның негізгі компоненттерінің молекулярлық құрылысы және қызметі Опорно-двигательный аппарат. Скелет человека
Опорно-двигательный аппарат. Скелет человека Structure of DNA and its function
Structure of DNA and its function Органы чувств. Анализаторы
Органы чувств. Анализаторы Анатомия глаза
Анатомия глаза Мимические мышцы
Мимические мышцы Витамины. Действие на организм
Витамины. Действие на организм Теломердің қартаю теориясы
Теломердің қартаю теориясы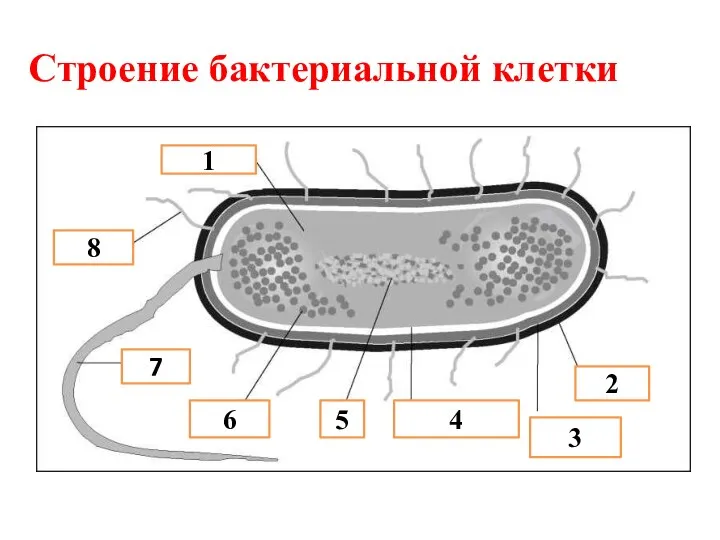 Строение бактериальной клетки
Строение бактериальной клетки Онтоногенез — это индивидуальное развитие организма
Онтоногенез — это индивидуальное развитие организма Как появился человек на Земле
Как появился человек на Земле Открытый урок Работа сердца
Открытый урок Работа сердца Биологическое соцветие
Биологическое соцветие Вакуолярная система
Вакуолярная система Australia’s Weird and Wonderful Wildlife
Australia’s Weird and Wonderful Wildlife спинной мозг
спинной мозг Биоконверсия растительного сырья. Лекция 1
Биоконверсия растительного сырья. Лекция 1 Аномалии развития верхних и нижних конечностей
Аномалии развития верхних и нижних конечностей Вегетативная нервная система
Вегетативная нервная система Методи обробки результатів медико-біологічних досліджень у фізичній культурі та спорті
Методи обробки результатів медико-біологічних досліджень у фізичній культурі та спорті Кровоснабжение сердечной мышцы
Кровоснабжение сердечной мышцы Регенерація. Фізіологічна та репаративні регенерація. Старіння як етап онтогенезу. Механізми старіння
Регенерація. Фізіологічна та репаративні регенерація. Старіння як етап онтогенезу. Механізми старіння Основы молекулярной биологии
Основы молекулярной биологии Презентация Отряд Таракановые
Презентация Отряд Таракановые Стебель, его значение и строение. Многообразие стеблей
Стебель, его значение и строение. Многообразие стеблей Биофизика органа слуха. Биофизическое действие ультразвука на живые ткани
Биофизика органа слуха. Биофизическое действие ультразвука на живые ткани Спиной мозг. Позвоночник
Спиной мозг. Позвоночник Respiration carbon dioxide in blood
Respiration carbon dioxide in blood