Содержание
- 2. Структурно-функциональные свойства скелетной мышечной ткани
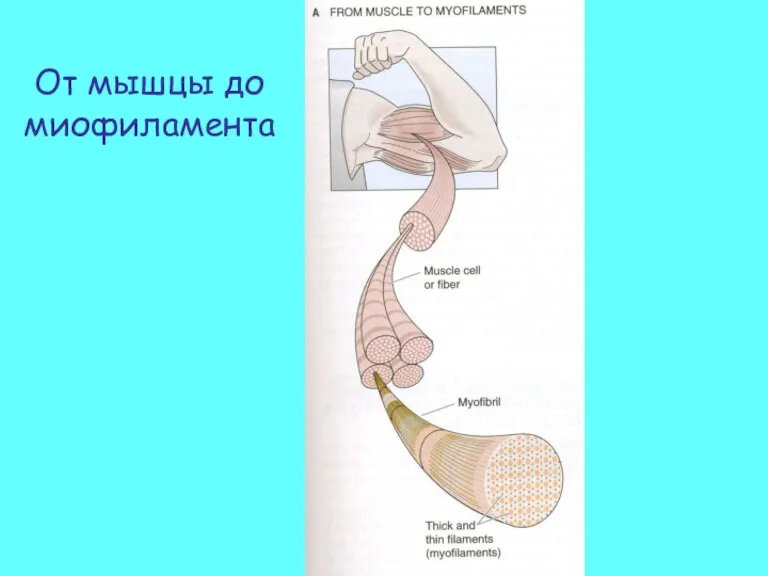
- 3. От мышцы до миофиламента
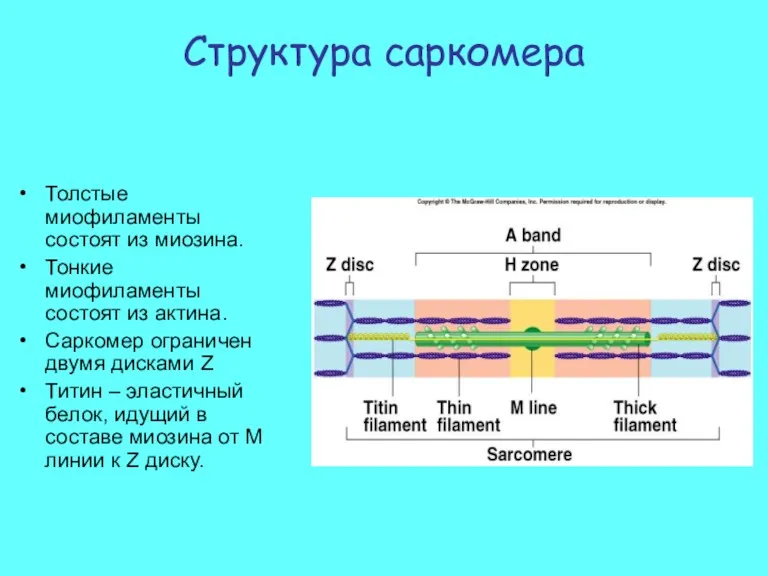
- 4. Структура саркомера Толстые миофиламенты состоят из миозина. Тонкие миофиламенты состоят из актина. Саркомер ограничен двумя дисками
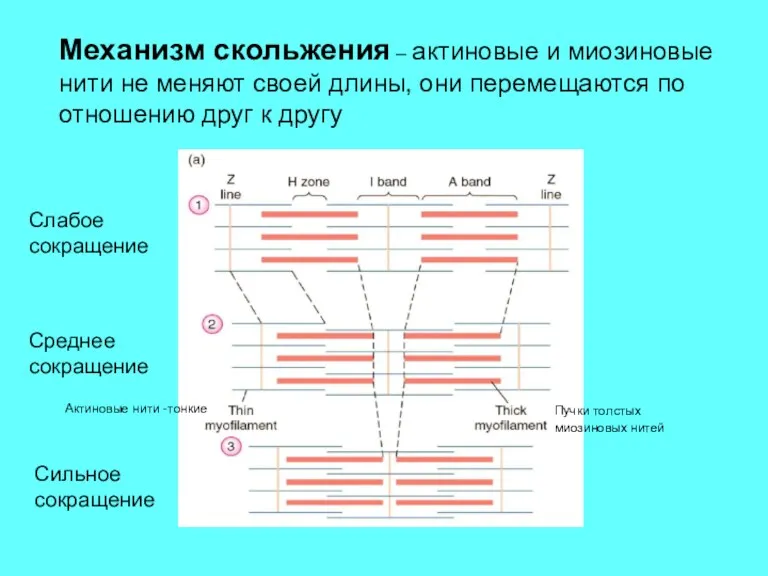
- 5. Актиновые нити -тонкие Пучки толстых миозиновых нитей Слабое сокращение Среднее сокращение Сильное сокращение Механизм скольжения –
- 6. Пучки миофиламентов
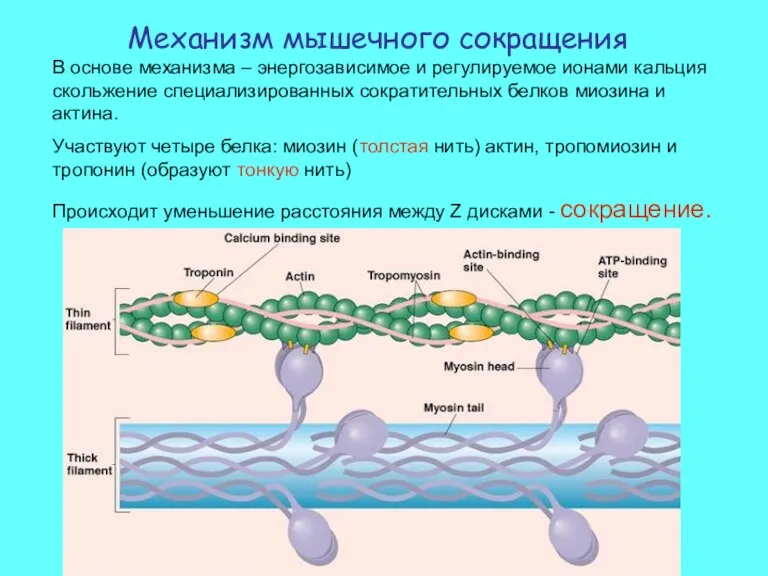
- 7. Механизм мышечного сокращения В основе механизма – энергозависимое и регулируемое ионами кальция скольжение специализированных сократительных белков
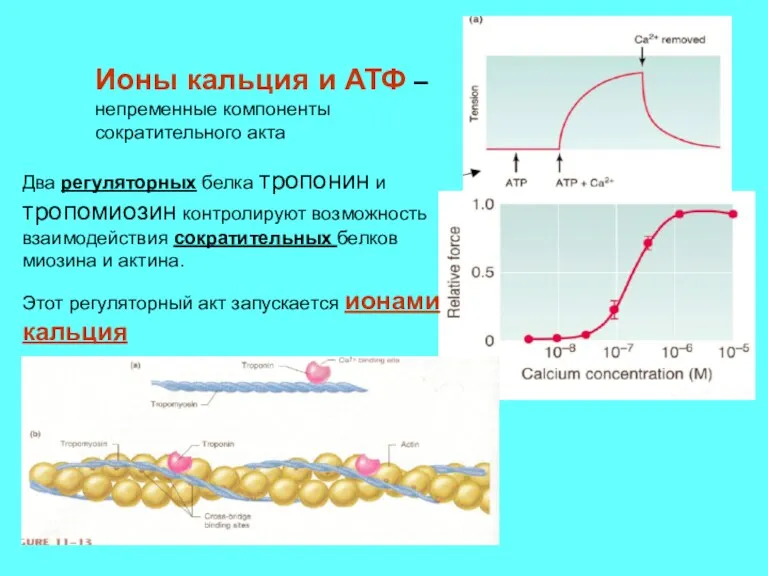
- 8. Два регуляторных белка тропонин и тропомиозин контролируют возможность взаимодействия сократительных белков миозина и актина. Этот регуляторный
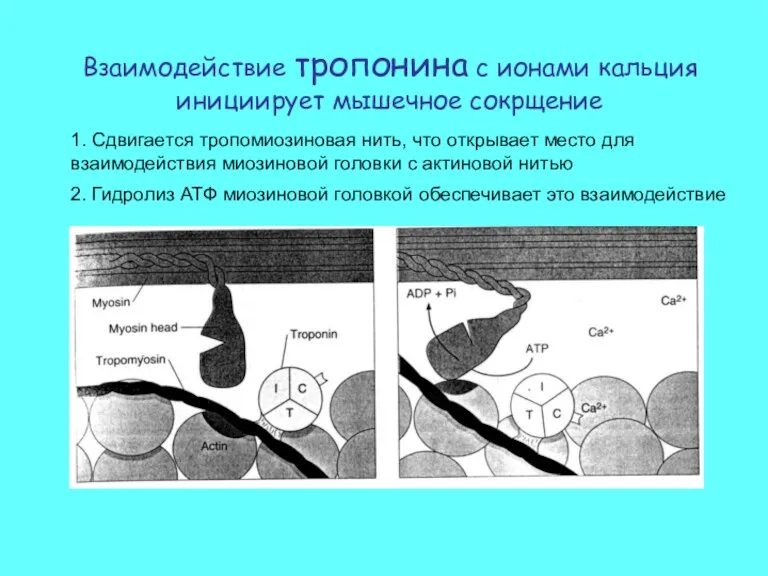
- 9. Взаимодействие тропонина с ионами кальция инициирует мышечное сокрщение 1. Сдвигается тропомиозиновая нить, что открывает место для
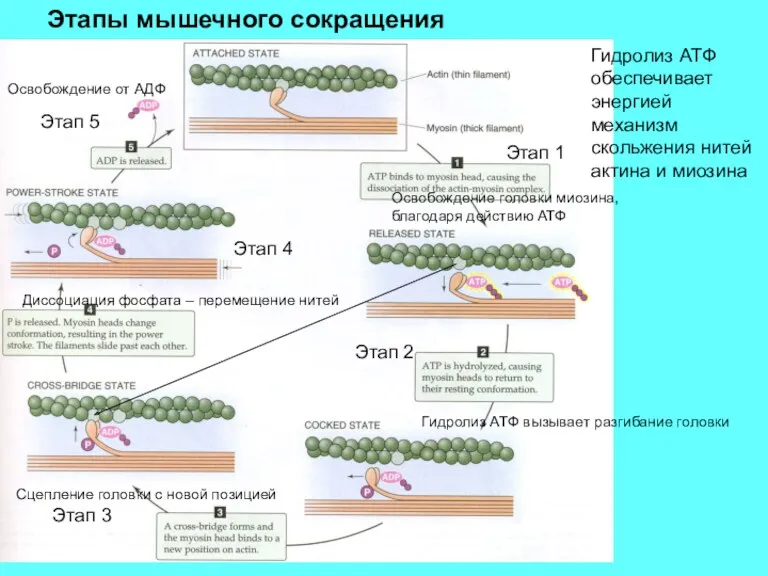
- 10. Гидролиз АТФ обеспечивает энергией механизм скольжения нитей актина и миозина Освобождение головки миозина, благодаря действию АТФ
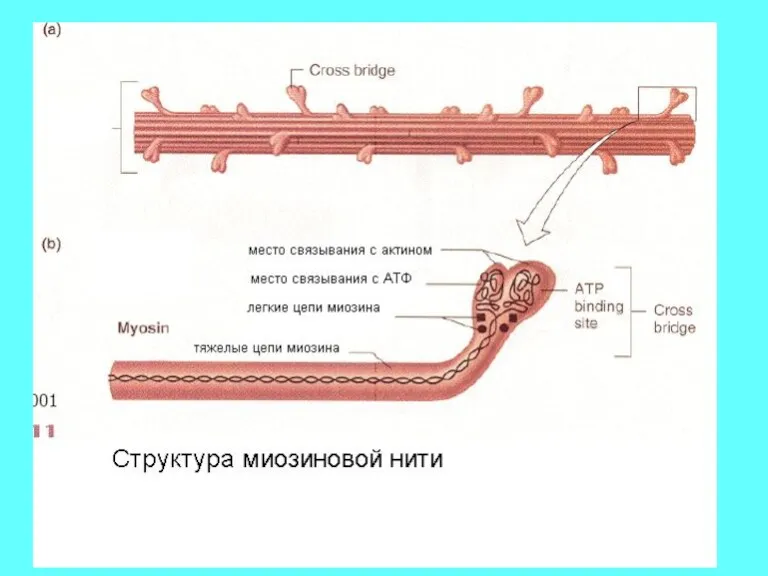
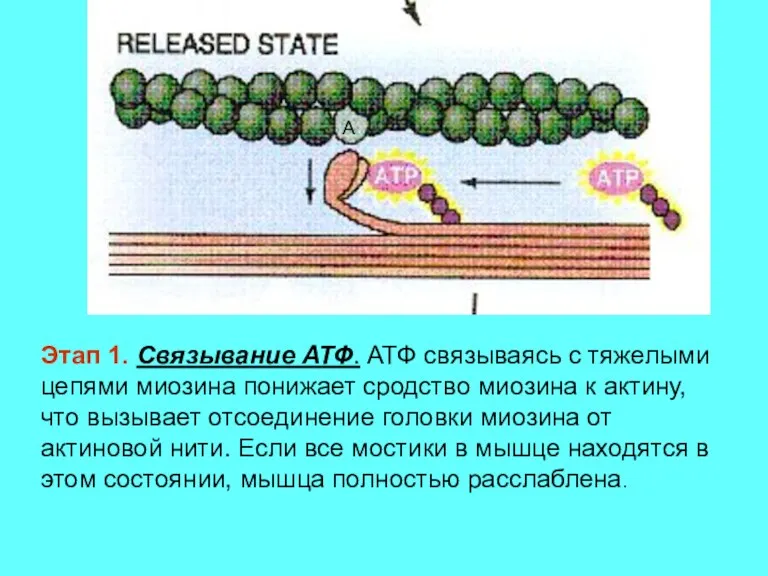
- 11. Этап 1. Связывание АТФ. АТФ связываясь с тяжелыми цепями миозина понижает сродство миозина к актину, что
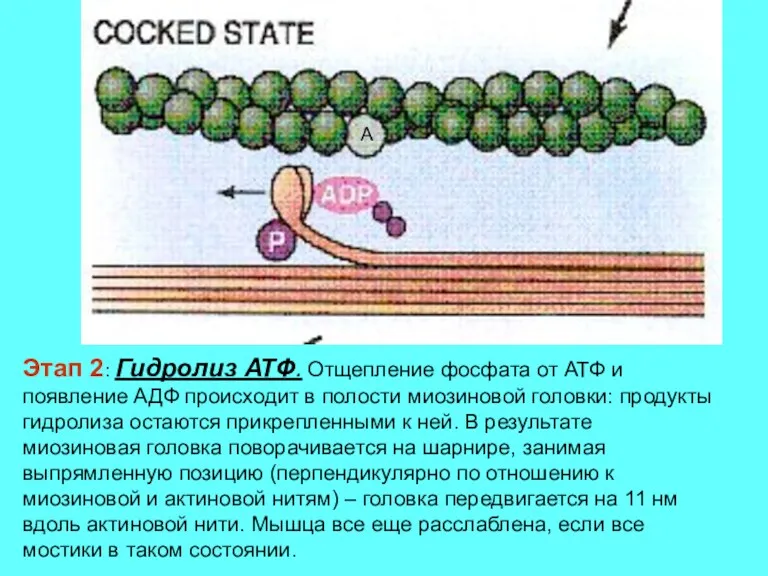
- 12. Этап 2: Гидролиз АТФ. Отщепление фосфата от АТФ и появление АДФ происходит в полости миозиновой головки:
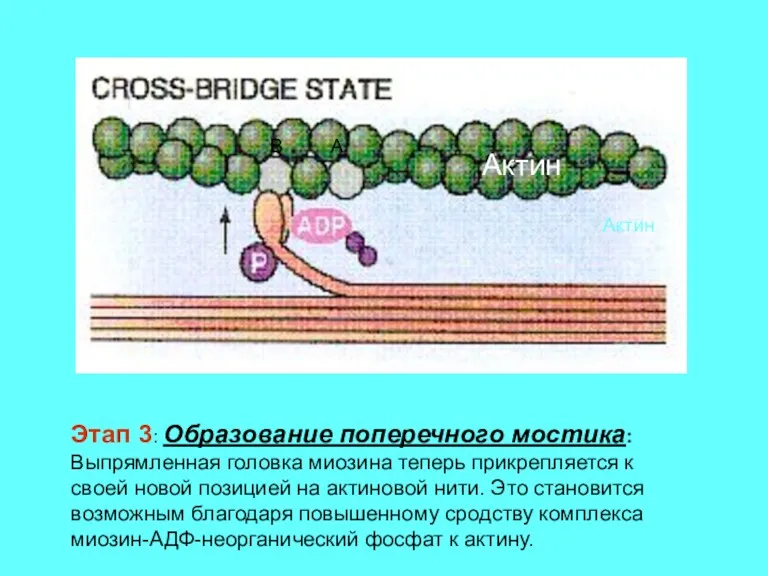
- 13. Этап 3: Образование поперечного мостика: Выпрямленная головка миозина теперь прикрепляется к своей новой позицией на актиновой
- 14. Этап 4: Освобождение миозина от фосфата. Диссоциация фосфата приводит к силовому гребку – конформационному превращению, в
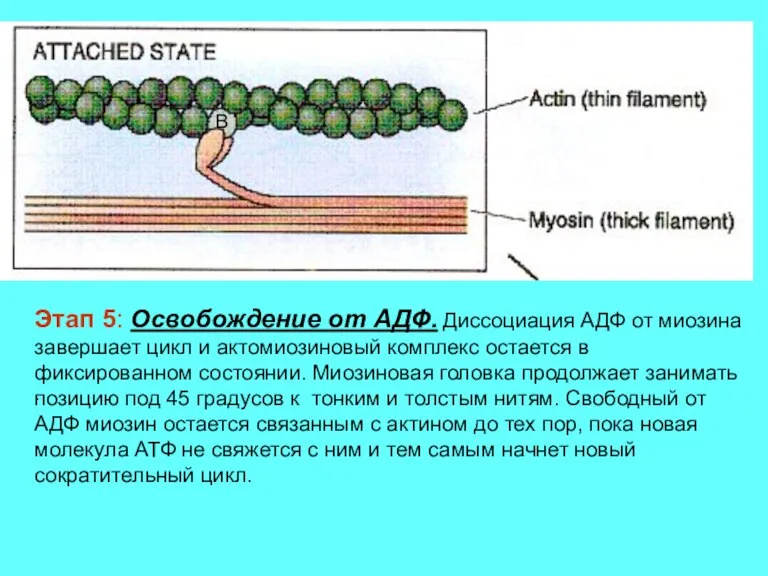
- 15. . Этап 5: Освобождение от АДФ. Диссоциация АДФ от миозина завершает цикл и актомиозиновый комплекс остается
- 16. Мембрано-миофибриллярная связь
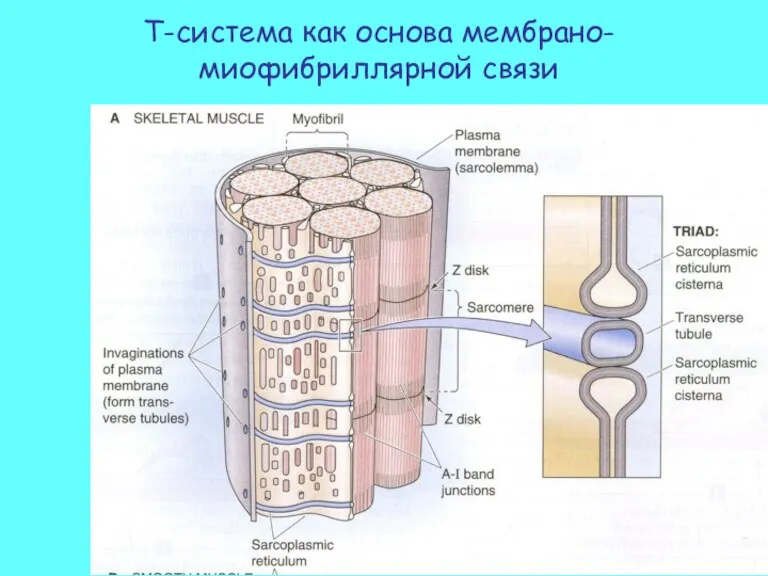
- 17. Т-система как основа мембрано-миофибриллярной связи
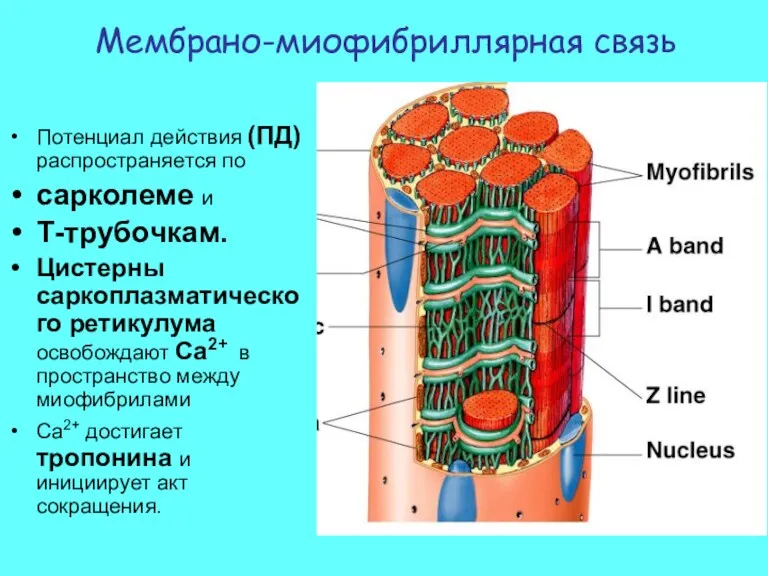
- 18. Потенциал действия (ПД) распространяется по сарколеме и Т-трубочкам. Цистерны саркоплазматического ретикулума освобождают Ca2+ в пространство между
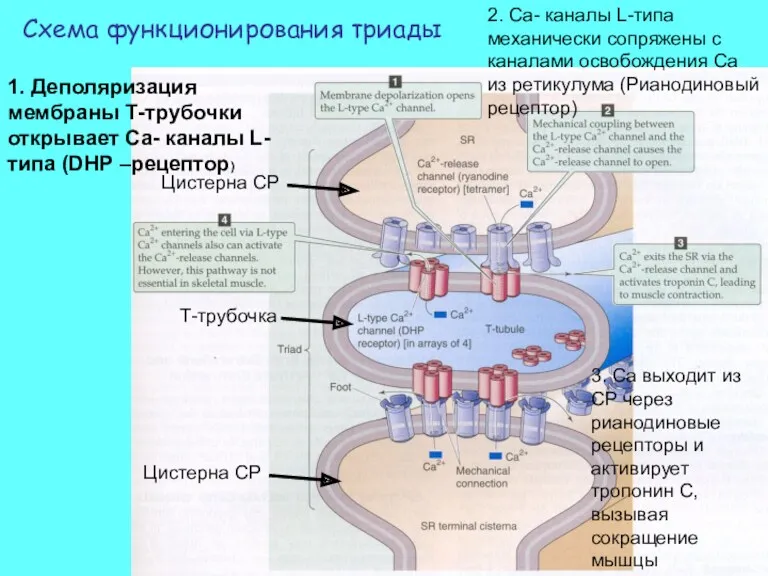
- 19. Схема функционирования триады 1. Деполяризация мембраны Т-трубочки открывает Са- каналы L-типа (DHP –рецептор) 2. Са- каналы
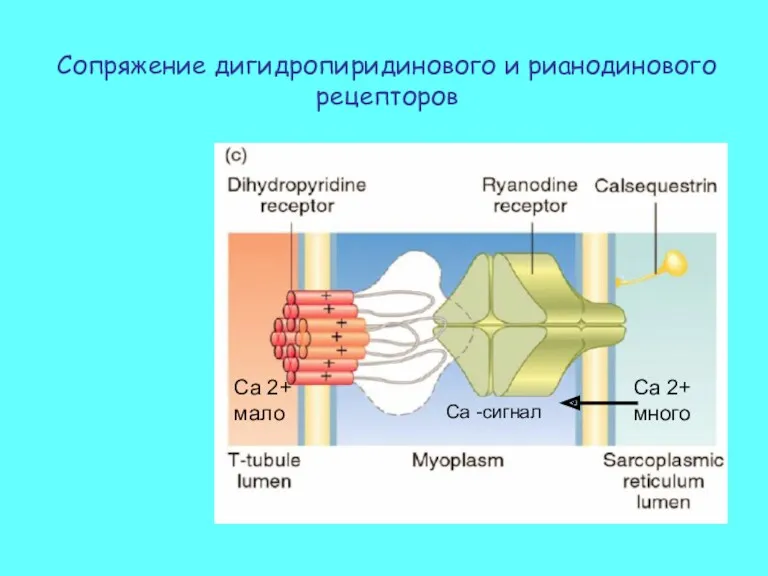
- 20. Сопряжение дигидропиридинового и рианодинового рецепторов Ca 2+ много Ca 2+ мало Са -сигнал
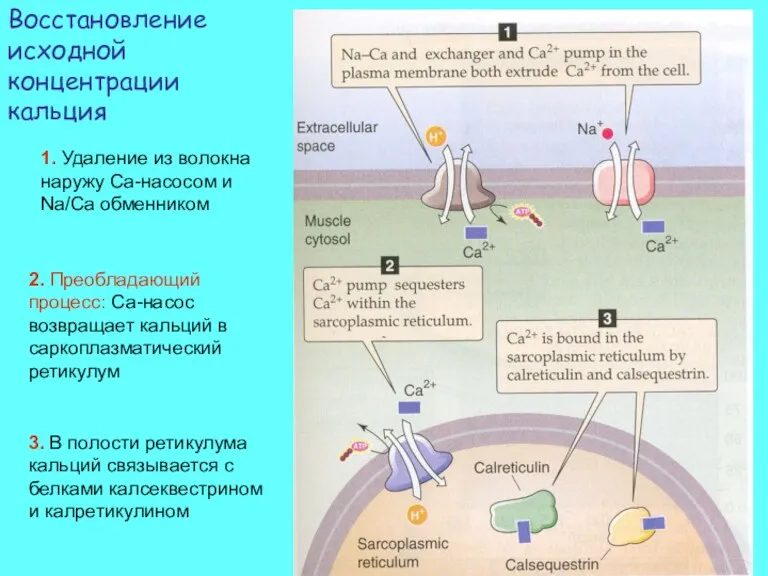
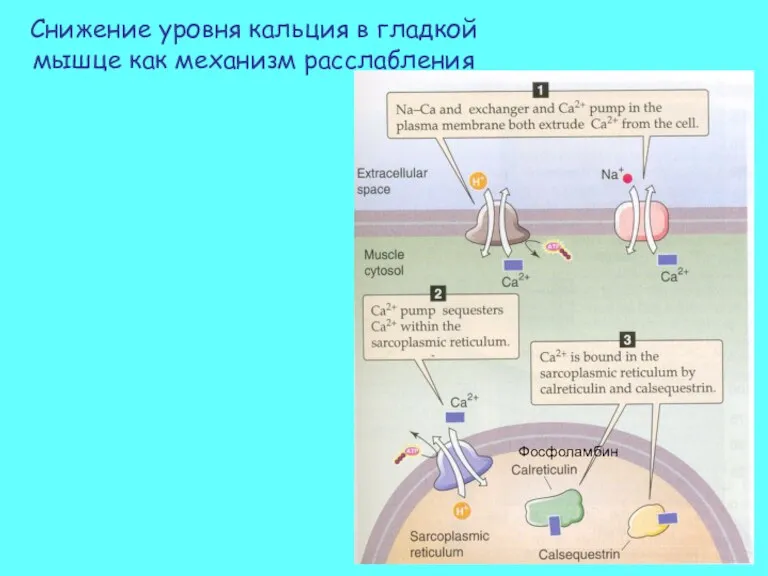
- 21. Восстановление исходной концентрации кальция 1. Удаление из волокна наружу Са-насосом и Na/Ca обменником 2. Преобладающий процесс:
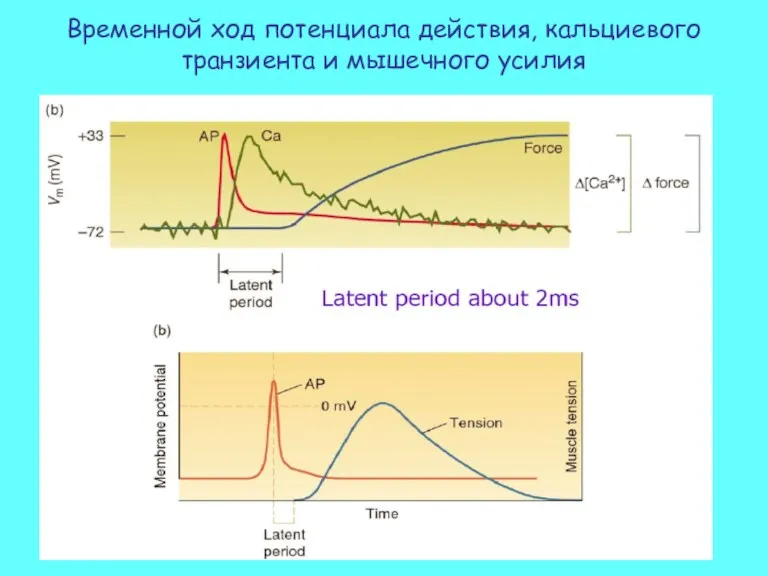
- 22. Временной ход потенциала действия, кальциевого транзиента и мышечного усилия
- 23. Последовательность этапов сокращения и расслабления скелетного мышечного волокна
- 24. Сокращение мышцы как органа
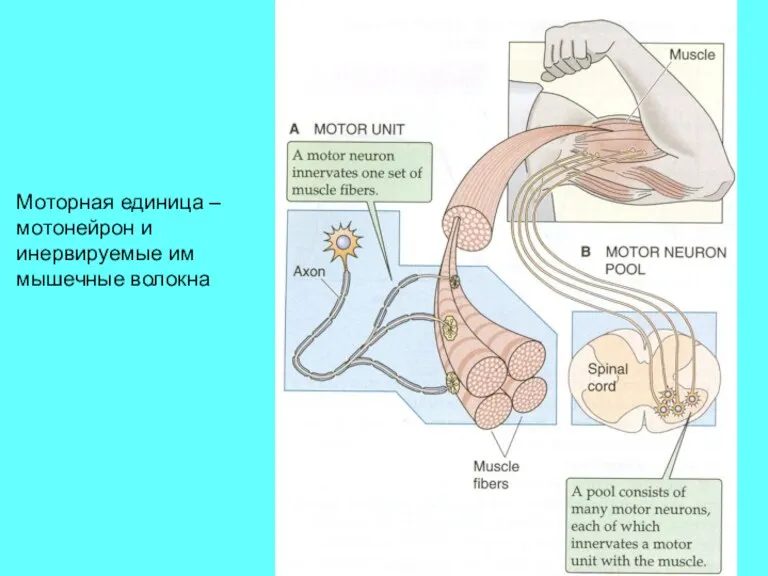
- 25. Моторная единица – мотонейрон и инервируемые им мышечные волокна
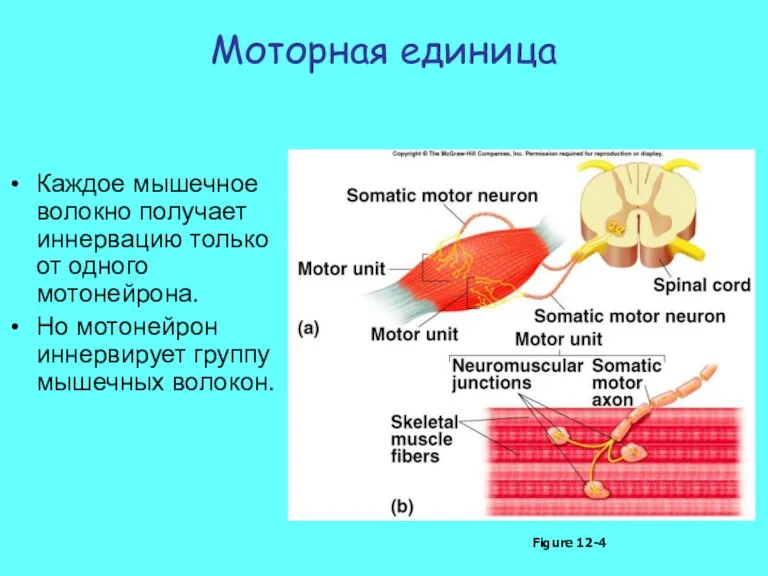
- 26. Моторная единица Каждое мышечное волокно получает иннервацию только от одного мотонейрона. Но мотонейрон иннервирует группу мышечных
- 27. Моторная (или двигательная) единица Активация мотонейрона в спинном или продолговатом мозгу вызывает сокращение всех мышечных волокон,
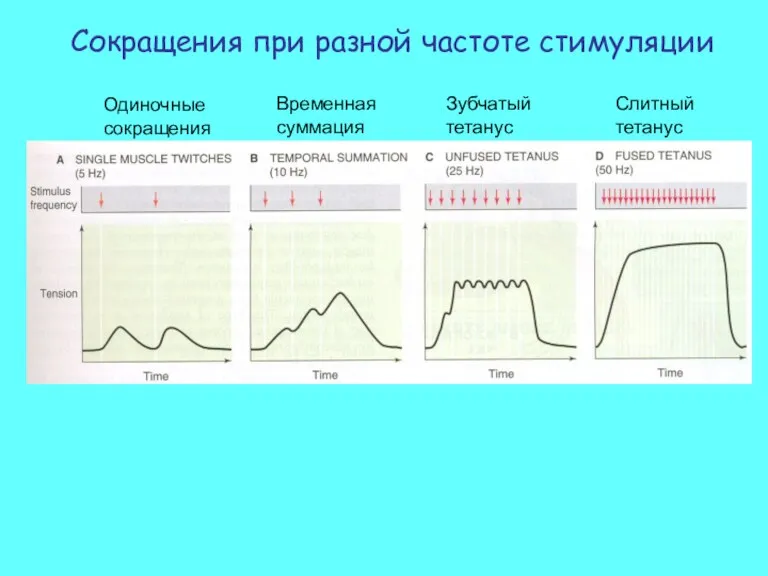
- 28. Одиночные сокращения Временная суммация Зубчатый тетанус Слитный тетанус Сокращения при разной частоте стимуляции
- 29. Основной источник энергии: 1 М АТФ + Н2О → АДФ + Н3РО4 + 7.3 ккал В
- 30. Метаболизм скелетных мышц Скелетные мышцы работают в анаэробном режиме первые 45-90 сек тяжелой нагрузки. Это время
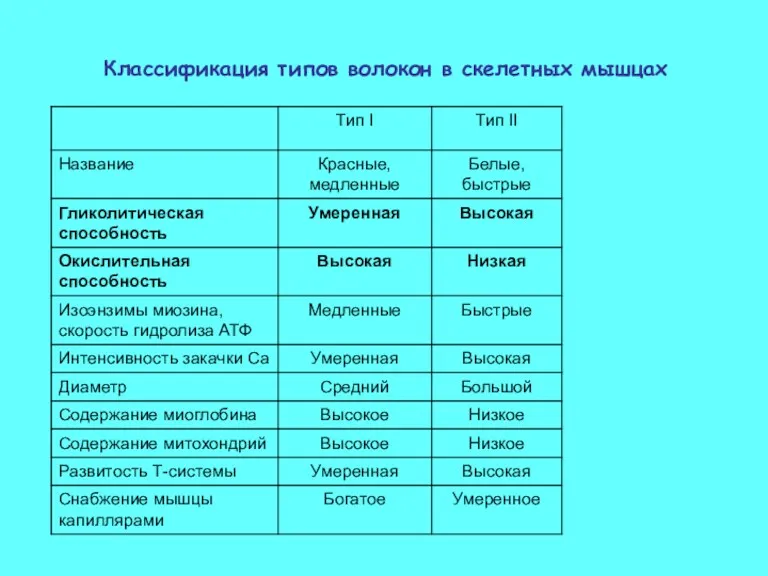
- 31. Классификация типов волокон в скелетных мышцах
- 32. Перерыв
- 33. Гладкая мышца
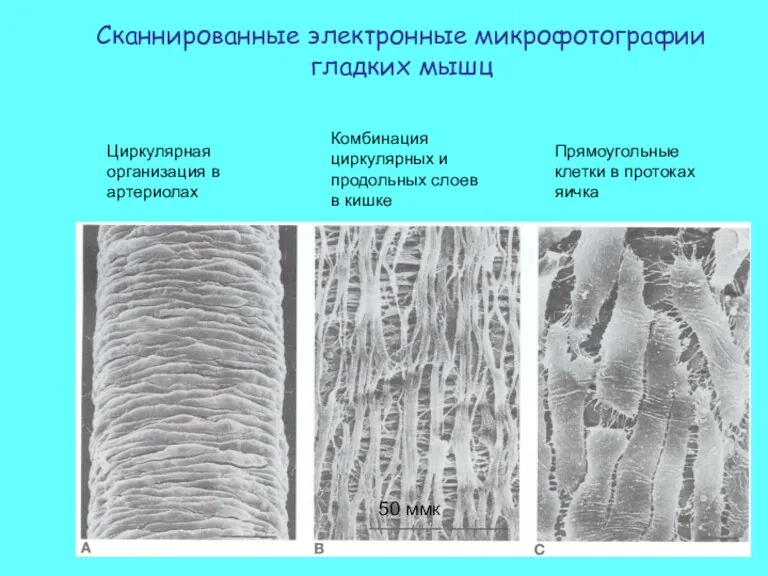
- 34. Сканнированные электронные микрофотографии гладких мышц Циркулярная организация в артериолах Комбинация циркулярных и продольных слоев в кишке
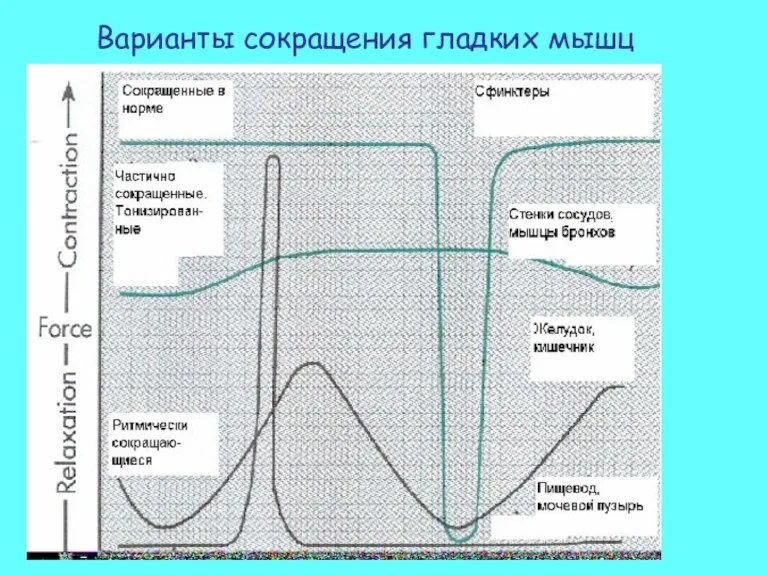
- 35. Варианты сокращения гладких мышц
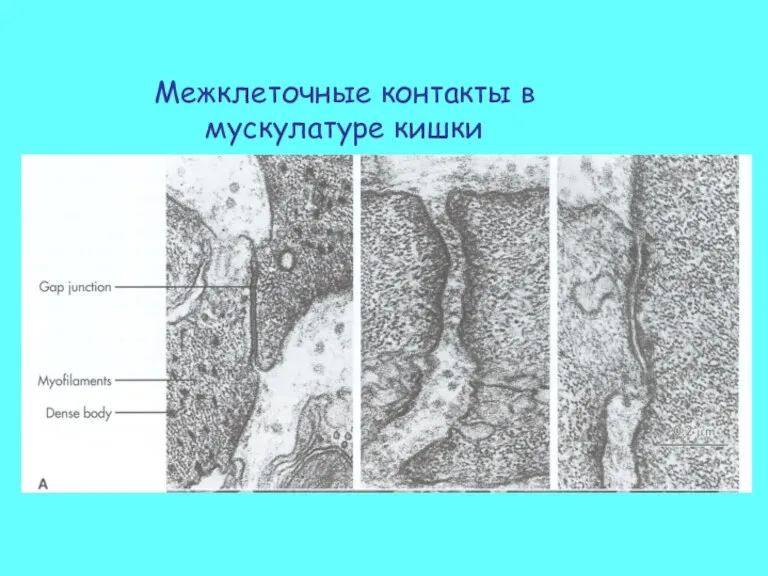
- 36. Межклеточные контакты в мускулатуре кишки
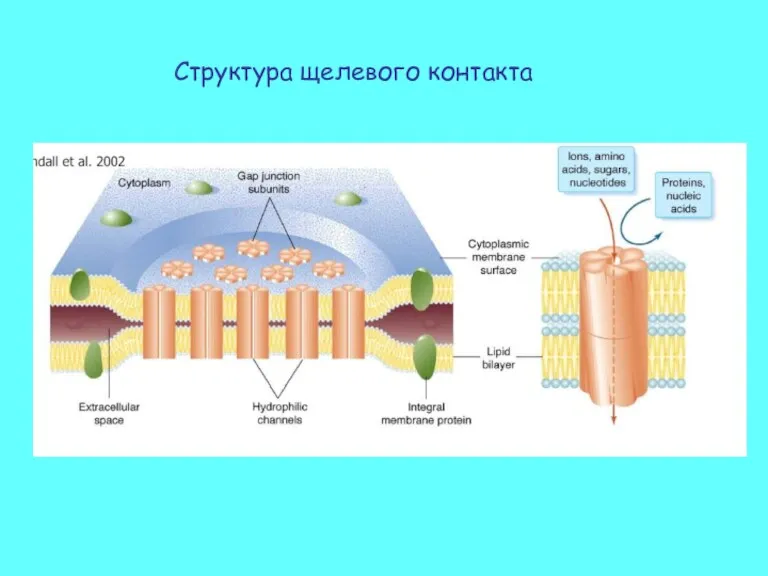
- 37. Структура щелевого контакта
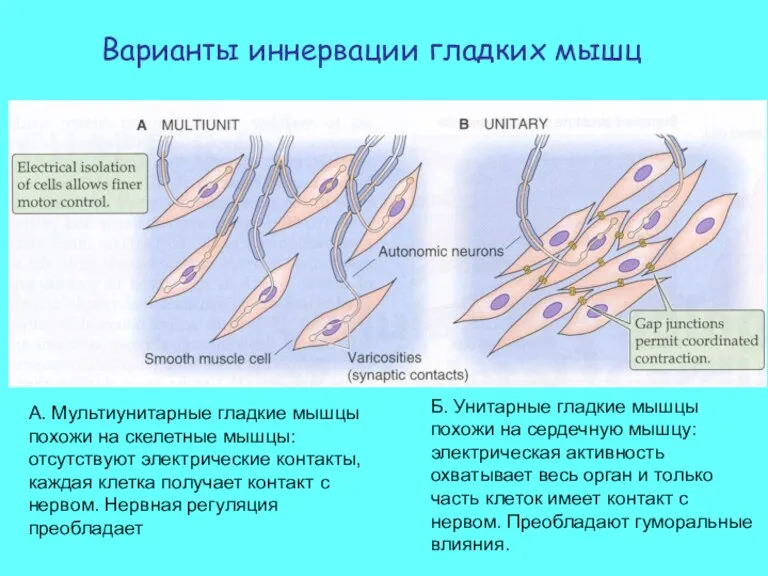
- 38. Варианты иннервации гладких мышц А. Мультиунитарные гладкие мышцы похожи на скелетные мышцы: отсутствуют электрические контакты, каждая
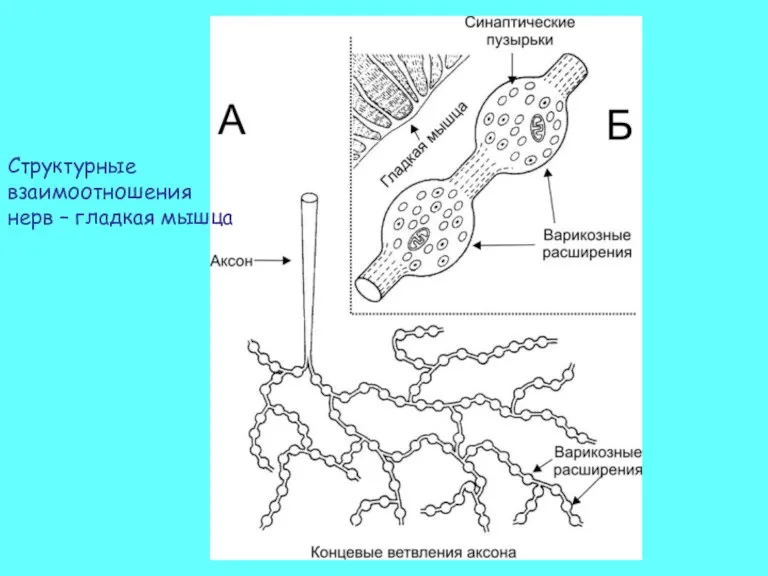
- 39. Структурные взаимоотношения нерв – гладкая мышца
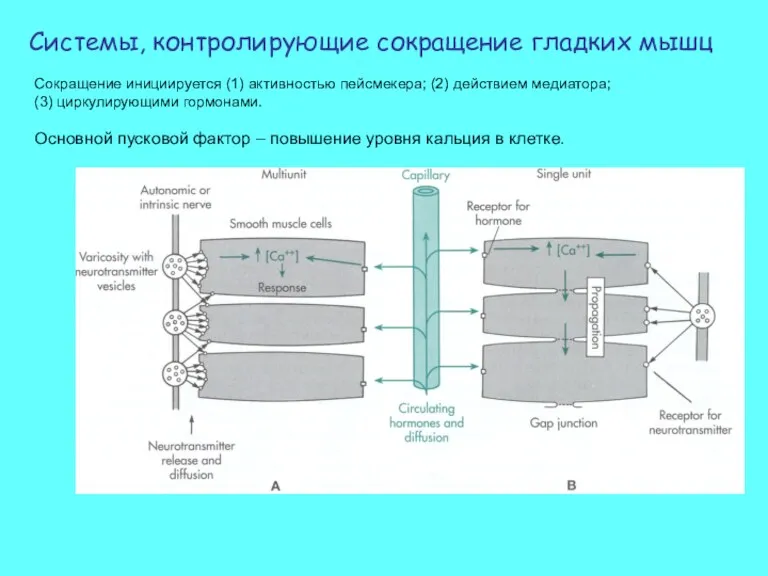
- 40. Сокращение инициируется (1) активностью пейсмекера; (2) действием медиатора; (3) циркулирующими гормонами. Основной пусковой фактор – повышение
- 41. Модуляция гладких мышц медиаторами,гормонами и местными факторами
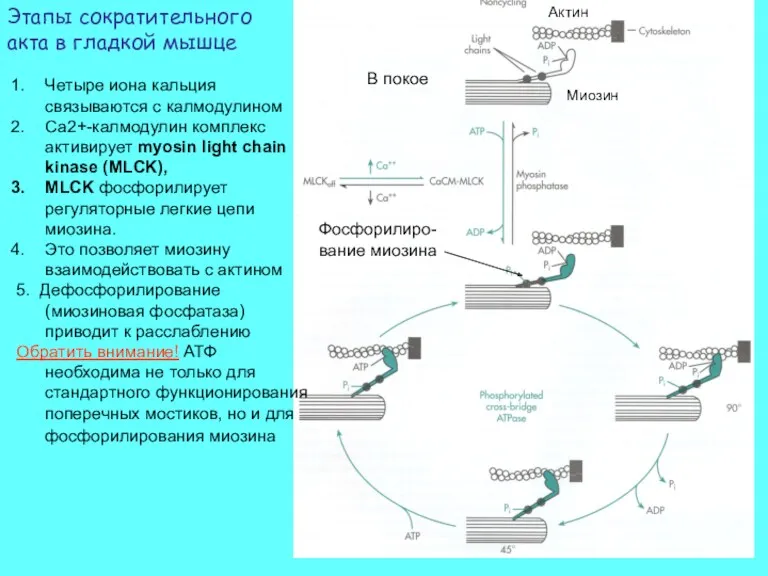
- 42. Актин Миозин В покое Фосфорилиро-вание миозина Четыре иона кальция связываются с калмодулином Ca2+-калмодулин комплекс активирует myosin
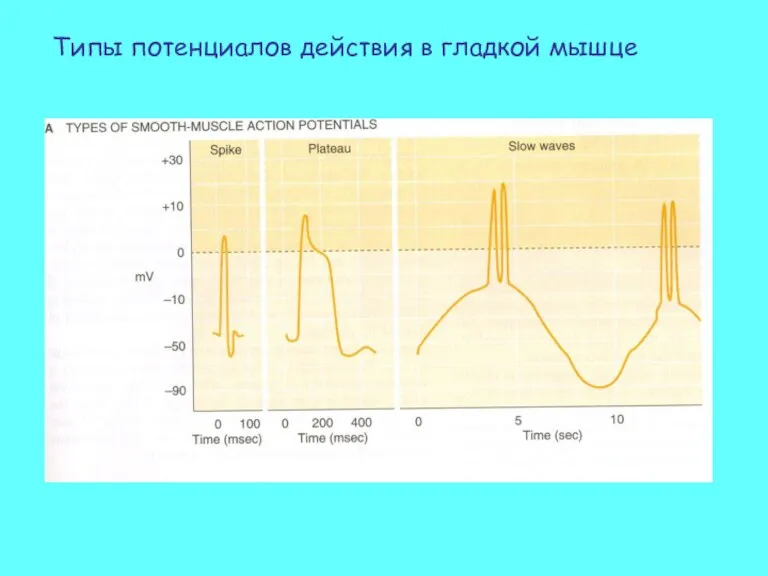
- 43. Типы потенциалов действия в гладкой мышце
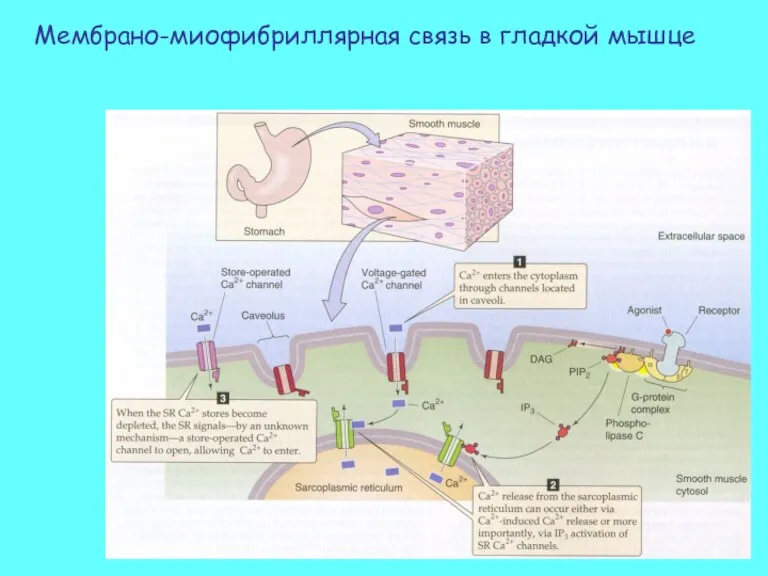
- 44. Мембрано-миофибриллярная связь в гладкой мышце
- 45. Снижение уровня кальция в гладкой мышце как механизм расслабления Фосфоламбин
- 46. Гладкая мышца
- 47. Сердечная мышца
- 48. Особенности сердечной мышечной ткани Представляет собой электрический синцитий Волокна всех волокон определенного отдела сердца сокращаются одновременно
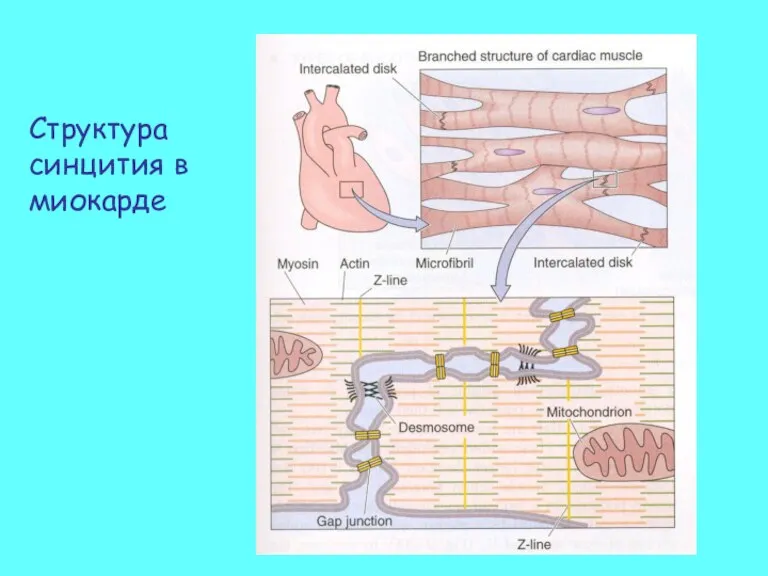
- 49. Структура синцития в миокарде
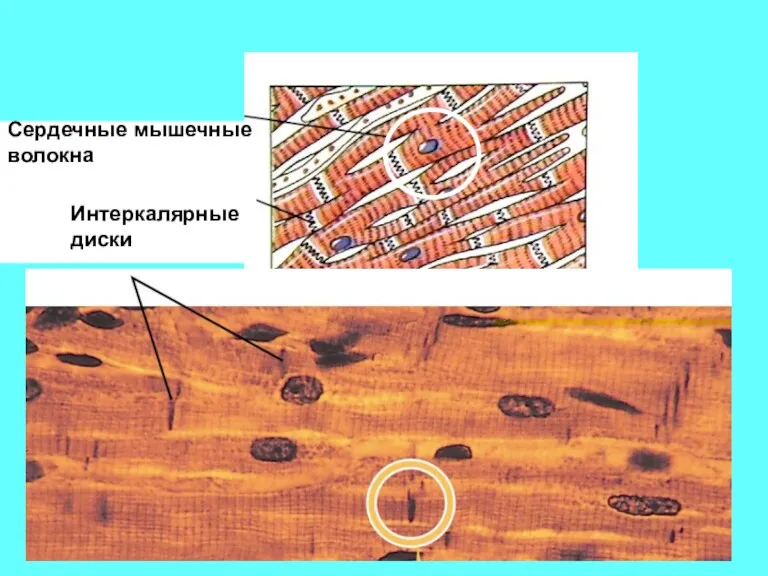
- 50. Интеркалярные диски Сердечные мышечные волокна
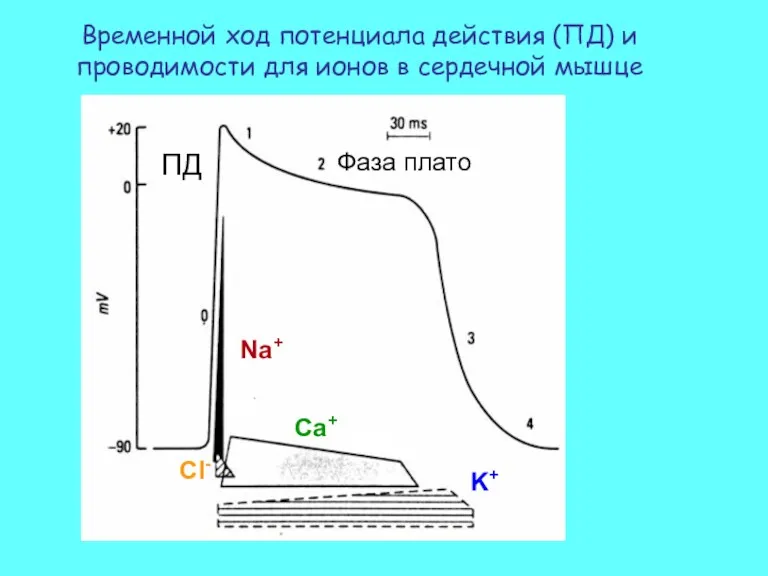
- 51. Временной ход потенциала действия (ПД) и проводимости для ионов в сердечной мышце Na+ Ca+ K+ Cl-
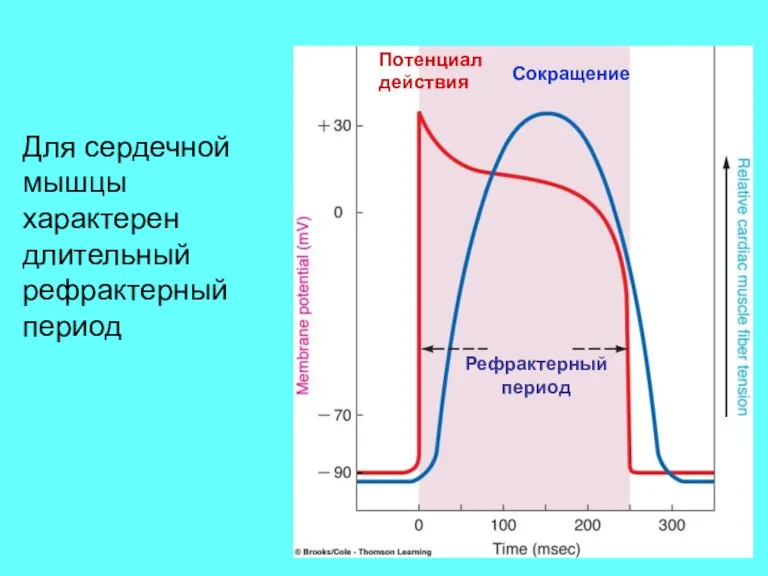
- 52. Потенциал действия Сокращение Рефрактерный период Для сердечной мышцы характерен длительный рефрактерный период
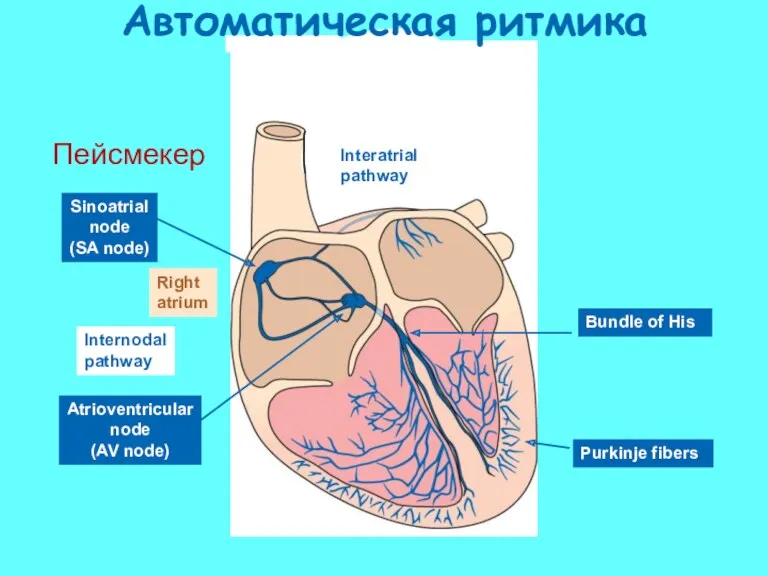
- 53. Sinoatrial node (SA node) Right atrium Internodal pathway Purkinje fibers Bundle of His Atrioventricular node (AV
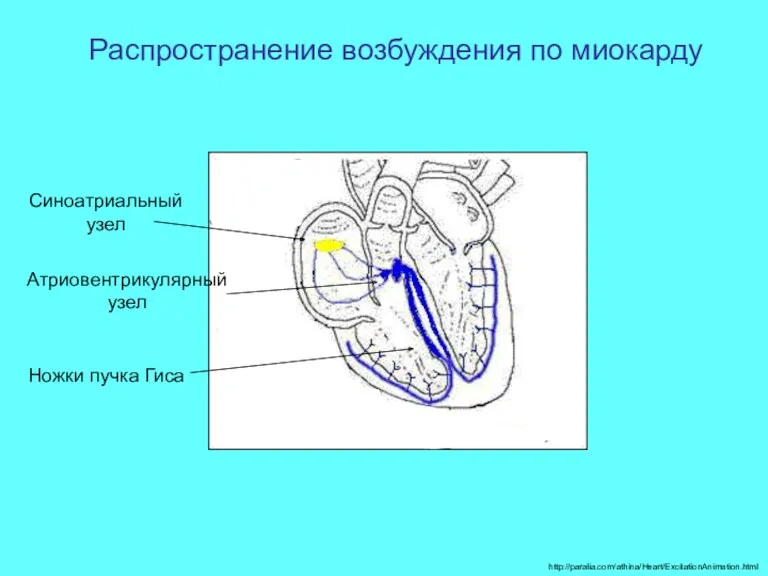
- 54. http://paralia.com/athina/Heart/ExcitationAnimation.html Распространение возбуждения по миокарду Синоатриальный узел Атриовентрикулярный узел Ножки пучка Гиса
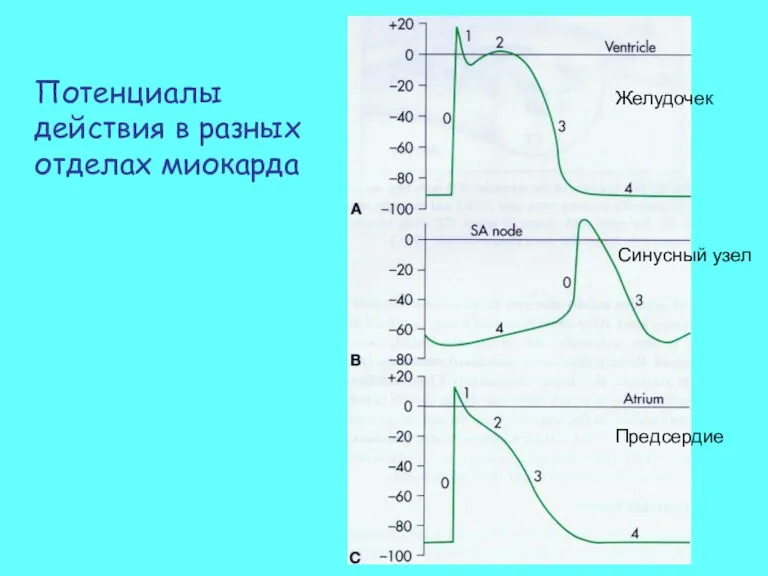
- 55. Потенциалы действия в разных отделах миокарда Желудочек Предсердие Синусный узел
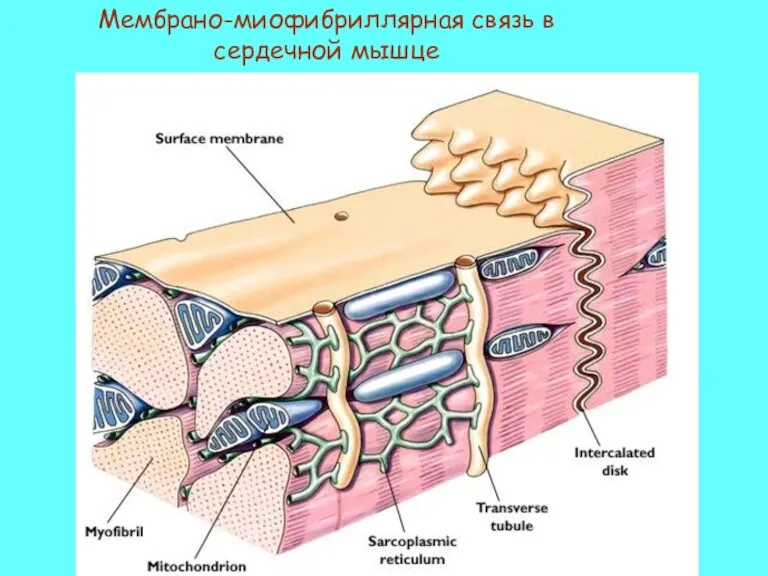
- 56. Мембрано-миофибриллярная связь в сердечной мышце
- 57. Сердечная мышца
- 59. Скачать презентацию















 Основные радиационные и биологические факторы, определяющие радиобиологические эффекты
Основные радиационные и биологические факторы, определяющие радиобиологические эффекты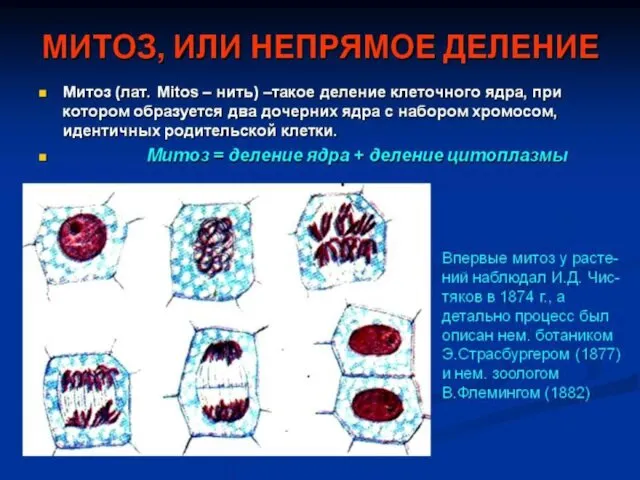 Типы деления клеток. Митоз
Типы деления клеток. Митоз Ядро клетки
Ядро клетки Мутации – изменения в структуре генов
Мутации – изменения в структуре генов Биология оқыту әдістемесінің негізгі дидактикалық принциптері. Биология оқыту формаларының жүйелері
Биология оқыту әдістемесінің негізгі дидактикалық принциптері. Биология оқыту формаларының жүйелері Анатомия и возрастная физиология как учебная дисциплина
Анатомия и возрастная физиология как учебная дисциплина 27 февраля – День белого медведя
27 февраля – День белого медведя Своя игра. Знатоки млекопитающих
Своя игра. Знатоки млекопитающих Азбука здоровья от А до Я
Азбука здоровья от А до Я Тема урока: Кровообращение (9-й класс)
Тема урока: Кровообращение (9-й класс) Электронный атлас растений
Электронный атлас растений Фото цветов
Фото цветов Органы дыхательной системы.
Органы дыхательной системы. Этикет и цветы
Этикет и цветы Болезни картофеля и меры борьбы с ними
Болезни картофеля и меры борьбы с ними Respiratory system
Respiratory system Строение цветка
Строение цветка Транспорт асимілятів як основна об΄єднуюча ланка для пересування метаболітів та їх використання в синтетичних процесах
Транспорт асимілятів як основна об΄єднуюча ланка для пересування метаболітів та їх використання в синтетичних процесах Влияние факторов внешней среды на микроорганизмы
Влияние факторов внешней среды на микроорганизмы Цветок, его строение и значение. Соцветия
Цветок, его строение и значение. Соцветия Агроценоз и агроэкосистема
Агроценоз и агроэкосистема Тип кільчасті черви
Тип кільчасті черви Покриви тіла тварин
Покриви тіла тварин Центральная догма молекулярной биологии. Синтез РНК по матрице ДНК
Центральная догма молекулярной биологии. Синтез РНК по матрице ДНК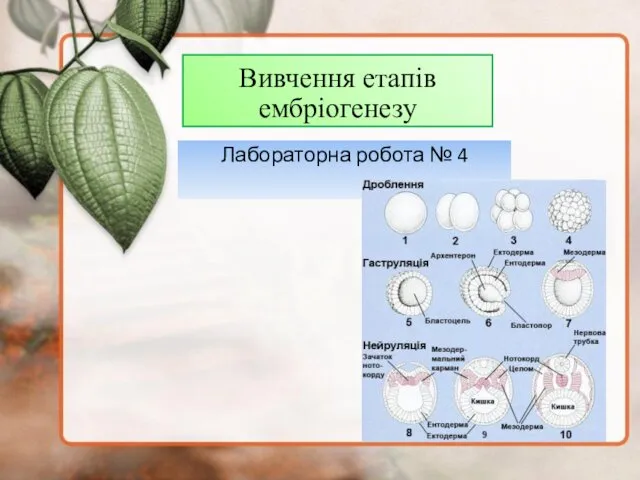 Вивчення етапів ембріогенезу
Вивчення етапів ембріогенезу Низшие растения водоросли
Низшие растения водоросли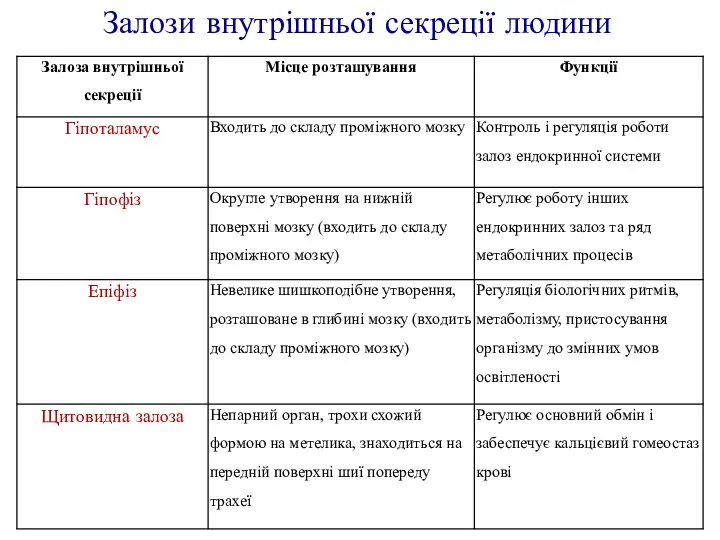 Залози внутрішньої секреції людини
Залози внутрішньої секреції людини Что такое природа
Что такое природа