Содержание
- 2. П Л А Н Классификация, строение, свойства аминокислот. Пути образования пула аминокислот в крови и его
- 3. Реакции использования и обезвреживания аммиака: образование глутамина, аспарагина, мочевины. Тканевые особенности. Связь орнитинового цикла с обменом
- 4. Всего известно около 300 видов АК, человека в организме - 70, а в составе белков -
- 5. Аминокислоты классифицируются По количеству карбоксильных и аминогрупп По функциональным группам в радикале По способности к синтезу
- 6. Классификация АК по природе радикала: 1). алифатические (гли, ала, вал, лей, иле и.т.д.); 2). Ароматические карбо-
- 7. Классификация АК по способности к синтезу Заменимые - синтезируются в организме (глицин, аспарагиновая кислота, аспарагин, глутаминовая
- 8. ФУНКЦИИ АК Используются для синтеза белков, углеводов, липидов, нуклеиновых кислот, биогенных аминов (гормонов, нейромедиаторов), других АК
- 9. Гликогенные аминокислоты - превращаются в ПВК и промежуточные продукты ЦТК (а-КГ, сукцинил-КоА, фумарат, ЩУК). через ЩУК,
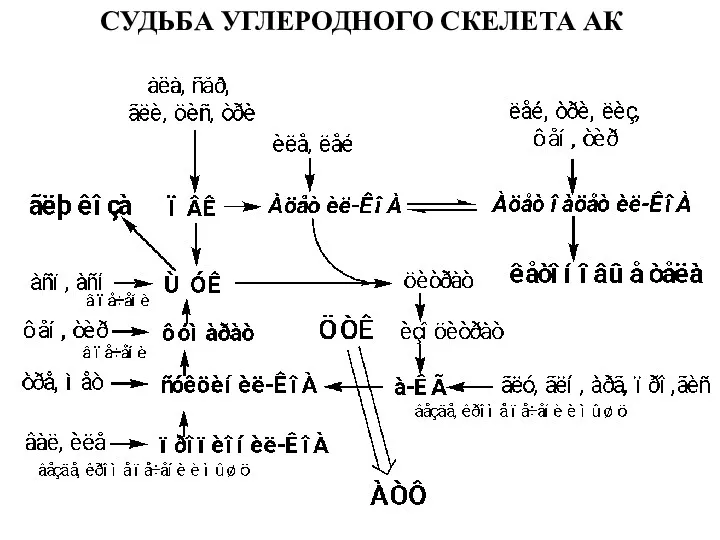
- 10. СУДЬБА УГЛЕРОДНОГО СКЕЛЕТА АК
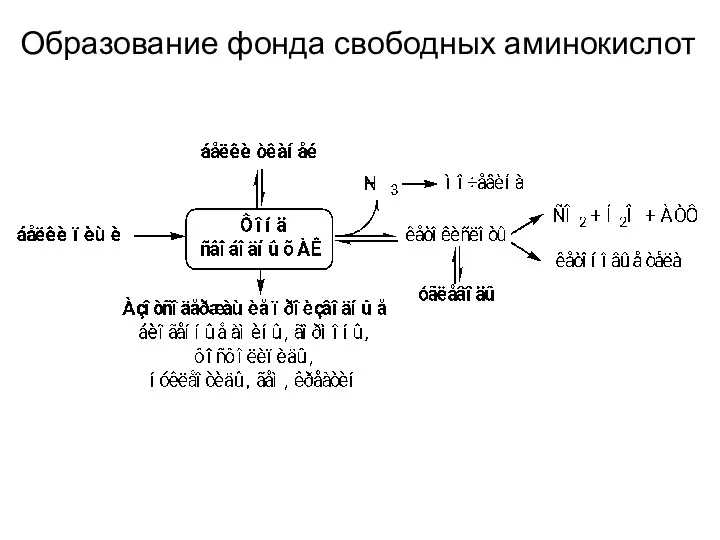
- 11. Образование фонда свободных аминокислот
- 12. Общие реакции обмена аминокислот Биосинтез белка Трансаминирование Дезаминирование Декарбоксилирование Изомеризация Образование оснований Шиффа (при гликозилировании белков).
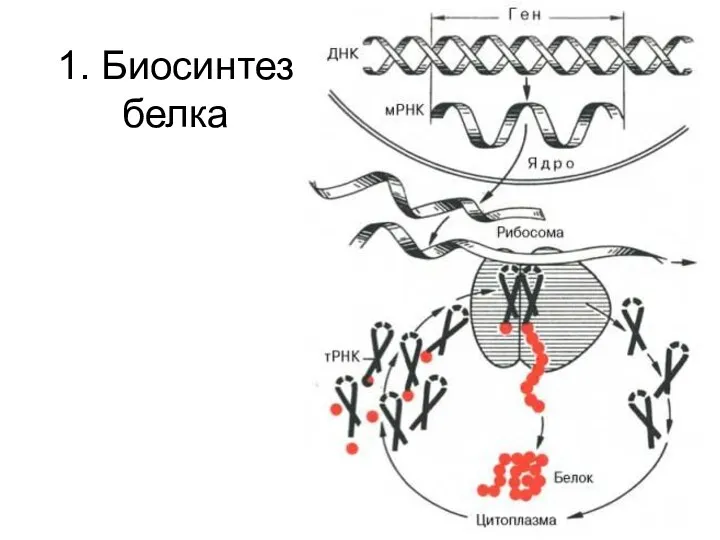
- 13. 1. Биосинтез белка
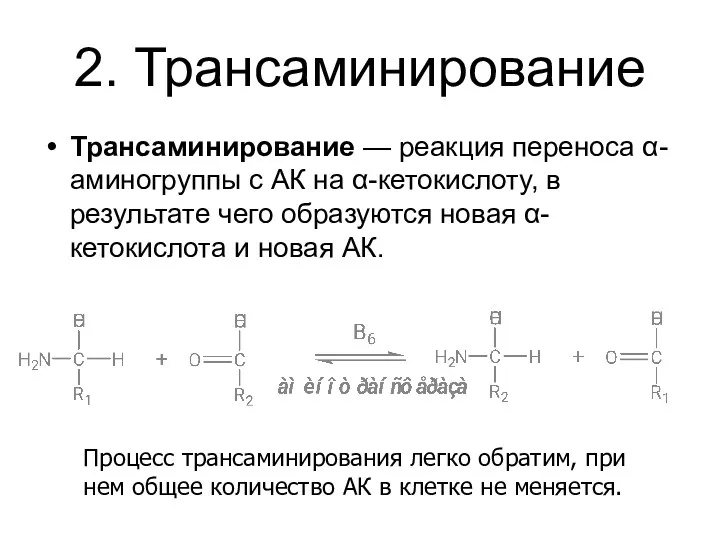
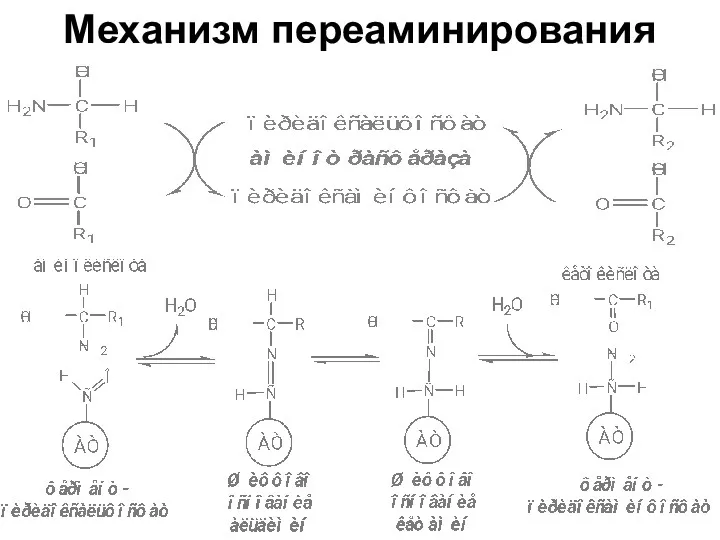
- 14. 2. Трансаминирование Трансаминирование — реакция переноса α-аминогруппы с АК на α-кетокислоту, в результате чего образуются новая
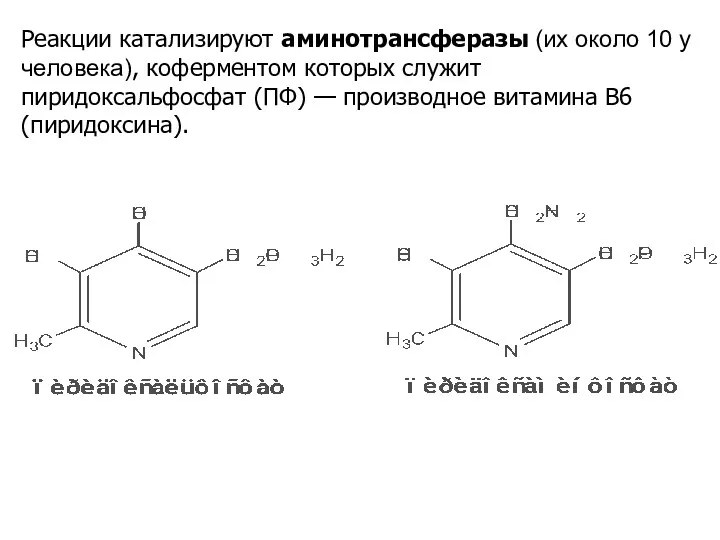
- 15. Реакции катализируют аминотрансферазы (их около 10 у человека), коферментом которых служит пиридоксальфосфат (ПФ) — производное витамина
- 16. Механизм переаминирования
- 17. 3. ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ — реакция отщепления α-аминогруппы от АК, в результате чего образуется соответствующая α-кетокислота и
- 18. А. виды прямого дезаминирования АК Окислительное (самое активное); неокислительное; внутримолекулярное; восстановительное; гидролитическое.
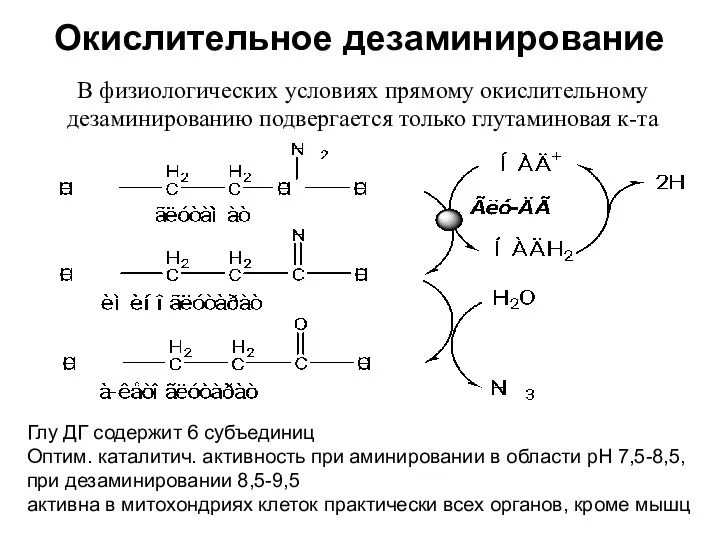
- 19. Окислительное дезаминирование В физиологических условиях прямому окислительному дезаминированию подвергается только глутаминовая к-та Глу ДГ содержит 6
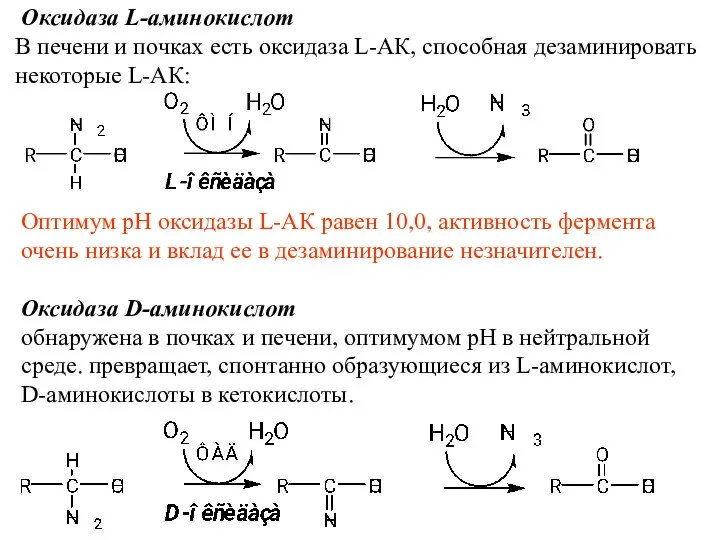
- 20. Оксидаза L-аминокислот В печени и почках есть оксидаза L-АК, способная дезаминировать некоторые L-АК: Оптимум рН оксидазы
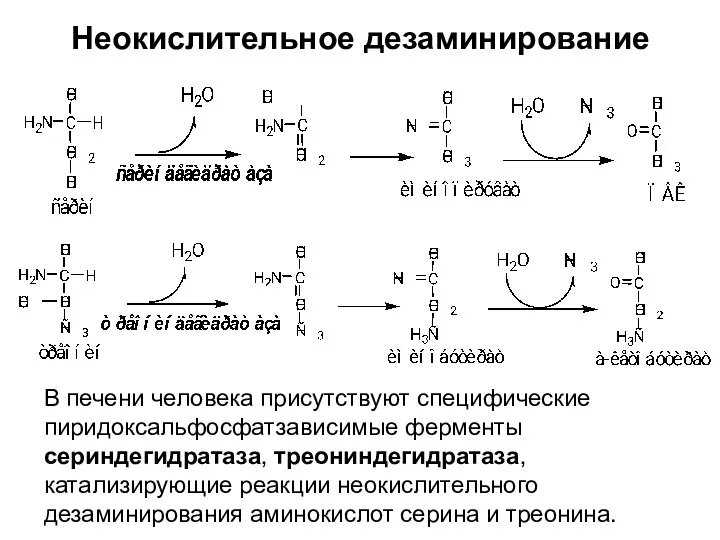
- 21. Неокислительное дезаминирование В печени человека присутствуют специфические пиридоксальфосфатзависимые ферменты сериндегидратаза, треониндегидратаза, катализирующие реакции неокислительного дезаминирования аминокислот
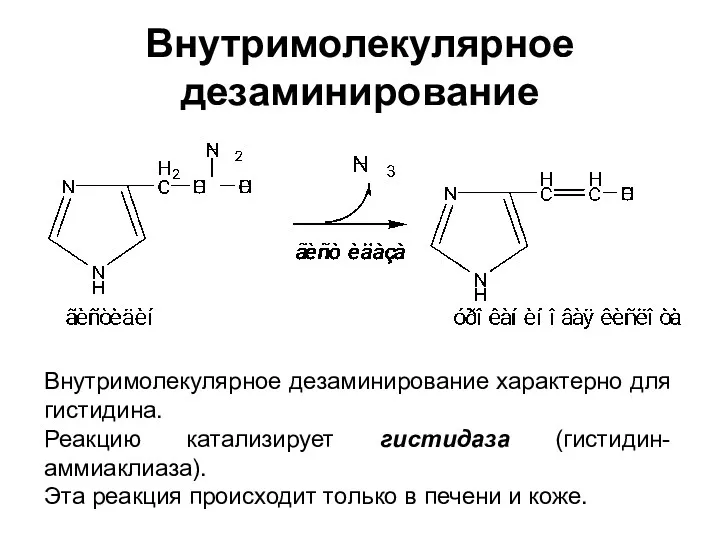
- 22. Внутримолекулярное дезаминирование Внутримолекулярное дезаминирование характерно для гистидина. Реакцию катализирует гистидаза (гистидин-аммиаклиаза). Эта реакция происходит только в
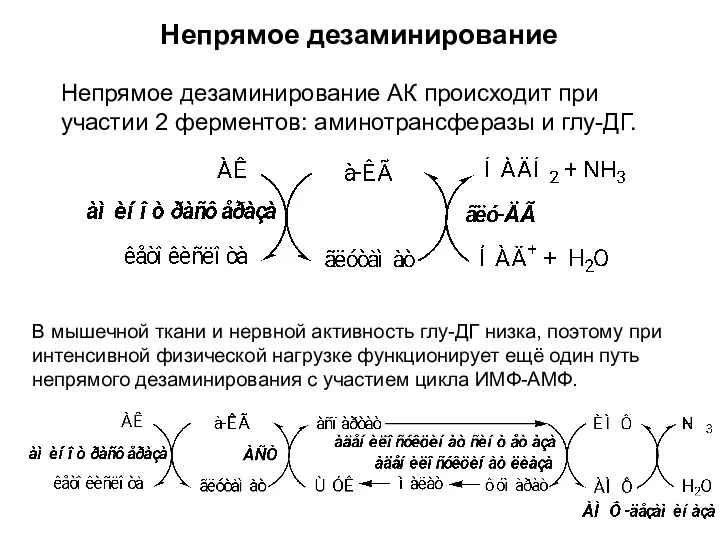
- 23. Б. Непрямое дезаминирование АК происходит в 2 стадии с участием нескольких ферментов. характерно для большинства АК,
- 24. Непрямое дезаминирование В мышечной ткани и нервной активность глу-ДГ низка, поэтому при интенсивной физической нагрузке функционирует
- 25. Органоспецифичные ферменты АЛТ: ала + α-КГ ↔ ПВК + глу локализуется в цитозоле в клеток печени
- 26. БИОЛОГИЧЕСКАЯ РОЛЬ АМИНОТРАНСФЕРАЗ 1. Очень активные и распространенные в тканях ферменты, особенно АсАТ и АлАТ 2.
- 27. Декарбоксилирование –это процесс отщепления карбоксильной группы от аминокислот. Реакцию катализируют лиазы, которые в качестве кофермента содержат
- 28. типы декарбоксилирования аминокислот α-Декарбоксилирование, ω-Декарбоксилирование Декарбоксилирование, связанное с реакцией трансаминирования, Декарбоксилирование связанное с реакцией конденсации двух
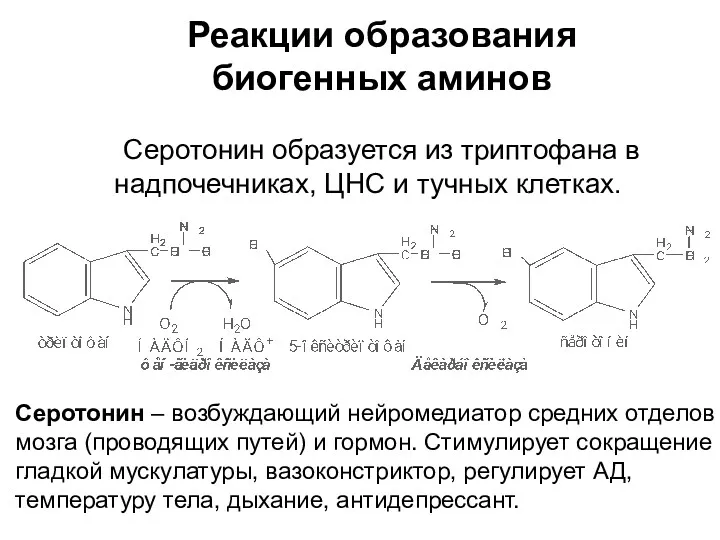
- 29. Реакции образования биогенных аминов Серотонин образуется из триптофана в надпочечниках, ЦНС и тучных клетках. Серотонин –
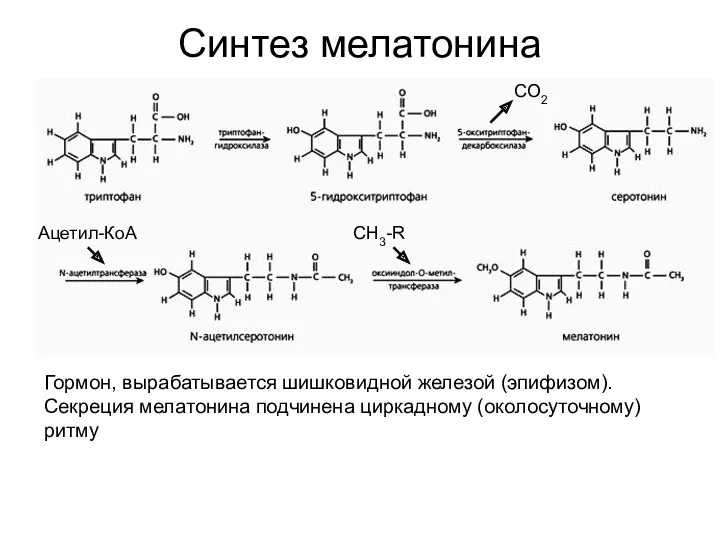
- 30. Синтез мелатонина Ацетил-КоА Гормон, вырабатывается шишковидной железой (эпифизом). Секреция мелатонина подчинена циркадному (околосуточному) ритму СО2 СН3-R
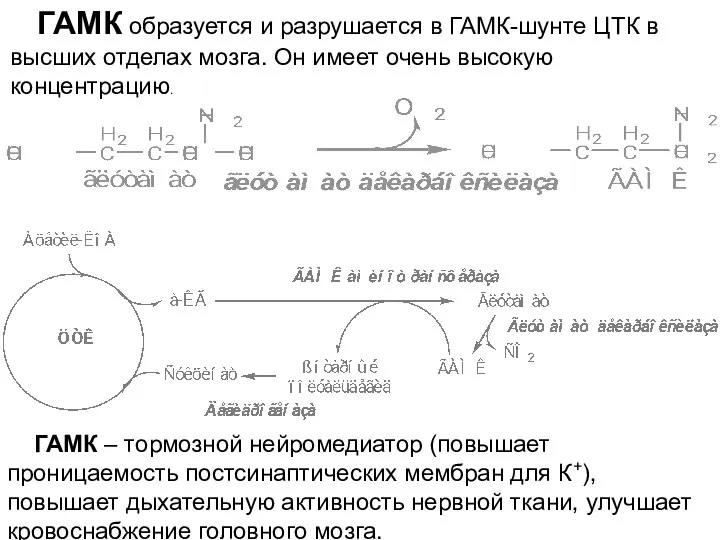
- 31. ГАМК образуется и разрушается в ГАМК-шунте ЦТК в высших отделах мозга. Он имеет очень высокую концентрацию.
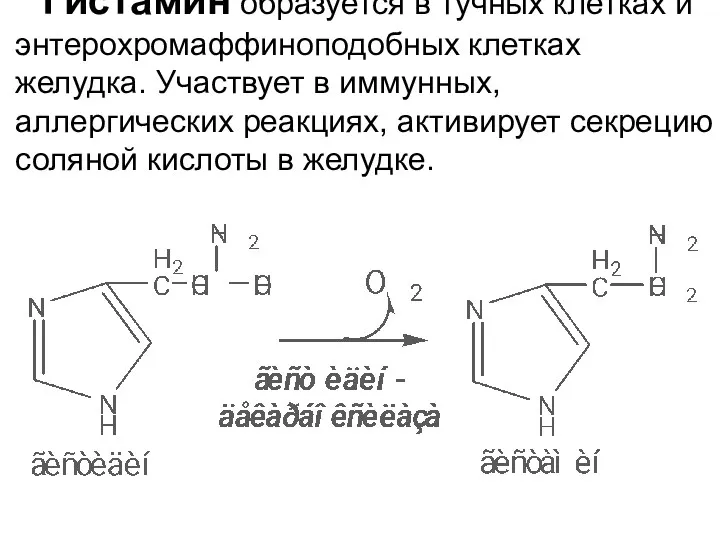
- 32. Гистамин образуется в тучных клетках и энтерохромаффиноподобных клетках желудка. Участвует в иммунных, аллергических реакциях, активирует секрецию
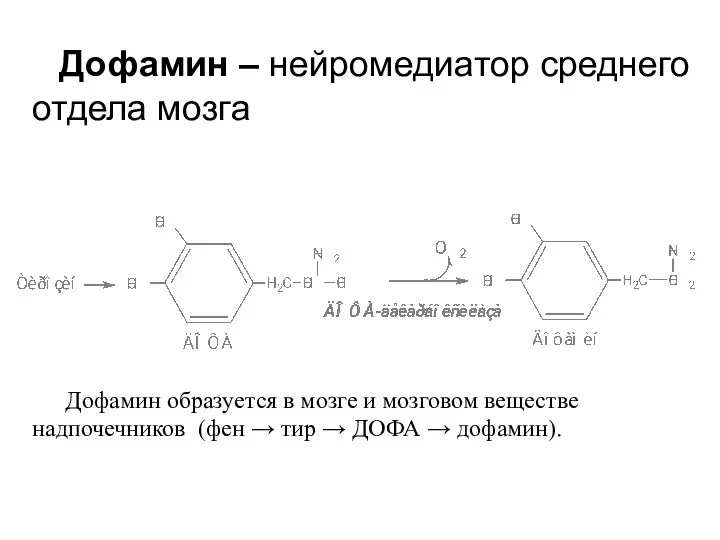
- 33. Дофамин образуется в мозге и мозговом веществе надпочечников (фен → тир → ДОФА → дофамин). Дофамин
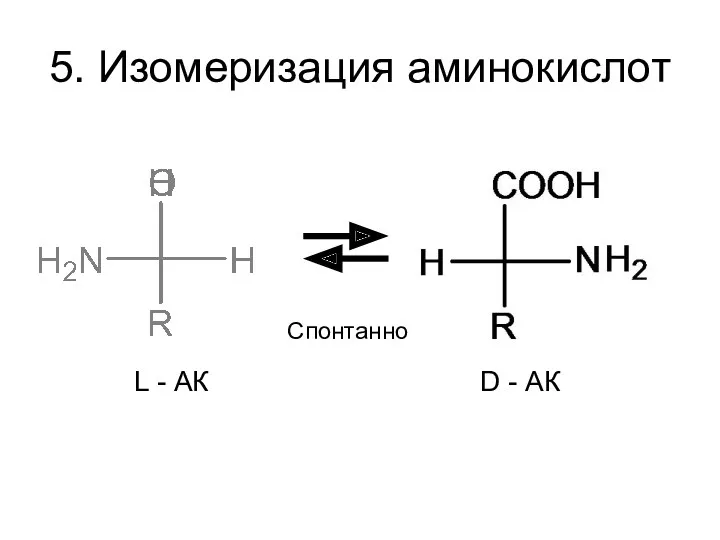
- 34. 5. Изомеризация аминокислот L - АК D - АК Спонтанно
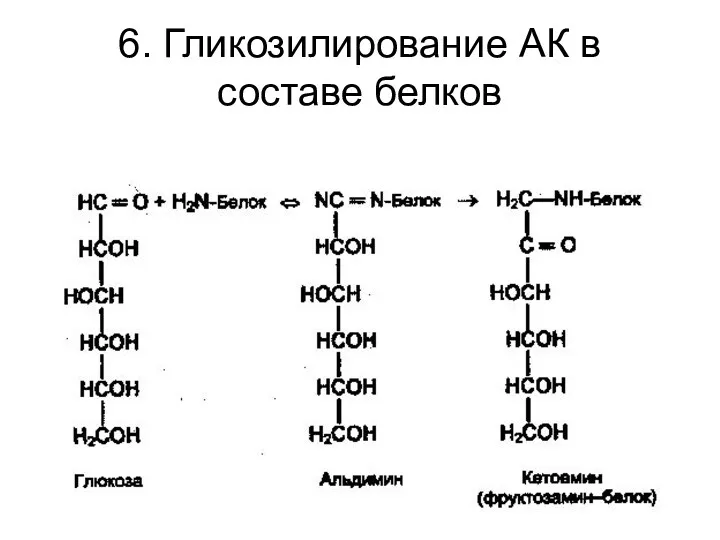
- 35. 6. Гликозилирование АК в составе белков
- 36. ОБМЕН АММИАКА образуется при: дезаминировании АК во всех тканях (много) дезаминировании биогенных аминов и нуклеотидов во
- 37. Концентрация аммиака в норме 99% - в виде иона аммония NH4+ 1% - неионизированного NH3
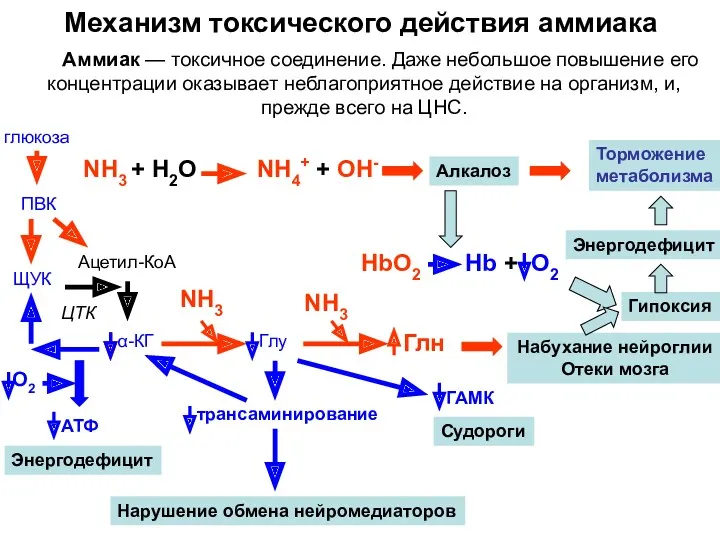
- 38. Механизм токсического действия аммиака Аммиак — токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие
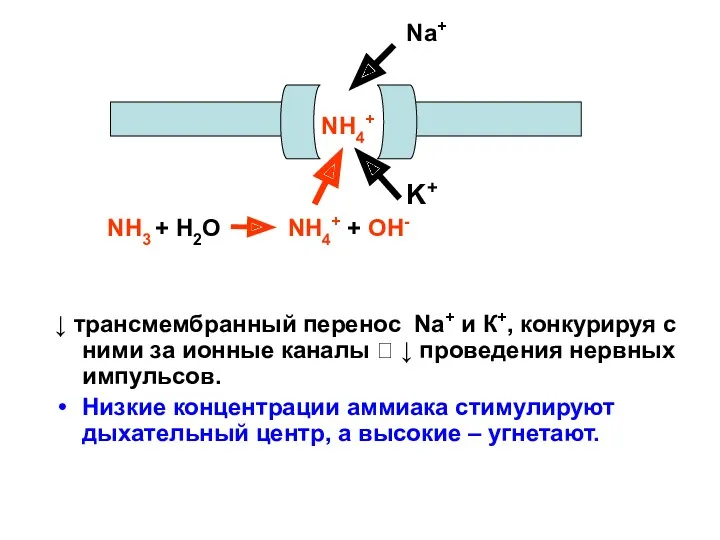
- 39. ↓ трансмембранный перенос Na+ и К+, конкурируя с ними за ионные каналы ? ↓ проведения нервных
- 40. Клинические признаки острого отравления парами аммиака Головокружение Потеря памяти Потеря сознания Бред Возбужденное состояние Судороги Удушье
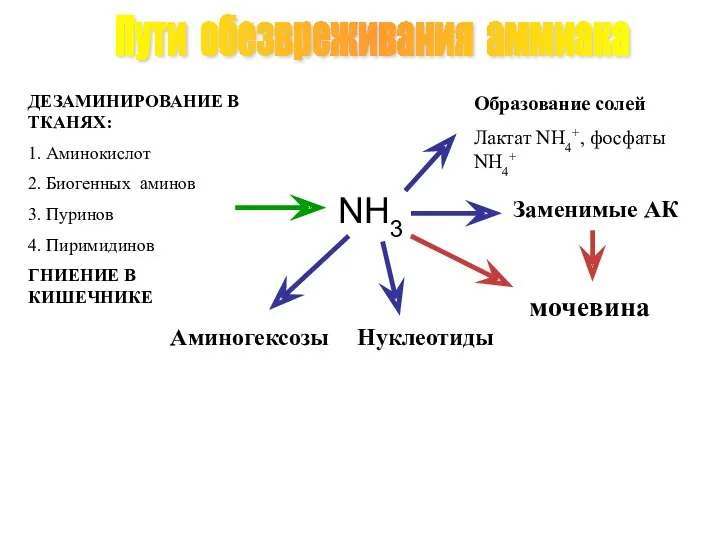
- 41. Пути обезвреживания аммиака ДЕЗАМИНИРОВАНИЕ В ТКАНЯХ: 1. Аминокислот 2. Биогенных аминов 3. Пуринов 4. Пиримидинов ГНИЕНИЕ
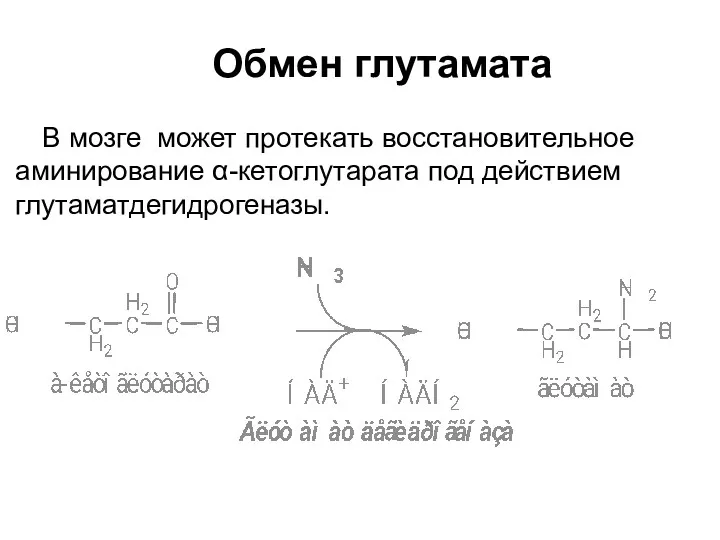
- 42. Обмен глутамата В мозге может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы.
- 43. Обмен глутамина Основной реакцией связывания аммиака, протекающей во всех тканях организма (основные поставщики мышцы, мозг и
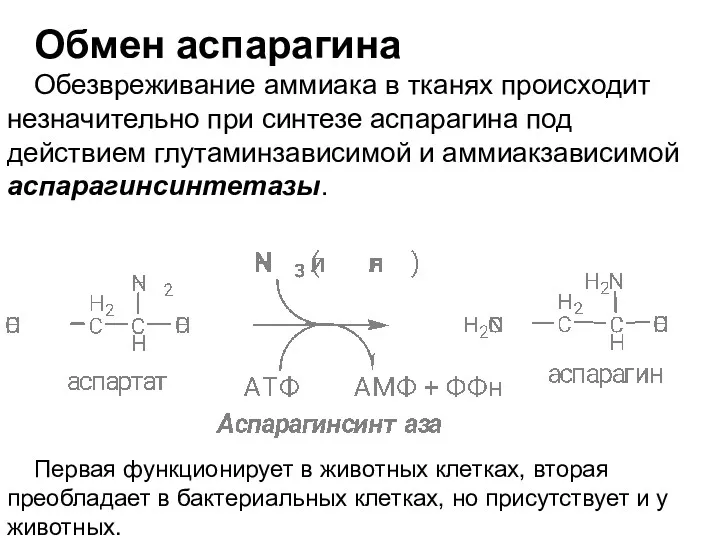
- 44. Обмен аспарагина Обезвреживание аммиака в тканях происходит незначительно при синтезе аспарагина под действием глутаминзависимой и аммиакзависимой
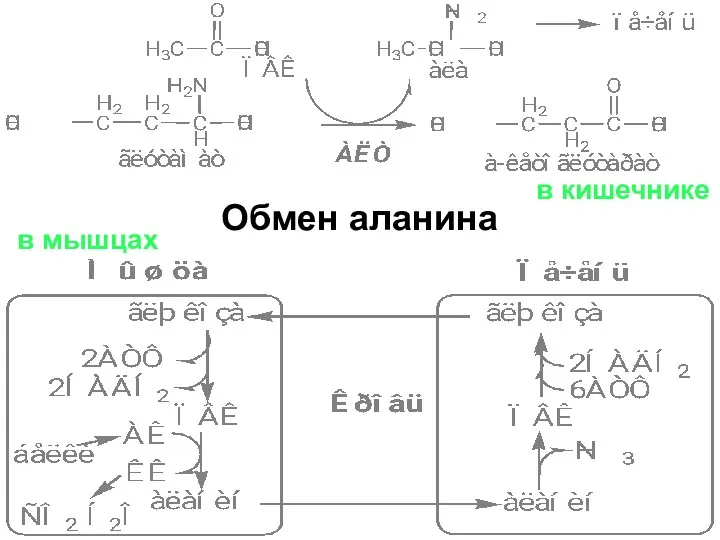
- 45. Обмен аланина в кишечнике в мышцах
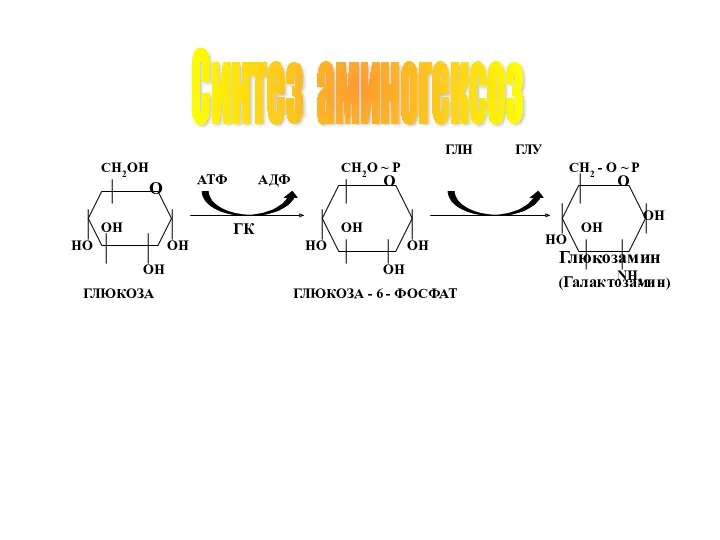
- 46. Синтез аминогексоз О ОН ОН ОН НО CH2OH O НО ОН ОН ОН СН2O ~ P
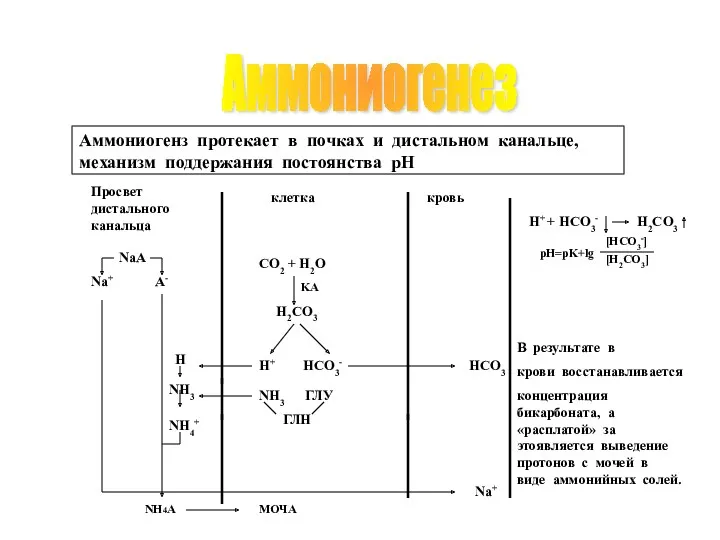
- 47. Аммониогенез H+ HCO3- Na+ В результате в крови восстанавливается концентрация бикарбоната, а «расплатой» за этоявляется выведение
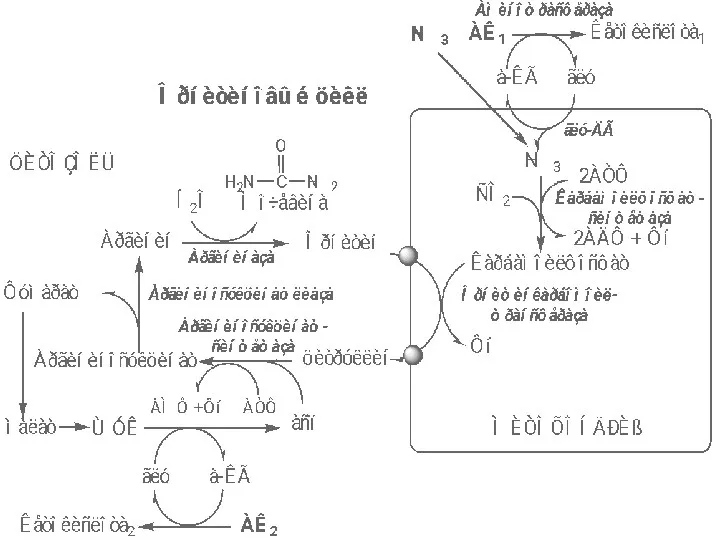
- 48. Реакции орнитинового цикла В митохондриях под действием карбамоилфосфатсинтетазы I с затратой 2 АТФ аммиак связывается с
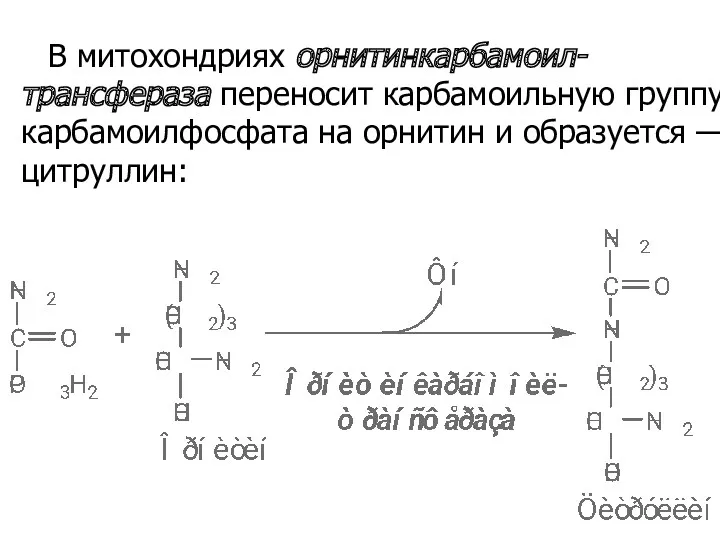
- 49. В митохондриях орнитинкарбамоил-трансфераза переносит карбамоильную группу карбамоилфосфата на орнитин и образуется — цитруллин:
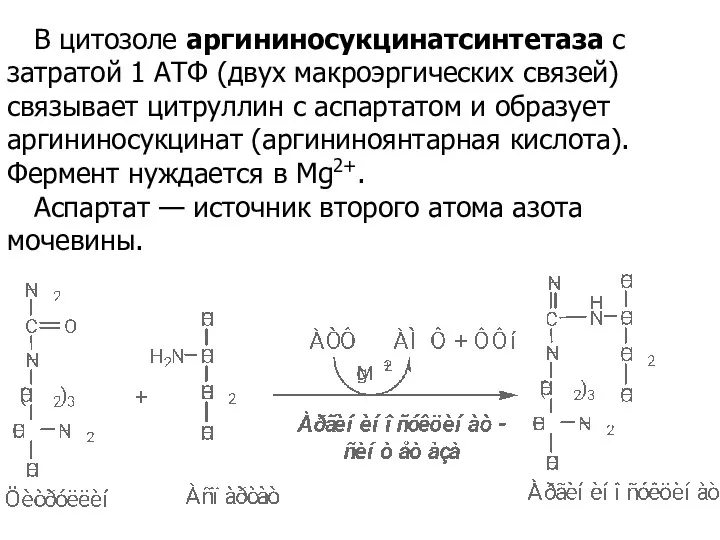
- 50. В цитозоле аргининосукцинатсинтетаза с затратой 1 АТФ (двух макроэргических связей) связывает цитруллин с аспартатом и образует
- 51. В цитозоле аргининосукцинатлиаза (аргининсукциназа) расщепляет аргининосукцинат на аргинин и фумарат (аминогруппа аспартата оказывается в аргинине).
- 52. В цитозоле аргиназа гидролизует аргинин на орнитин и мочевину. У аргиназы кофакторы ионы Са2+ или Мn2+,
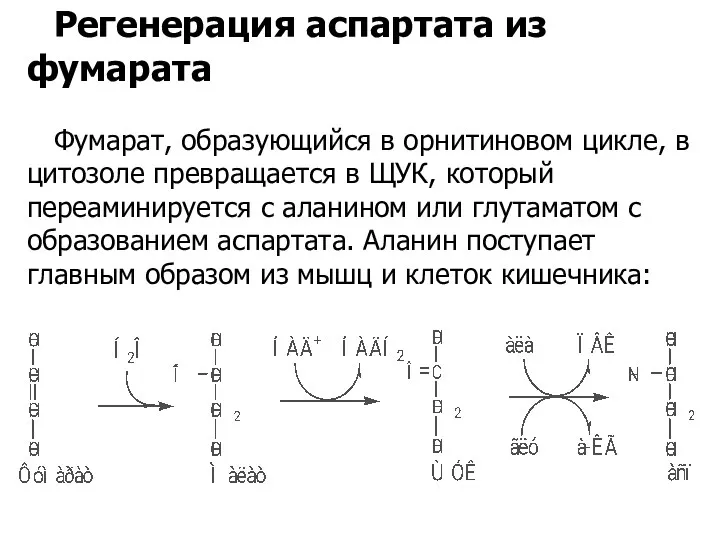
- 53. Регенерация аспартата из фумарата Фумарат, образующийся в орнитиновом цикле, в цитозоле превращается в ЩУК, который переаминируется
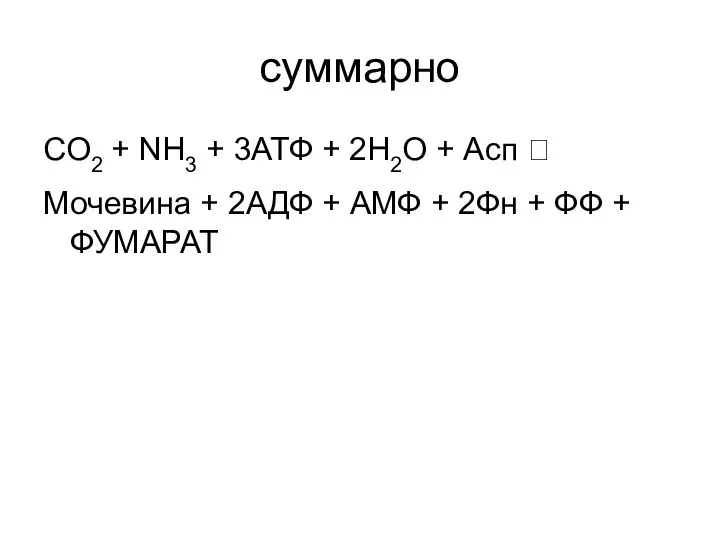
- 55. суммарно СO2 + NH3 + 3АТФ + 2H2O + Асп ? Мочевина + 2АДФ + АМФ
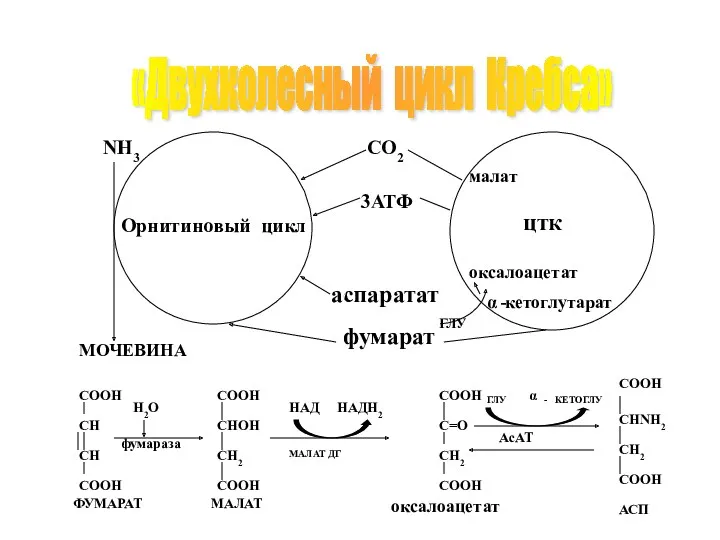
- 56. Взаимосвязь орнитинового цикла с ЦТК Для аминирования необходима доступность кислот цикла Кребса. Глутамат, образуемый при переаминировании,
- 57. «Двухколесный цикл Кребса»
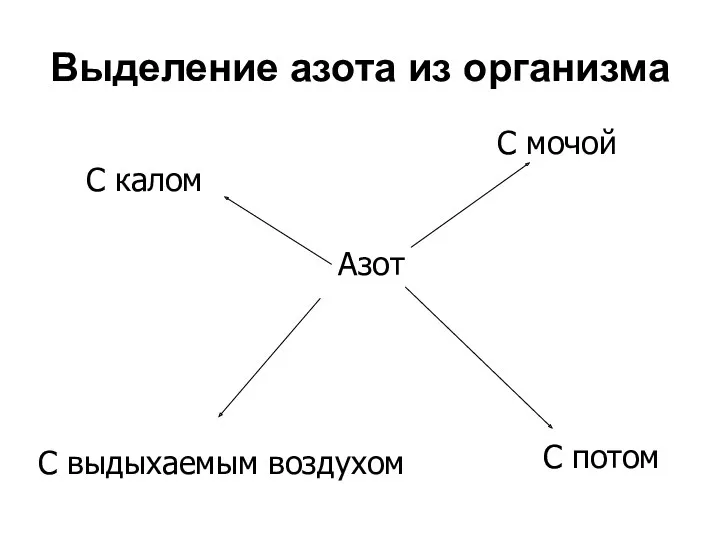
- 58. Выделение азота из организма Азот C мочой C калом C потом C выдыхаемым воздухом
- 60. Скачать презентацию
























 Эндокринная система. Железы внутренней секреции, строение, функции
Эндокринная система. Железы внутренней секреции, строение, функции Сауын сиырды азықтандыру
Сауын сиырды азықтандыру Кроссинговер
Кроссинговер Технологія виробництва м’яса бройлерів
Технологія виробництва м’яса бройлерів Жұмыр құрттар
Жұмыр құрттар Пресноводные рыбы. Игры и упражнения
Пресноводные рыбы. Игры и упражнения Вирусы и фаги
Вирусы и фаги Внутриутробное развитие человека
Внутриутробное развитие человека Зоология – наука о животных
Зоология – наука о животных Chondrichthyes. Хрящевые рыбы
Chondrichthyes. Хрящевые рыбы Биологические ресурсы пригородных лесов Владивостока
Биологические ресурсы пригородных лесов Владивостока Центры происхождения культурных растений
Центры происхождения культурных растений Фазовые переходы в мембранах. Лиотропный мезоморфизм липидов
Фазовые переходы в мембранах. Лиотропный мезоморфизм липидов Биология в искусстве. Интеллектуальный марафон Биологическое соцветие
Биология в искусстве. Интеллектуальный марафон Биологическое соцветие Перелетные птицы
Перелетные птицы Фотосинтез. Общие представления о фотосинтезе
Фотосинтез. Общие представления о фотосинтезе Cell structure. Cell Theory
Cell structure. Cell Theory Микробиологическое производство лекарственных средств, регуляторов роста и средств защиты растений
Микробиологическое производство лекарственных средств, регуляторов роста и средств защиты растений Здоровое питание. Технология, 5 класс
Здоровое питание. Технология, 5 класс Технологічні і біохімічні властивості м‘яса та м‘ясопродуктів. Будова тканин живих організмів
Технологічні і біохімічні властивості м‘яса та м‘ясопродуктів. Будова тканин живих організмів Внутрішнє середовище організму. Кров, її склад та функції
Внутрішнє середовище організму. Кров, її склад та функції Артериальная и венозная системы
Артериальная и венозная системы Комнатные растения в интерьере квартире
Комнатные растения в интерьере квартире Строение семян однодольных и двудольных растений. Морфология проростка. Прорастание семян
Строение семян однодольных и двудольных растений. Морфология проростка. Прорастание семян Движение веществ в организме животных
Движение веществ в организме животных Лікарська сировина тваринного походження
Лікарська сировина тваринного походження Учение о популяции. Общая экология
Учение о популяции. Общая экология Как видят животные
Как видят животные