Содержание
- 2. Классификация органелл Ядро и цитозоль связаны между собой ядерными порами, являются топологически едиными, но выполняют разные
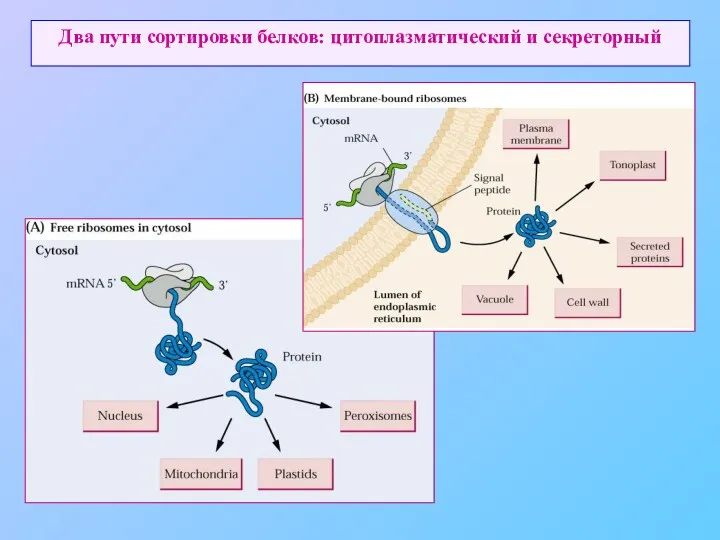
- 3. Два пути сортировки белков: цитоплазматический и секреторный
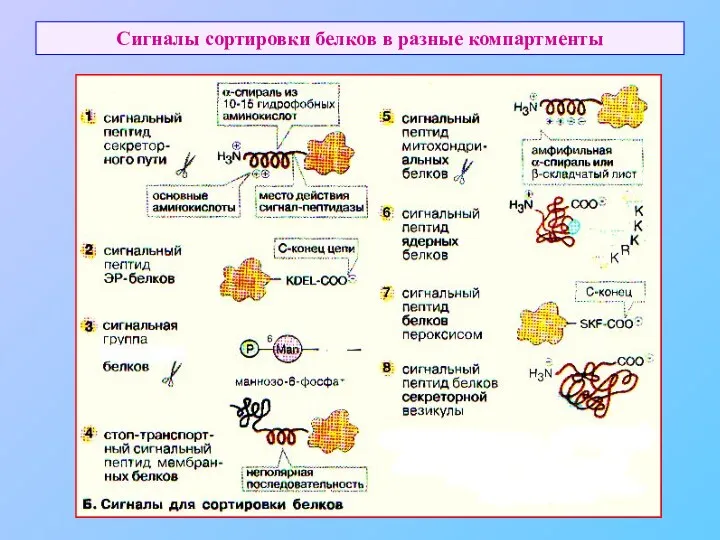
- 4. Сигналы сортировки белков в разные компартменты
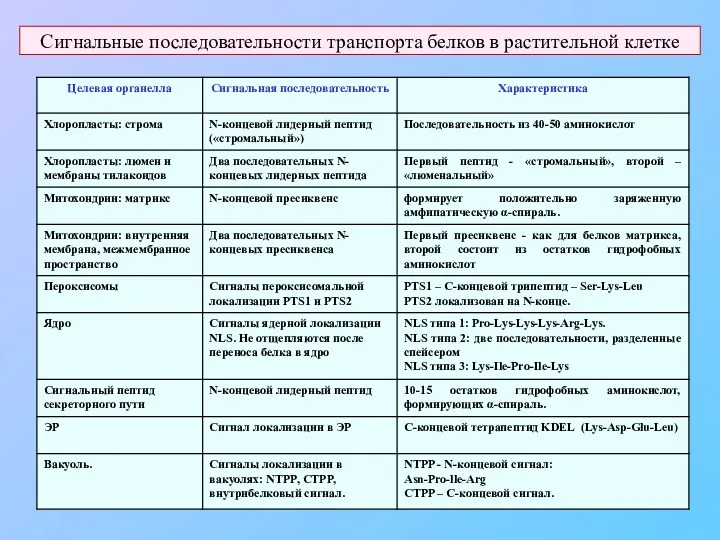
- 5. Сигнальные последовательности транспорта белков в растительной клетке
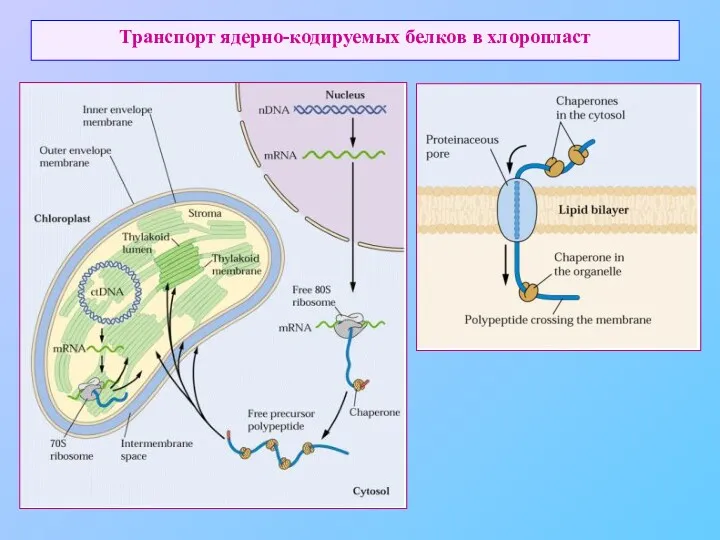
- 6. Транспорт ядерно-кодируемых белков в хлоропласт
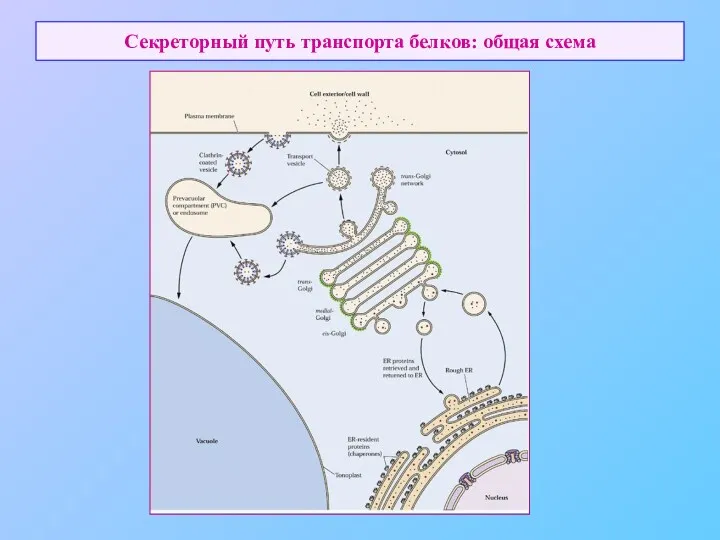
- 7. Секреторный путь транспорта белков: общая схема
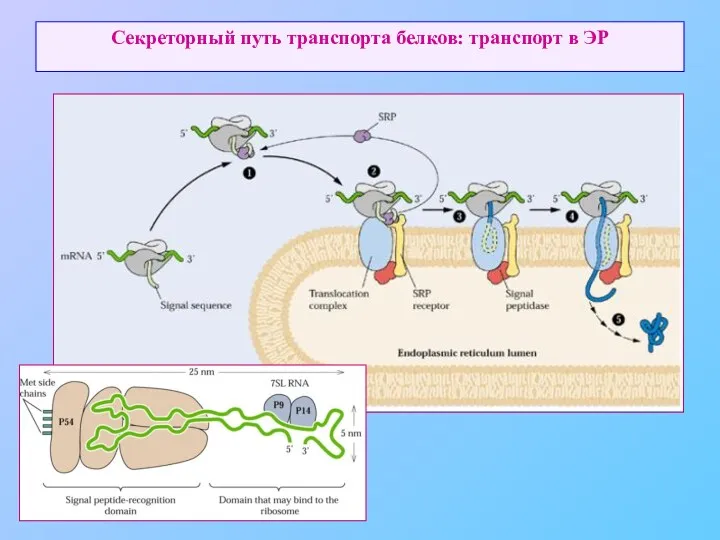
- 8. Секреторный путь транспорта белков: транспорт в ЭР
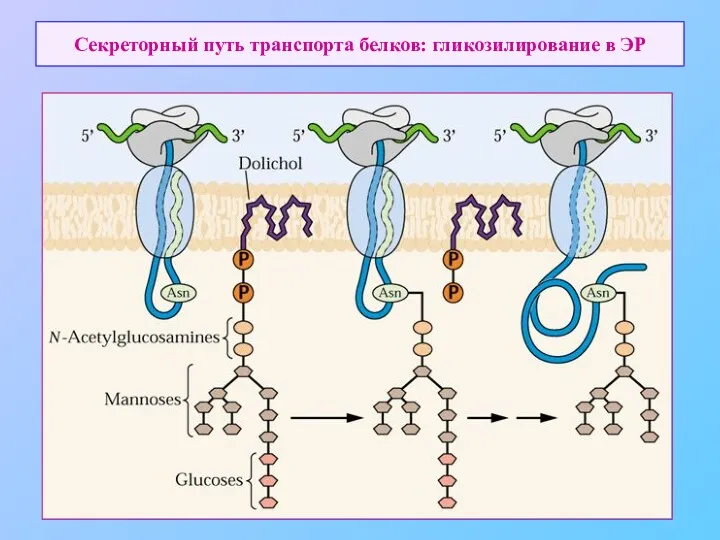
- 9. Секреторный путь транспорта белков: гликозилирование в ЭР
- 10. Клеточная стенка – это не «деревянная тюрьма» для несчастной клетки… С помощью клеточной стеки клетка решает
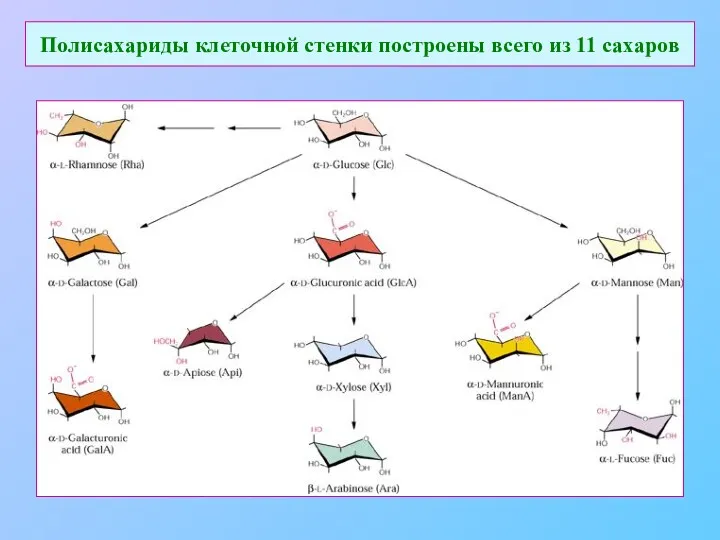
- 11. Полисахариды клеточной стенки построены всего из 11 сахаров
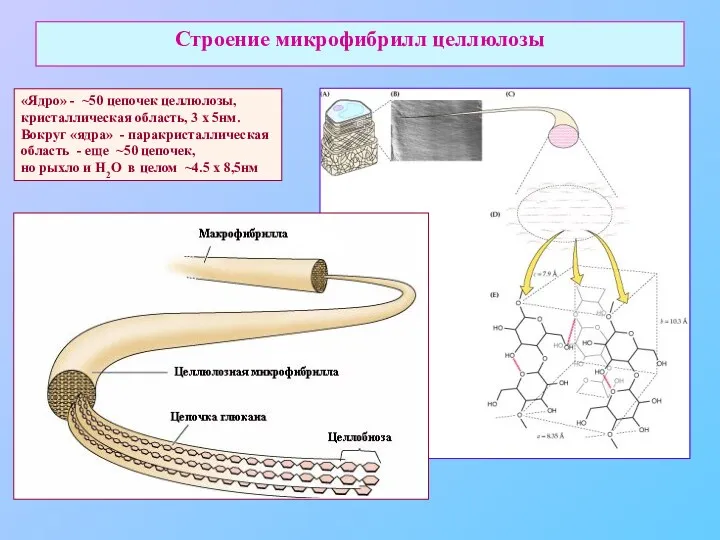
- 12. Строение микрофибрилл целлюлозы «Ядро» - ~50 цепочек целлюлозы, кристаллическая область, 3 х 5нм. Вокруг «ядра» -
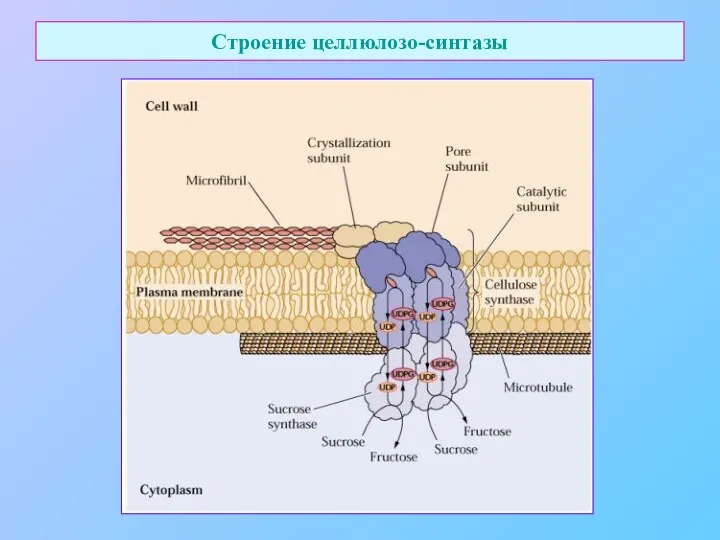
- 13. Строение целлюлозо-синтазы
- 14. Электронные фотографии КС с целлюлозо-синтазой
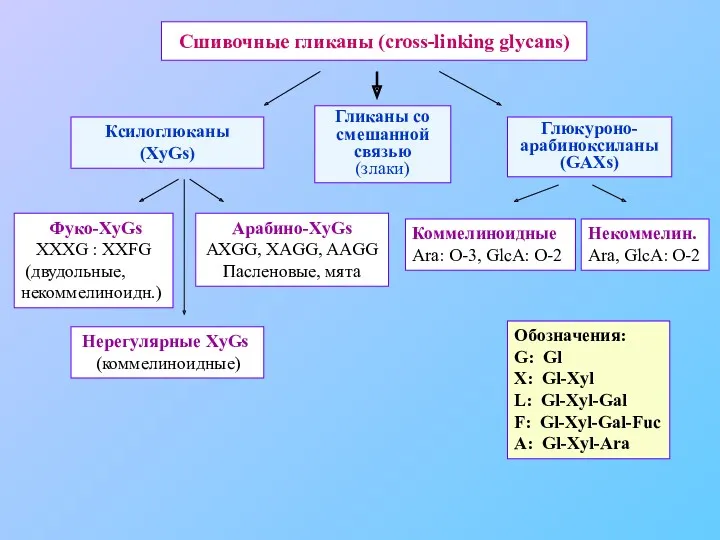
- 15. Сшивочные гликаны (cross-linking glycans) Ксилоглюканы (XyGs) Гликаны со смешанной связью (злаки) Глюкуроно-арабиноксиланы (GAXs) Фуко-XyGs XXXG :
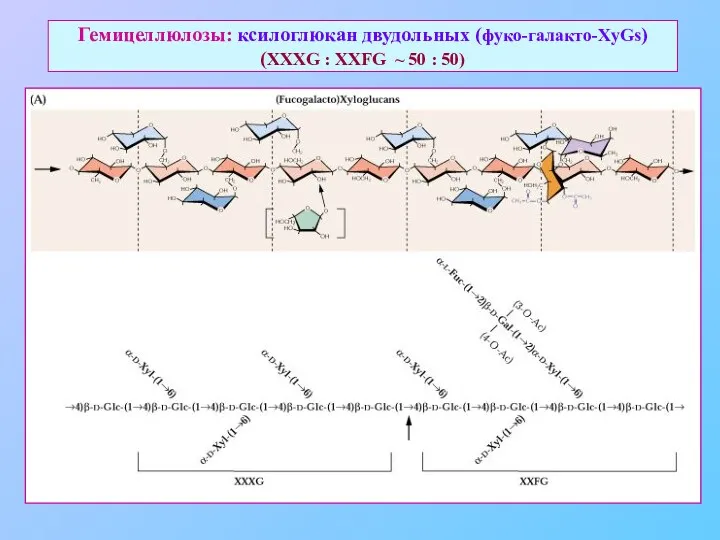
- 16. Гемицеллюлозы: ксилоглюкан двудольных (фуко-галакто-XyGs) (XXXG : XXFG ~ 50 : 50)
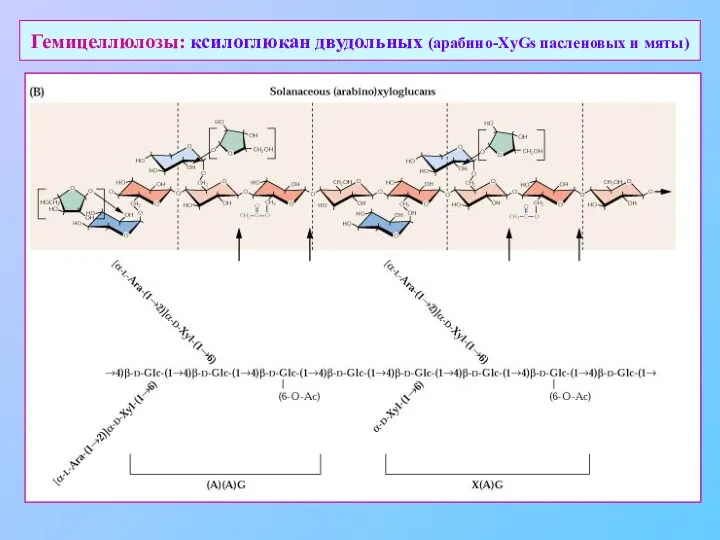
- 17. Гемицеллюлозы: ксилоглюкан двудольных (арабино-XyGs пасленовых и мяты)
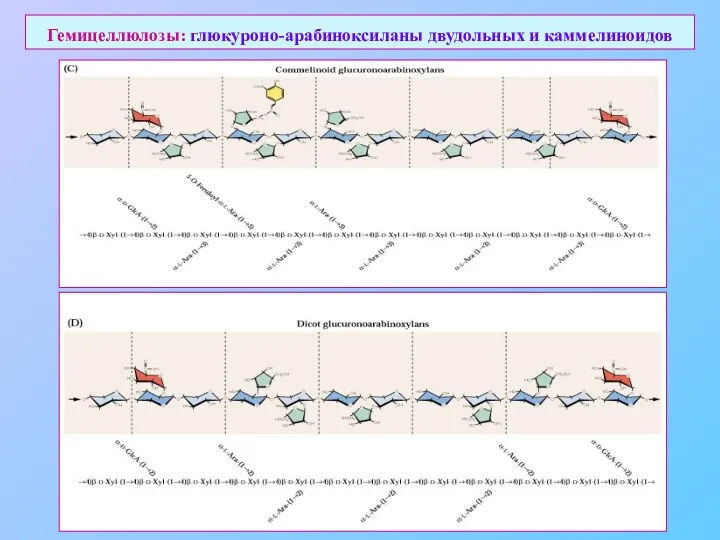
- 18. Гемицеллюлозы: глюкуроно-арабиноксиланы двудольных и каммелиноидов
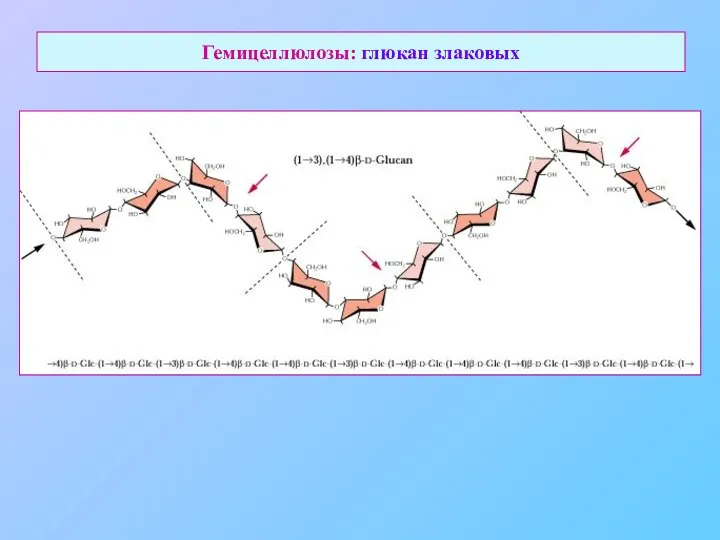
- 19. Гемицеллюлозы: глюкан злаковых
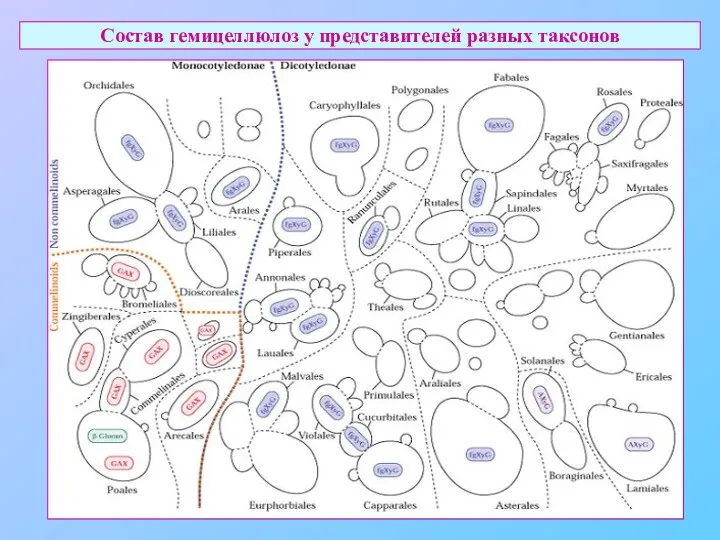
- 20. Состав гемицеллюлоз у представителей разных таксонов
- 21. Пектины Галактуронаны Рамногалактуронаны Гомогалактуронаны Ксилогалактуронаны Рамногалактуронаны II Рамногалактуронаны I
- 22. Пектины: галактоктуронаны (гомо- и ксило-галактуронаны)
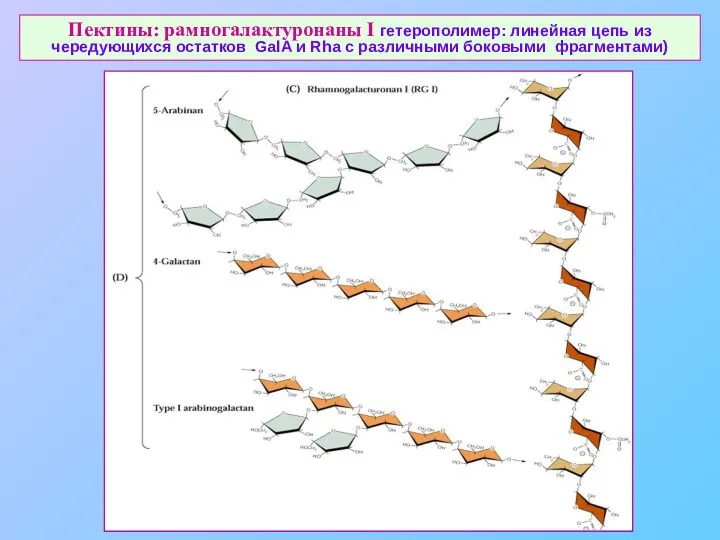
- 23. Пектины: рамногалактуронаны I гетерополимер: линейная цепь из чередующихся остатков GalA и Rha с различными боковыми фрагментами)
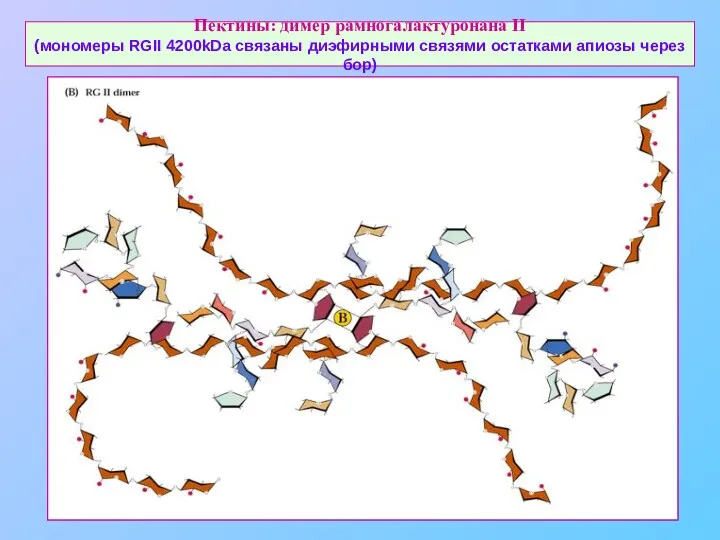
- 24. Пектины: димер рамногалактуронана II (мономеры RGII 4200kDa связаны диэфирными связями остатками апиозы через бор)
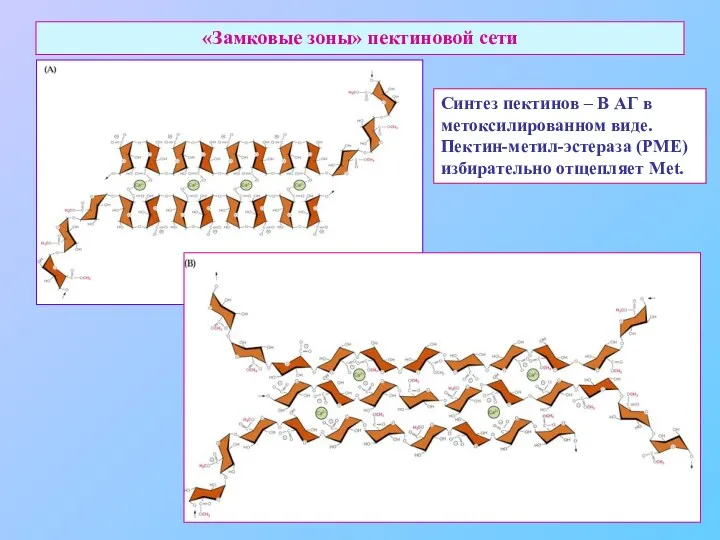
- 25. «Замковые зоны» пектиновой сети Синтез пектинов – В АГ в метоксилированном виде. Пектин-метил-эстераза (PME) избирательно отщепляет
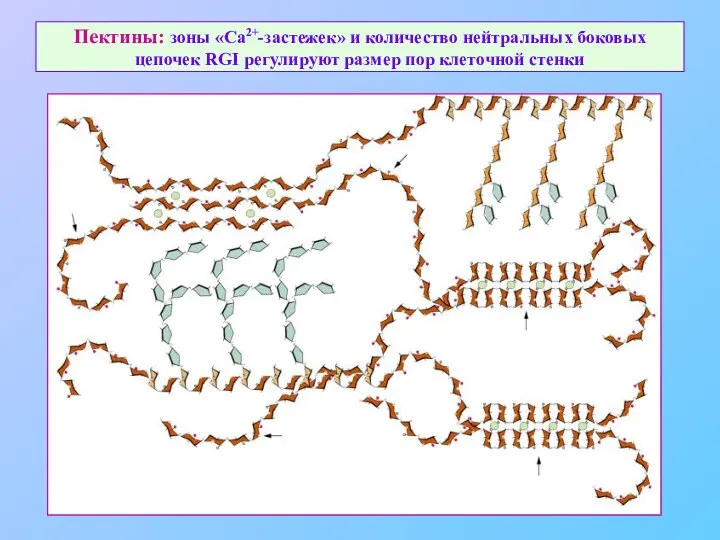
- 26. Пектины: зоны «Ca2+-застежек» и количество нейтральных боковых цепочек RGI регулируют размер пор клеточной стенки
- 27. Пектины: функциональная сеть клеточной стенки Функции пектинов: определяют размер пор КС определяют поверхностный заряд КС адгезионные
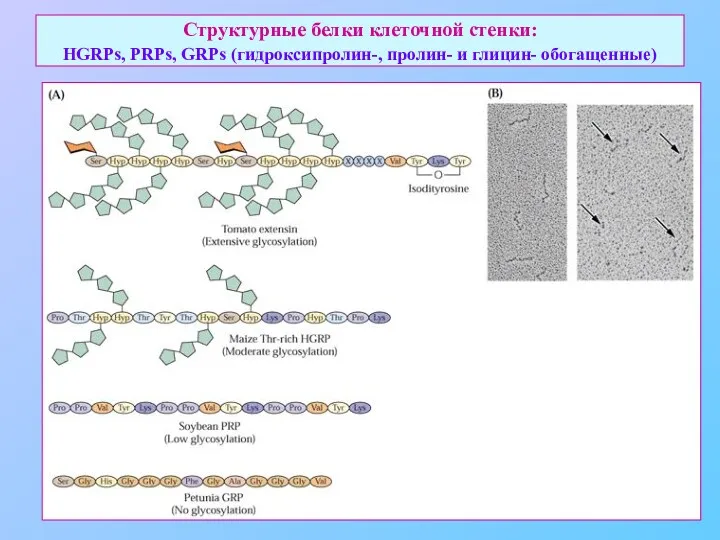
- 28. Структурные белки клеточной стенки: HGRPs, PRPs, GRPs (гидроксипролин-, пролин- и глицин- обогащенные)
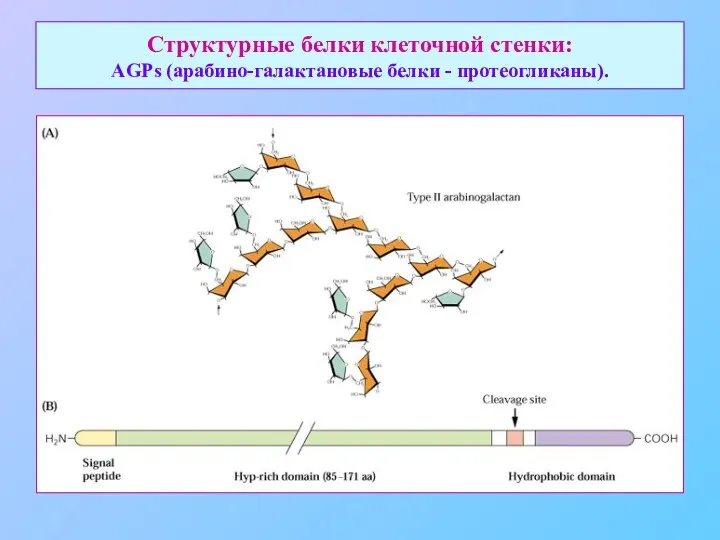
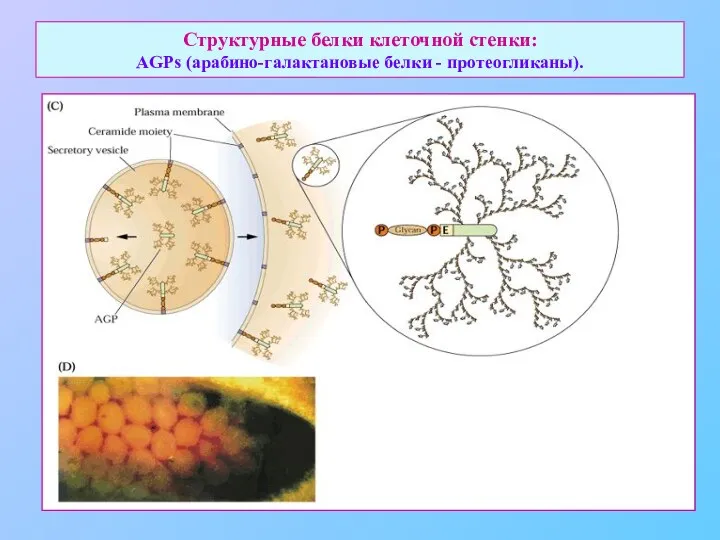
- 29. Структурные белки клеточной стенки: AGPs (арабино-галактановые белки - протеогликаны).
- 30. Структурные белки клеточной стенки: AGPs (арабино-галактановые белки - протеогликаны).
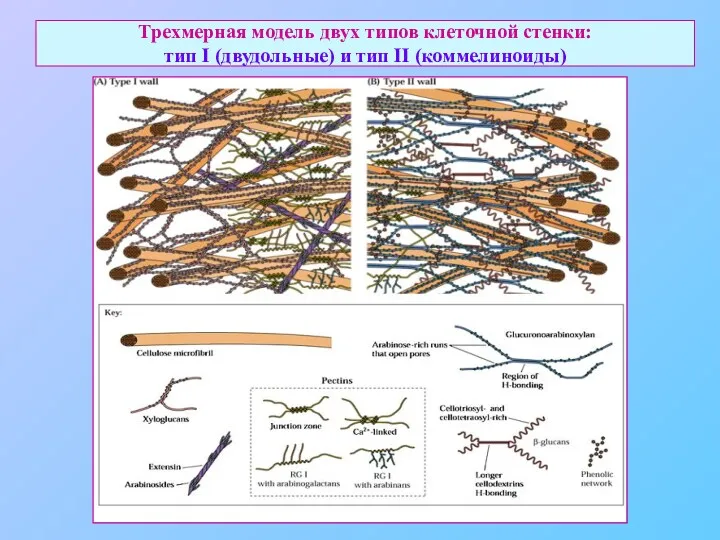
- 31. Трехмерная модель двух типов клеточной стенки: тип I (двудольные) и тип II (коммелиноиды)
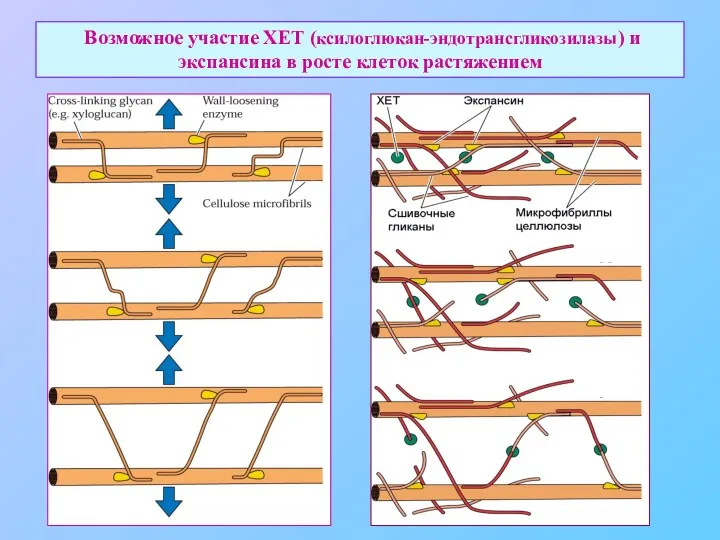
- 32. Возможное участие ХЕТ (ксилоглюкан-эндотрансгликозилазы) и экспансина в росте клеток растяжением
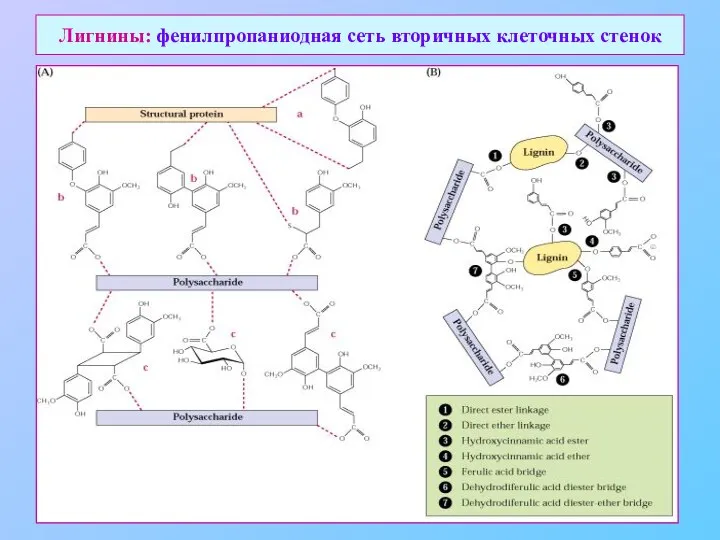
- 33. Лигнины: фенилпропаниодная сеть вторичных клеточных стенок
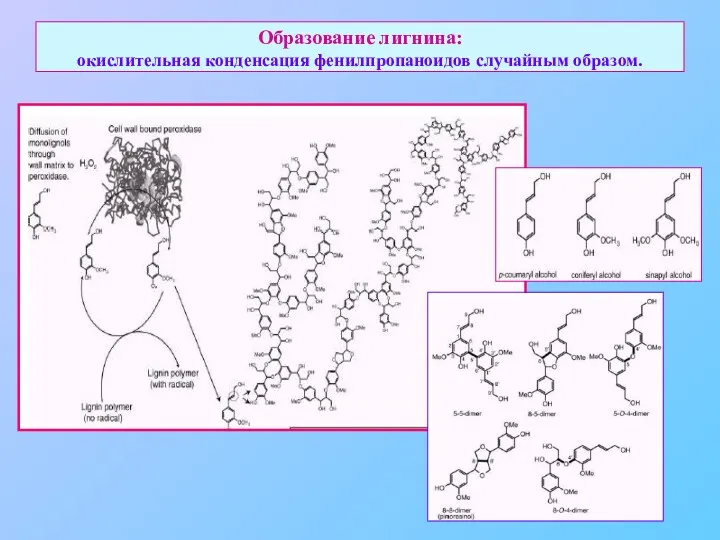
- 34. Образование лигнина: окислительная конденсация фенилпропаноидов случайным образом.
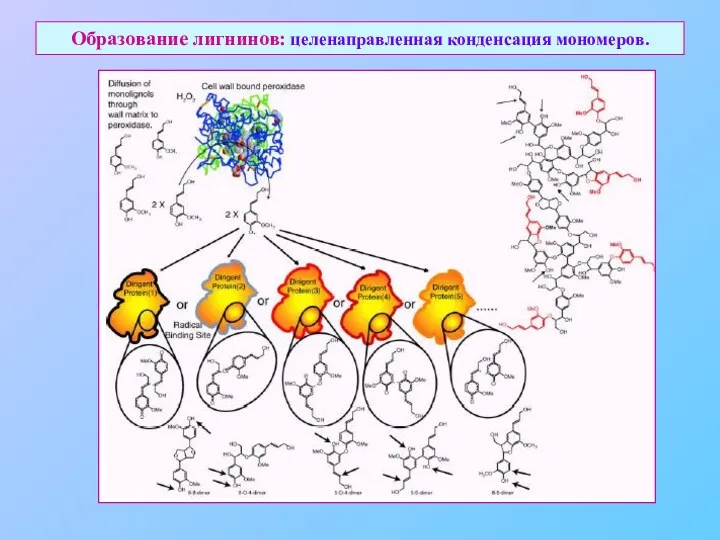
- 35. Образование лигнинов: целенаправленная конденсация мономеров.
- 36. Некоторые особенности плазмалеммы Структурные: зависимость состава от типа клетки основные ЖК: пальмитиновая (16:0), олеиновая (18:1, ∆9),
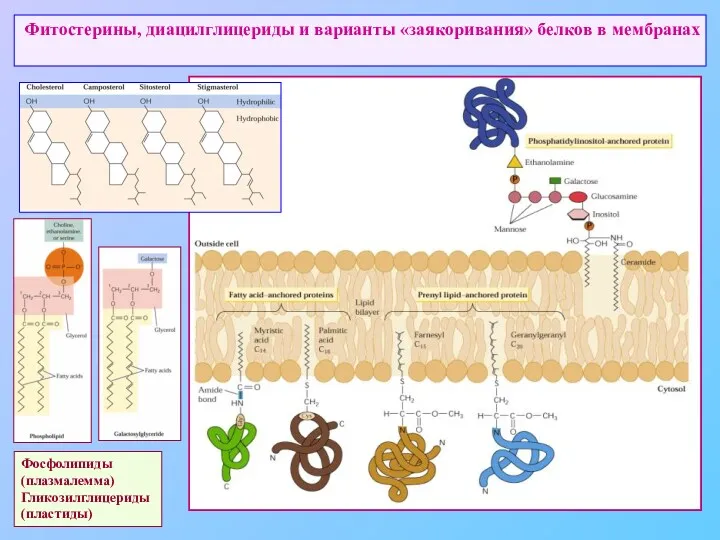
- 37. Фитостерины, диацилглицериды и варианты «заякоривания» белков в мембранах Фосфолипиды (плазмалемма) Гликозилглицериды (пластиды)
- 38. Функции плазмалеммы Контроль поглощения и секреции веществ Запасание и использование энергии. Размещение и обеспечение работы ферментов.
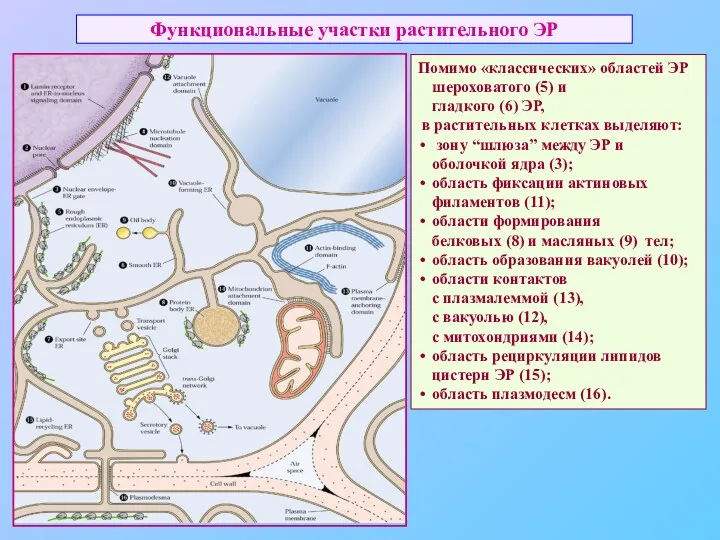
- 39. Функциональные участки растительного ЭР Помимо «классических» областей ЭР шероховатого (5) и гладкого (6) ЭР, в растительных
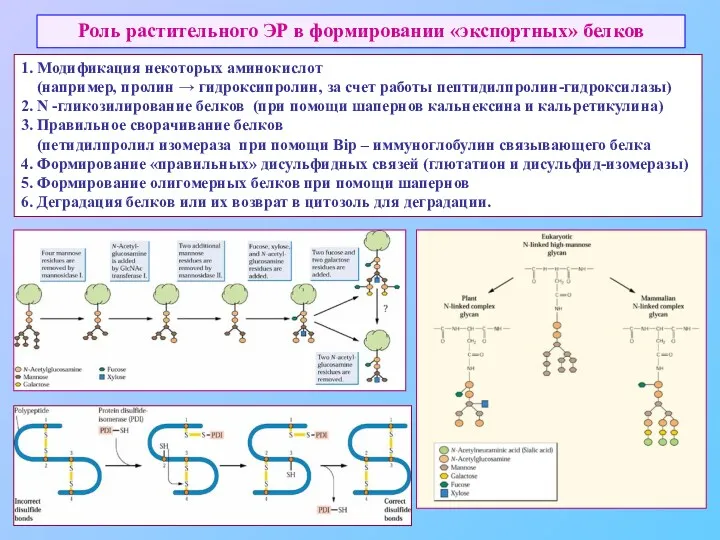
- 40. Роль растительного ЭР в формировании «экспортных» белков 1. Модификация некоторых аминокислот (например, пролин → гидроксипролин, за
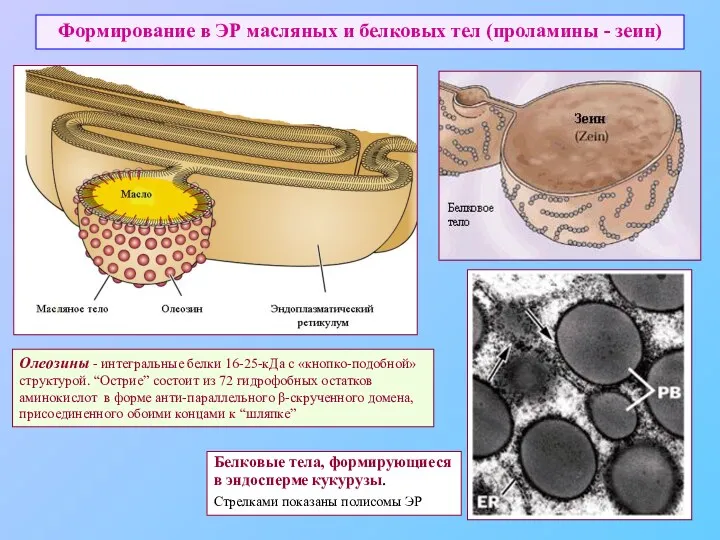
- 41. Формирование в ЭР масляных и белковых тел (проламины - зеин) Белковые тела, формирующиеся в эндосперме кукурузы.
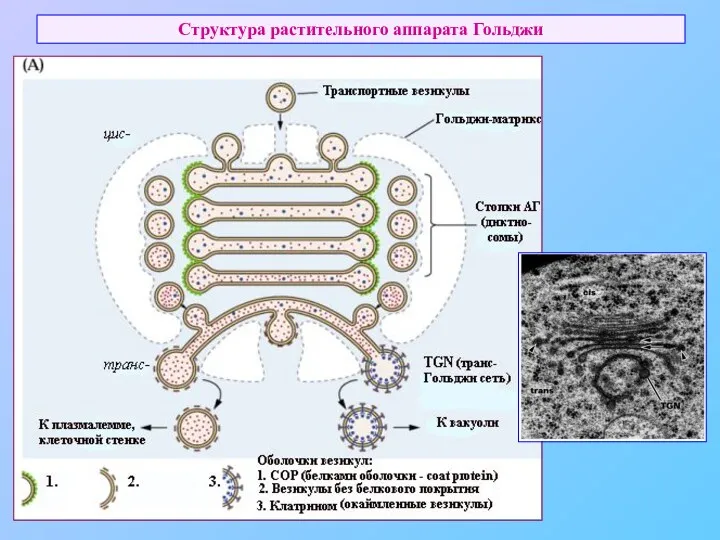
- 42. Структура растительного аппарата Гольджи
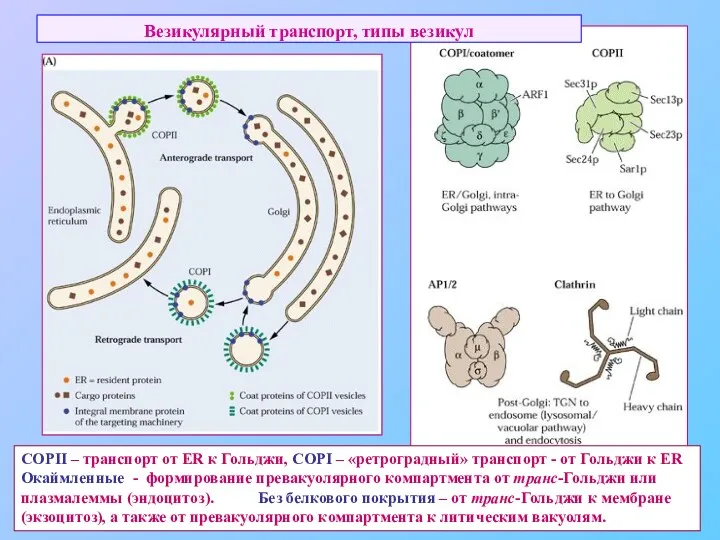
- 43. Везикулярный транспорт, типы везикул COPII – транспорт от ER к Гольджи, COPI – «ретроградный» транспорт -
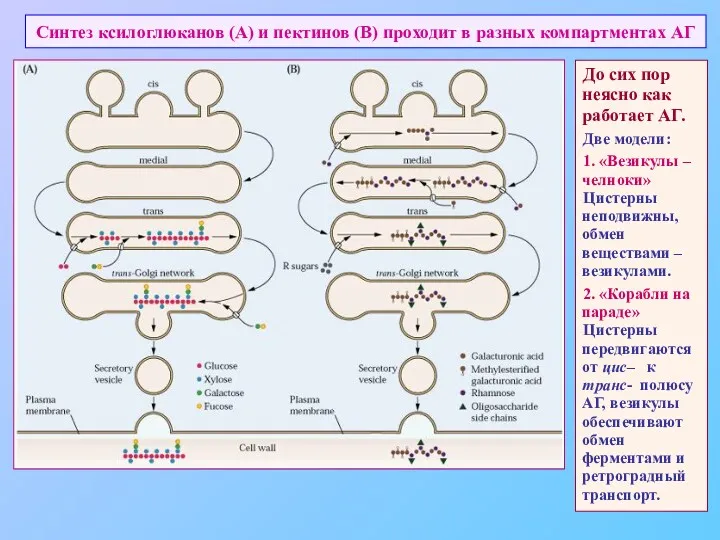
- 44. Синтез ксилоглюканов (А) и пектинов (В) проходит в разных компартментах АГ До сих пор неясно как
- 45. Вакуоли – мультифункциональные органеллы 1. Цель «создания» вакуолей - «дешевый» способ увеличения клетки? 2. В клетке
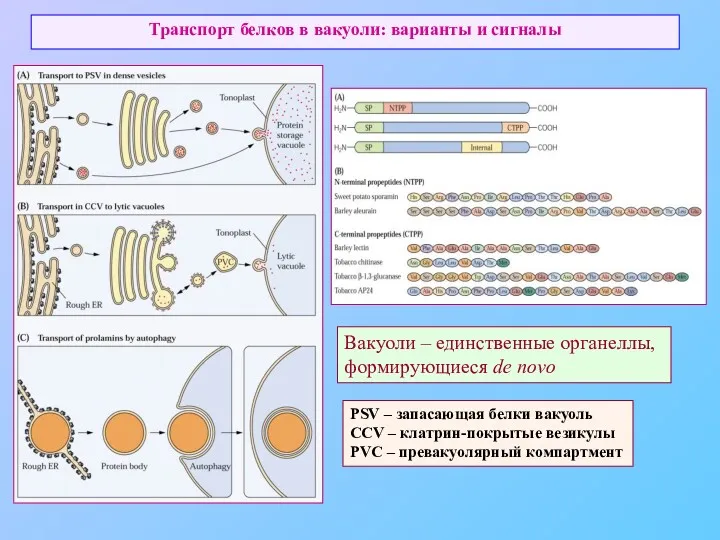
- 46. Транспорт белков в вакуоли: варианты и сигналы PSV – запасающая белки вакуоль CCV – клатрин-покрытые везикулы
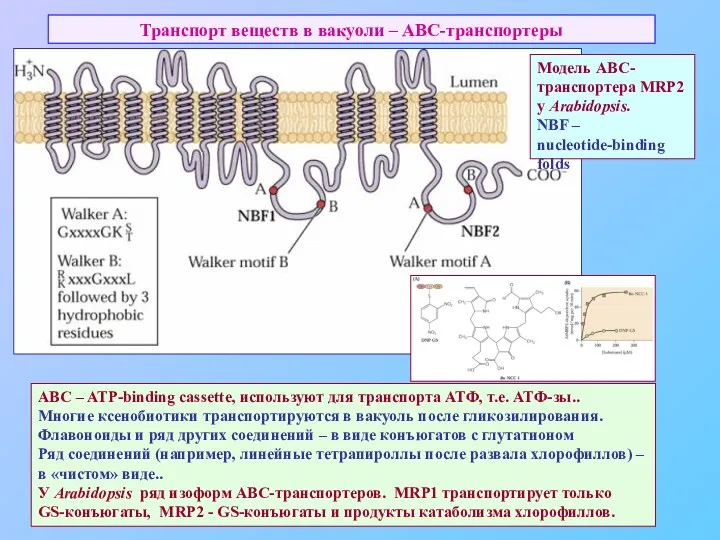
- 47. Транспорт веществ в вакуоли – АВС-транспортеры ABC – ATP-binding cassette, используют для транспорта АТФ, т.е. АТФ-зы..
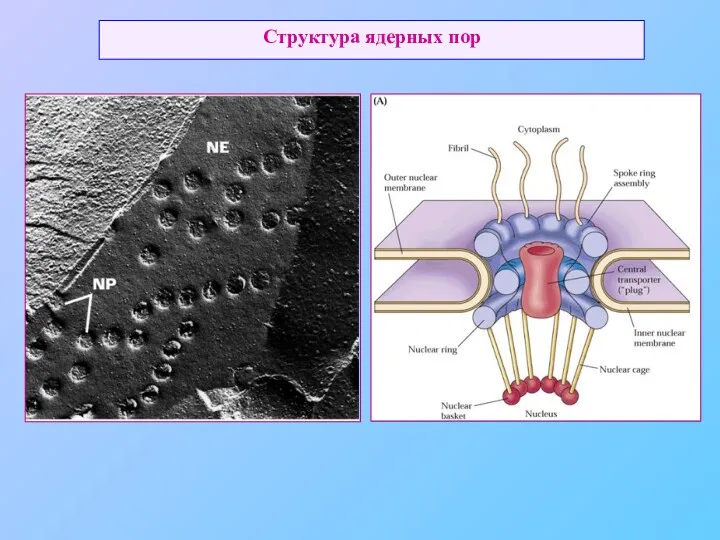
- 48. Структура ядерных пор
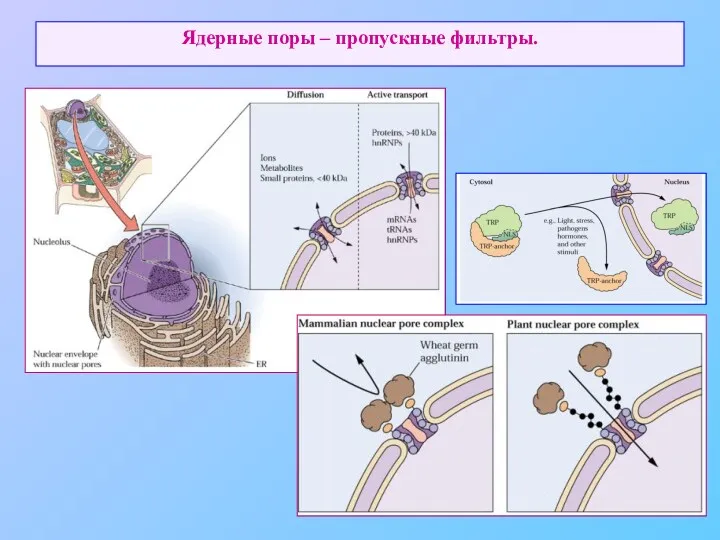
- 49. Ядерные поры – пропускные фильтры.
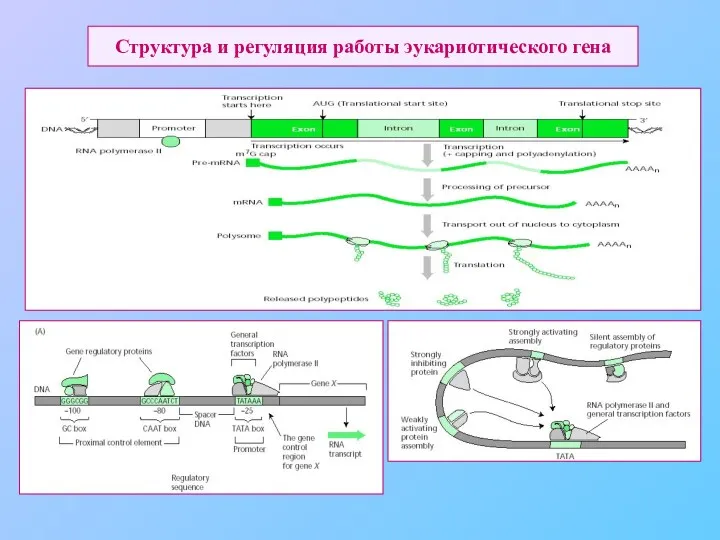
- 50. Структура и регуляция работы эукариотического гена
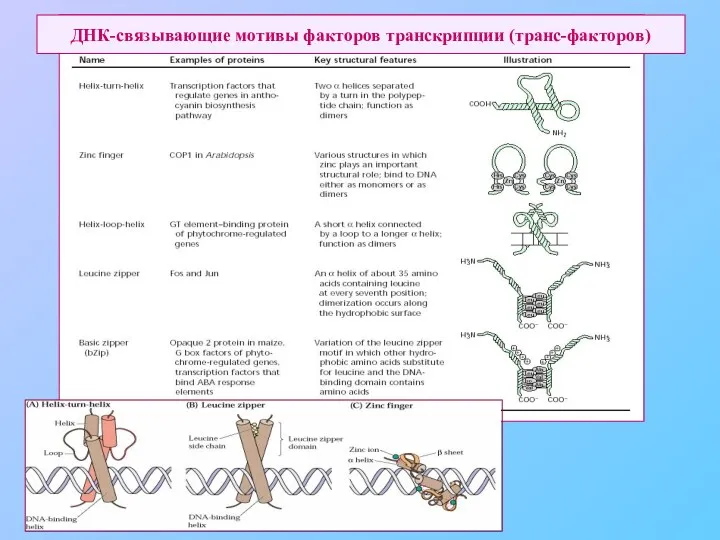
- 51. ДНК-связывающие мотивы факторов транскрипции (транс-факторов)
- 52. Факторы транскрипции растений (транс-факторы). bZip (basic leucin zipper) – «лейциновая молния» (застежка). у растений узнают участок
- 53. Некоторые особенности ядерного генома растений Размер: от ~108 тпн (Arabidopsis) до 1010 (бобы) – 1011 (Fritillaria)
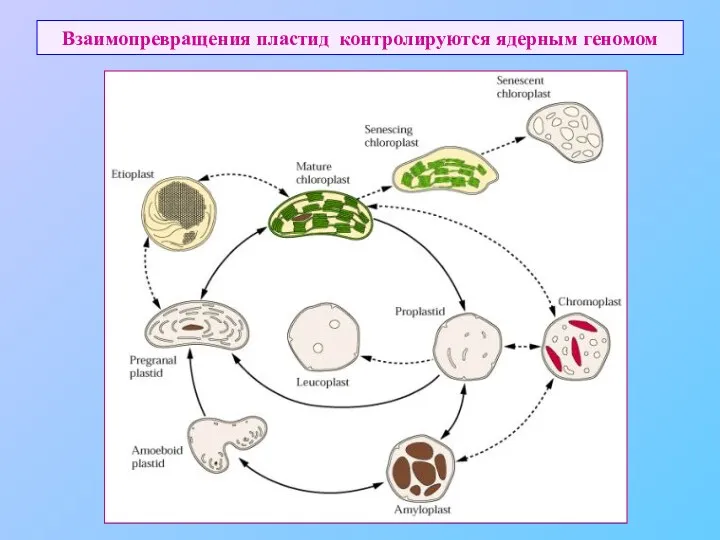
- 54. Взаимопревращения пластид контролируются ядерным геномом
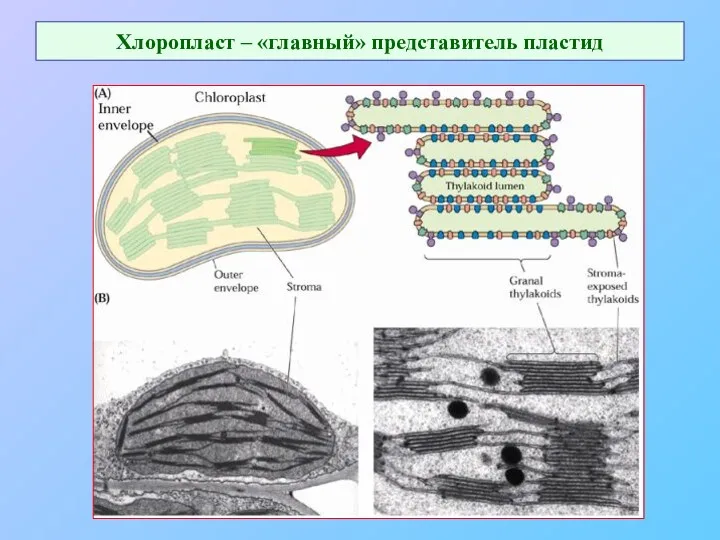
- 55. Хлоропласт – «главный» представитель пластид
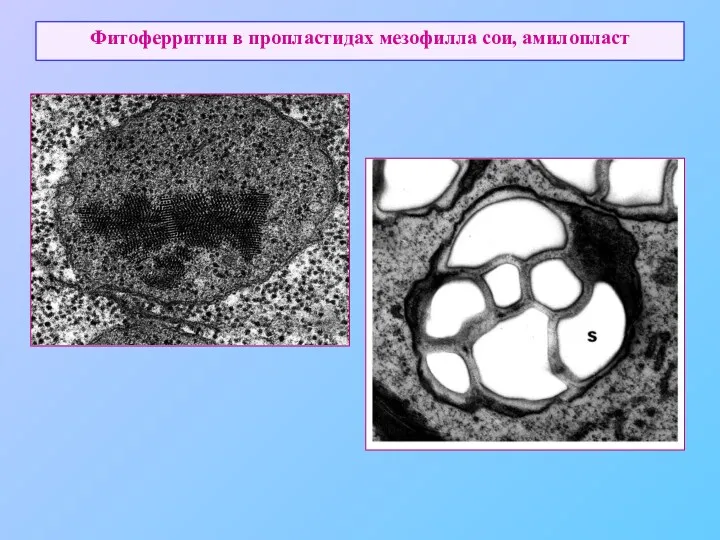
- 56. Фитоферритин в пропластидах мезофилла сои, амилопласт
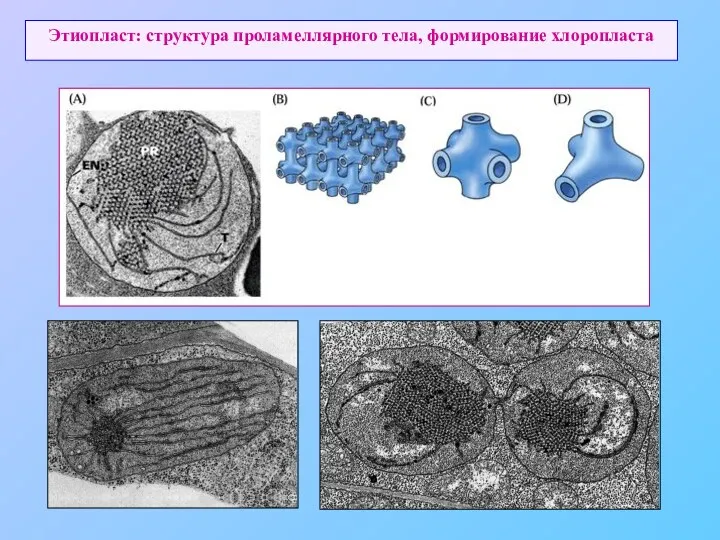
- 57. Этиопласт: структура проламеллярного тела, формирование хлоропласта
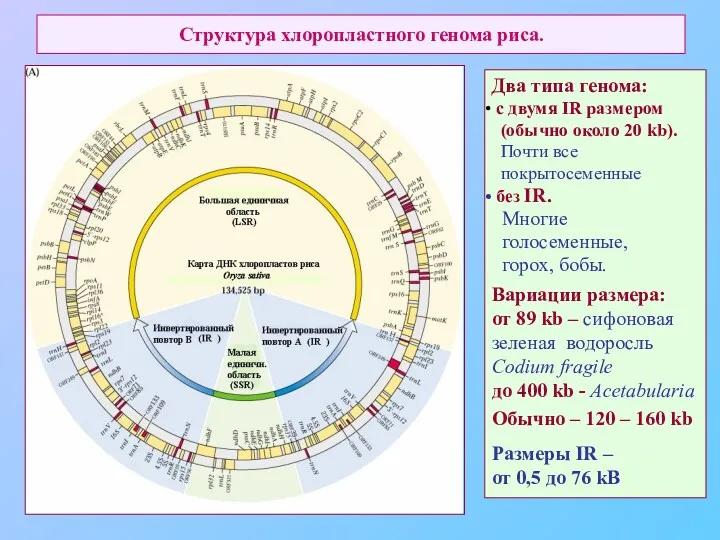
- 58. Структура хлоропластного генома риса. Два типа генома: c двумя IR размером (обычно около 20 kb). Почти
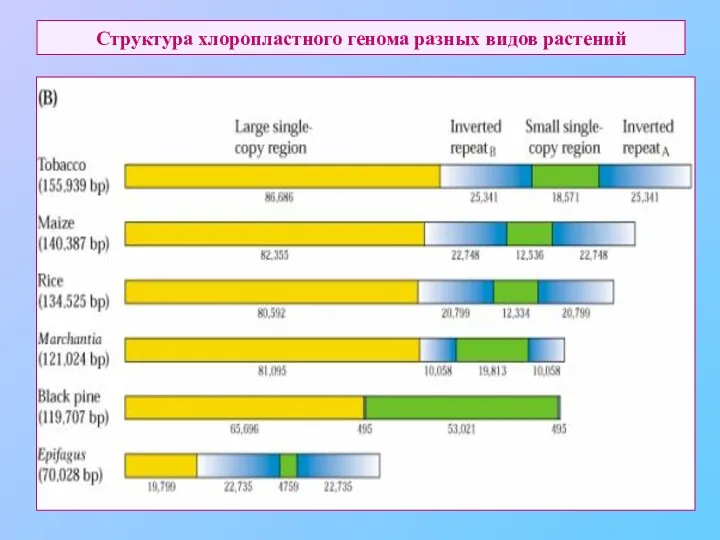
- 59. Структура хлоропластного генома разных видов растений
- 60. Сходства и отличия хлоропластного генома и белоксинтезирующей системы от бактериальных Сходства: Кольцевая ДНК Содержание G/С аналогично
- 61. Гены хлоропластов Транскрипция. 4 гена субъединиц пластидной РНК-полимеразы (rpo) Синтез белка. - 4 гена рРНК (оперон
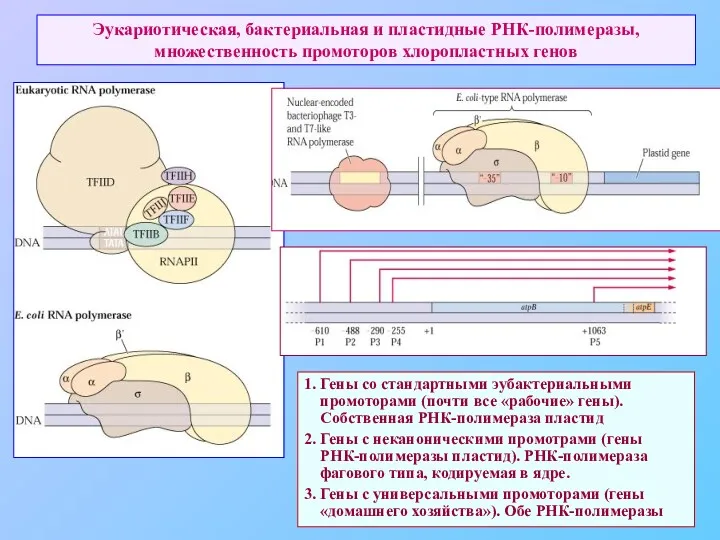
- 62. Эукариотическая, бактериальная и пластидные РНК-полимеразы, множественность промоторов хлоропластных генов 1. Гены со стандартными эубактериальными промоторами (почти
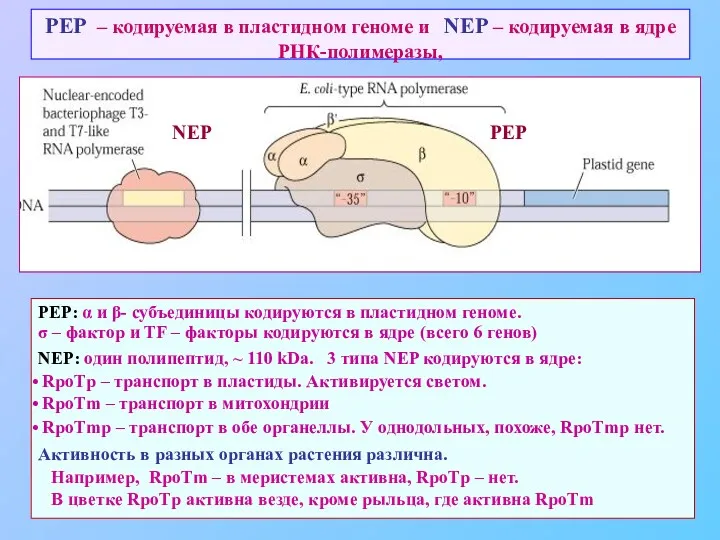
- 63. PEP – кодируемая в пластидном геноме и NEP – кодируемая в ядре РНК-полимеразы, PEP: α и
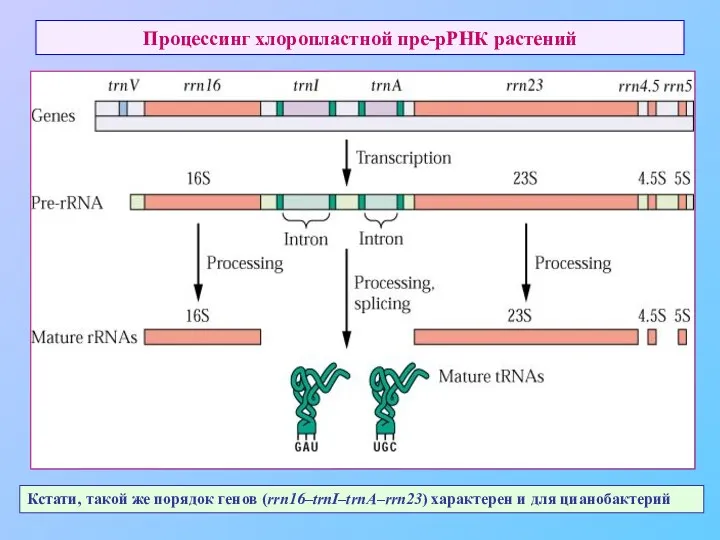
- 64. Процессинг хлоропластной пре-рРНК растений Кстати, такой же порядок генов (rrn16–trnI–trnA–rrn23) характерен и для цианобактерий
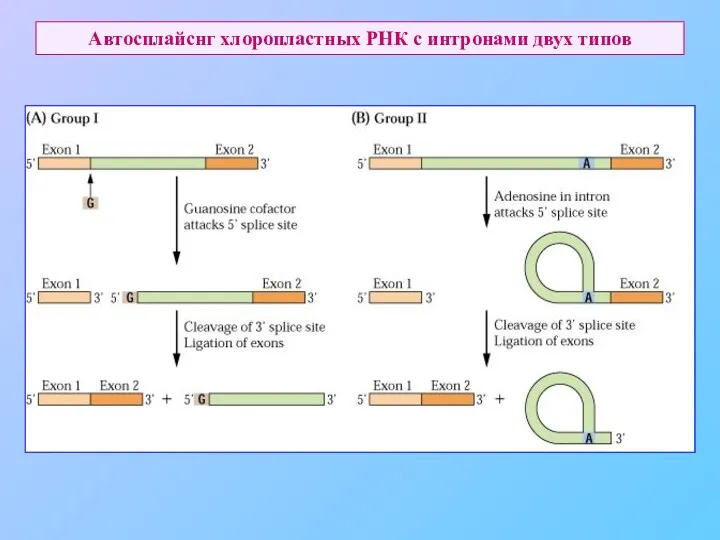
- 65. Автосплайснг хлоропластных РНК с интронами двух типов
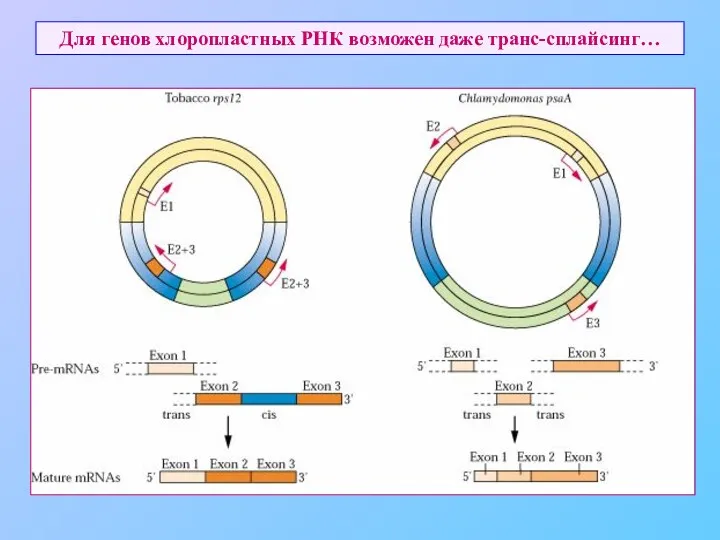
- 66. Для генов хлоропластных РНК возможен даже транс-сплайсинг…
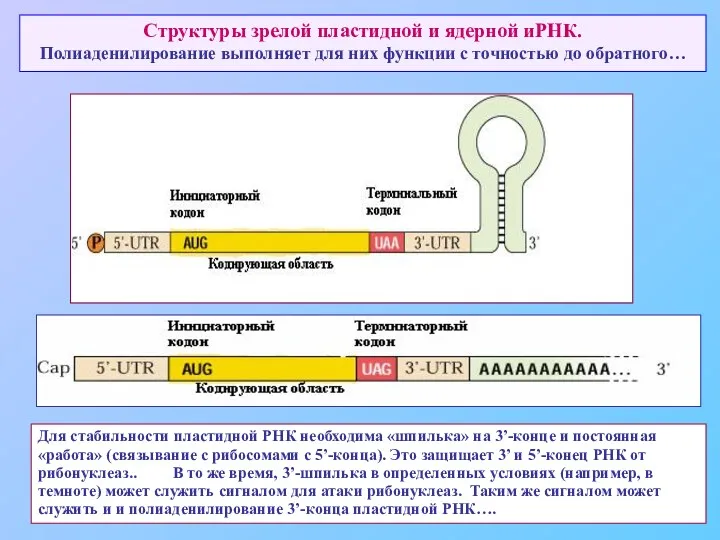
- 67. Структуры зрелой пластидной и ядерной иРНК. Полиаденилирование выполняет для них функции с точностью до обратного… Для
- 68. Функции пластид Фотосинтез – NB Синтез: все жирные кислоты, многие аминокислоты, синтез пуринов и пиримидинов, альтернативный
- 69. Растительные митохондрии имеют разнообразный размер и форму
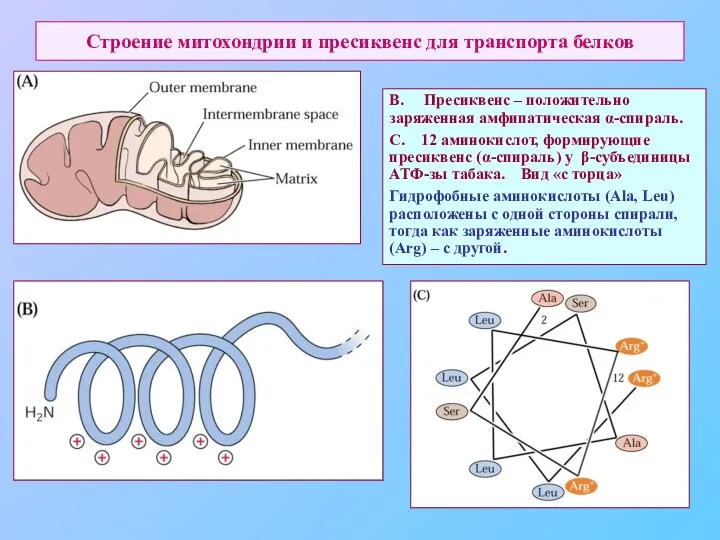
- 70. Строение митохондрии и пресиквенс для транспорта белков В. Пресиквенс – положительно заряженная амфипатическая α-спираль. С. 12
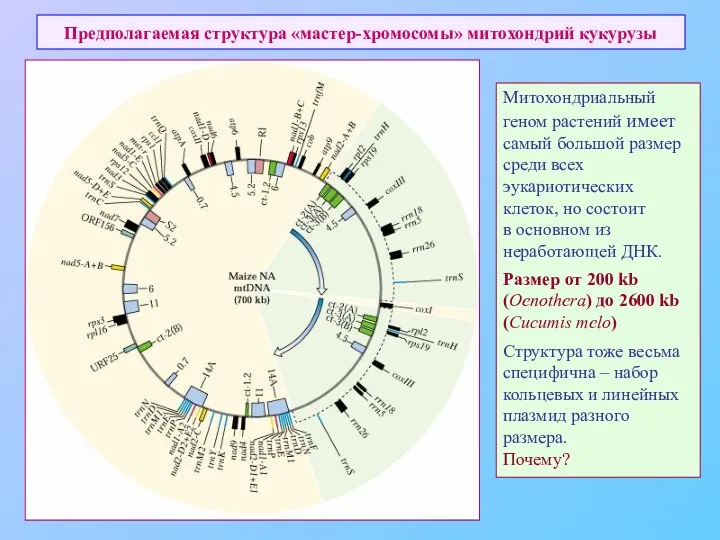
- 71. Предполагаемая структура «мастер-хромосомы» митохондрий кукурузы Митохондриальный геном растений имеет самый большой размер среди всех эукариотических клеток,
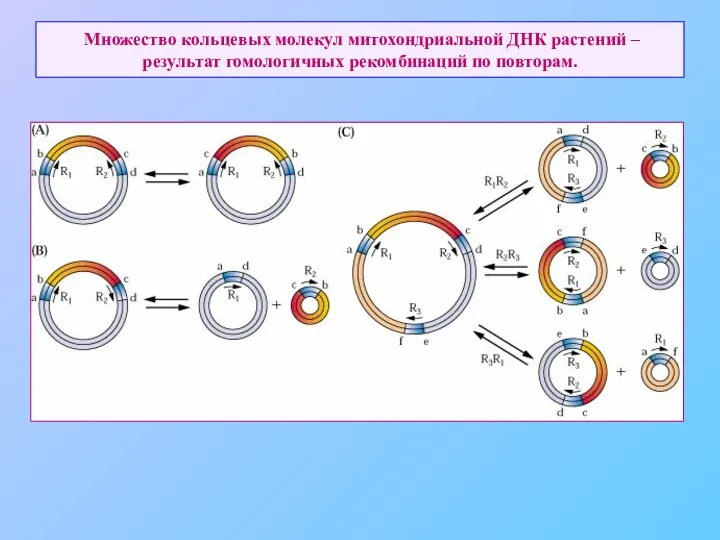
- 72. Множество кольцевых молекул митохондриальной ДНК растений – результат гомологичных рекомбинаций по повторам.
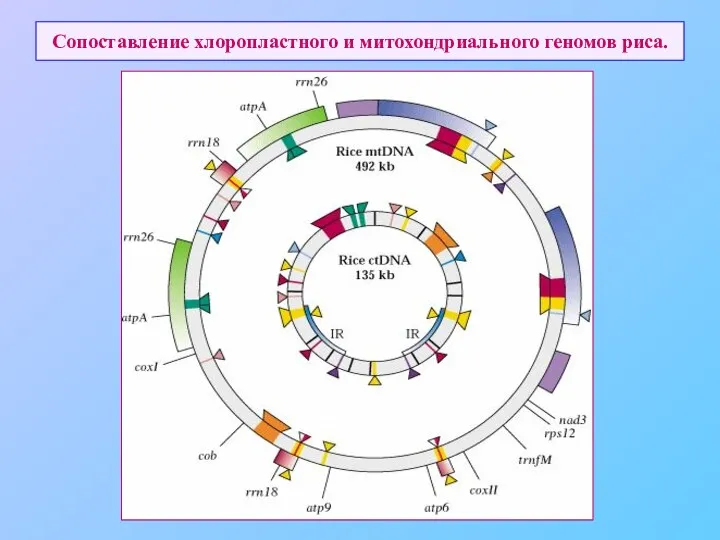
- 73. Сопоставление хлоропластного и митохондриального геномов риса.
- 74. Гены митохондрий Синтез белка. - 3 гена рРНК (оперон rrn) - 10 генов белков пластидных рибосом
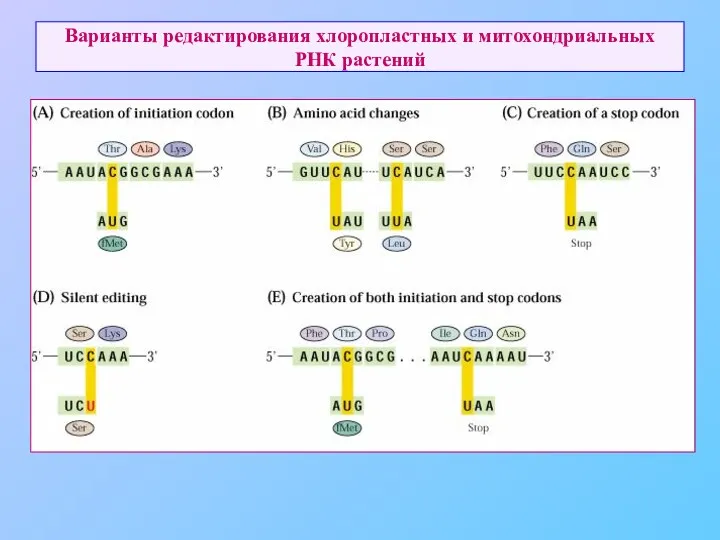
- 75. Варианты редактирования хлоропластных и митохондриальных РНК растений
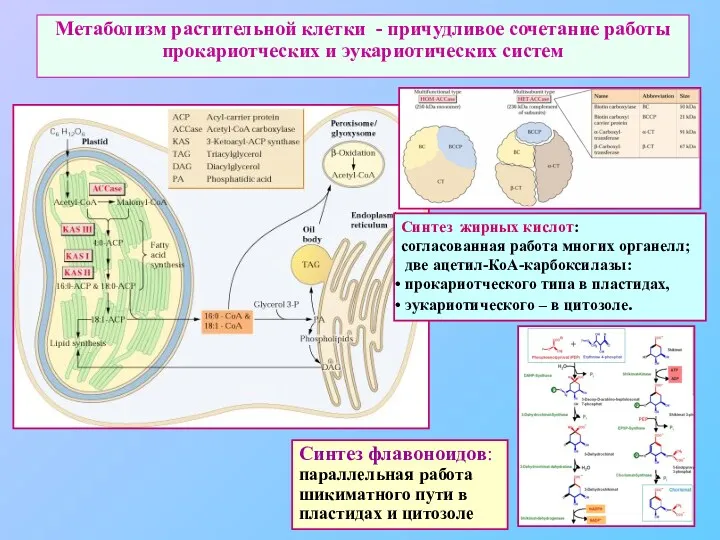
- 76. Метаболизм растительной клетки - причудливое сочетание работы прокариотческих и эукариотических систем Синтез жирных кислот: согласованная работа
- 78. Скачать презентацию














 Основные компоненты клетки
Основные компоненты клетки Предмет и задачи зоопсихологии и сравнительной психологии
Предмет и задачи зоопсихологии и сравнительной психологии Безпека харчування в умовах воєнного стану
Безпека харчування в умовах воєнного стану Атлас млекопитающих Москвы и Подмосковья
Атлас млекопитающих Москвы и Подмосковья Методы изучения генетики человека
Методы изучения генетики человека Грибы, сбор и заготовка
Грибы, сбор и заготовка Пищевая и биологическая ценность мяса. Санитарно-эпидемиологическое значение мяса
Пищевая и биологическая ценность мяса. Санитарно-эпидемиологическое значение мяса Только ли лист кормит растение? 5 класс
Только ли лист кормит растение? 5 класс Ягоды. Кроссворд
Ягоды. Кроссворд Розмноження рослин різними способами
Розмноження рослин різними способами Слава воде. Организм человека и вода
Слава воде. Организм человека и вода Тұқымқуалаушылық және өзгергіштік заңдылықтары
Тұқымқуалаушылық және өзгергіштік заңдылықтары Покрытосеменные или цветковые растения. 6 класс
Покрытосеменные или цветковые растения. 6 класс Среды обитания. 5 класс
Среды обитания. 5 класс Комнатные растения
Комнатные растения Жүйке жүйесі
Жүйке жүйесі Парнокопытные и непарнокопытные животные
Парнокопытные и непарнокопытные животные Царство грибы
Царство грибы Что изучает биология
Что изучает биология Питательные вещества и их превращение в организме
Питательные вещества и их превращение в организме Почему листья жёлтые? 7 класс
Почему листья жёлтые? 7 класс Разнообразие организмов и их классификация
Разнообразие организмов и их классификация Характеристика белков как биополимеров.
Характеристика белков как биополимеров. Внешнее строение листа. 6 класс
Внешнее строение листа. 6 класс Функции печени
Функции печени Проблемы хищных птиц сельхозландшафтов северной Белоруссии
Проблемы хищных птиц сельхозландшафтов северной Белоруссии Высшая нервная деятельность
Высшая нервная деятельность Интенсивная технология производства однолетних и многолетних трав
Интенсивная технология производства однолетних и многолетних трав