Содержание
- 2. Цели и задачи биохимии Биохимия – дословно «химия жизни» Цель: изучение химических ( т.е. молекулярных) основ
- 3. Применение знаний биохимии в медицине: 1. Решение проблем сохранения здоровья, в том числе проблем рационального питания;
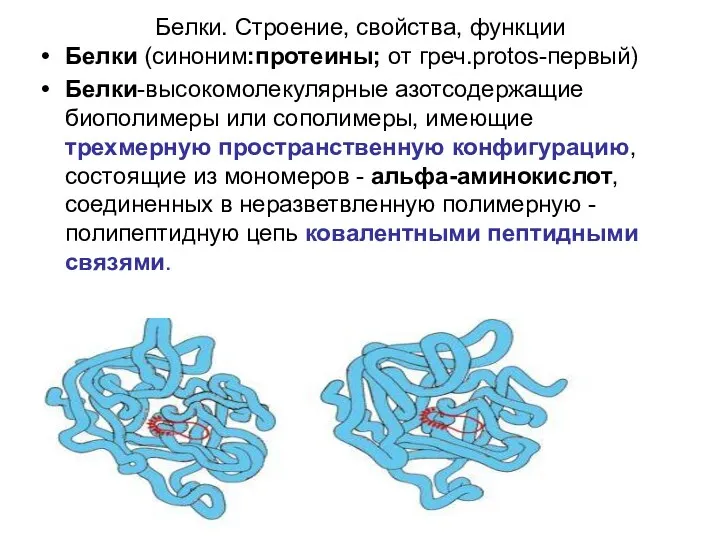
- 4. Белки. Строение, свойства, функции Белки (синоним:протеины; от греч.protos-первый) Белки-высокомолекулярные азотсодержащие биополимеры или сополимеры, имеющие трехмерную пространственную
- 5. 1. Белки. Функции. В организме человека содержится свыше 50000 индивидуальных белков, выполняющих жизненноважные функции. Функции: Специфические
- 6. Белки. Химический состав. Мономер природного белка – альфа- аминокислоты. В составе белков человека – 20 протеиногенных
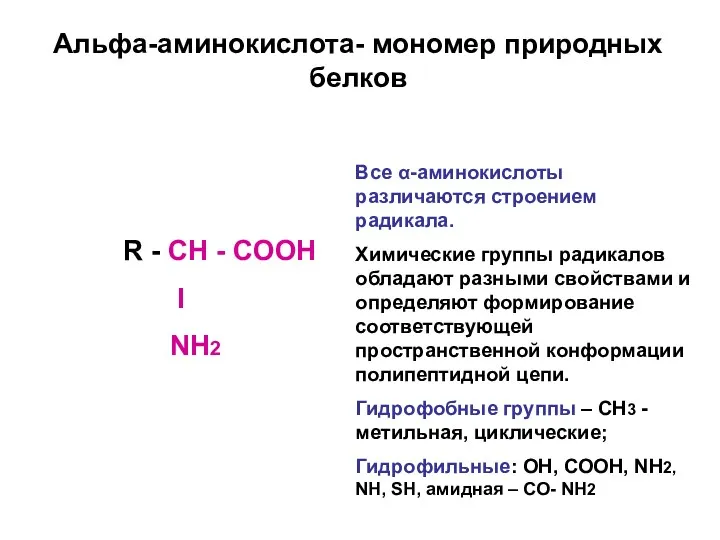
- 7. Альфа-аминокислота- мономер природных белков R - CН - СООН I NН2 Все α-аминокислоты различаются строением радикала.
- 8. Пространственная структура (конформация) Все индивидуальные белки отличаются первичной структурой, конформацией, строением активного центра и функциями. Молекулы
- 9. Пространственная структура (продолжение) Четвертичная (олигомерные белки) - ассоциация нескольких (четное кол-во) протомеров с третичным уровнем (нековалентные
- 10. Структура белка. Домены Для высокомолекулярных белков в структуре характерно наличие доменов. Домены- это участки полипептидной цепи,
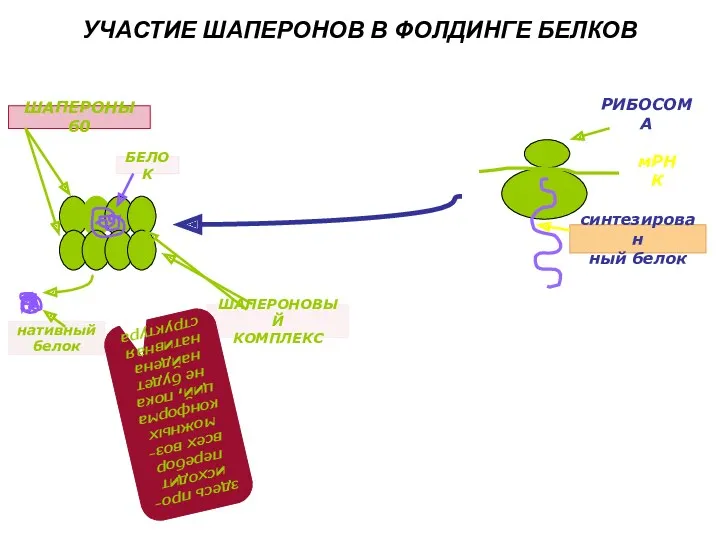
- 11. Шапероны. Фолдинг Фолдинг – процесс формирования трехмерной структуры при участии белков шаперонов Шапероны (shaperon - с
- 12. УЧАСТИЕ ШАПЕРОНОВ В ФОЛДИНГЕ БЕЛКОВ РИБОСОМА мРНК синтезирован ный белок ШАПЕРОНЫ 60 БЕЛОК ШАПЕРОНОВЫЙ КОМПЛЕКС нативный
- 13. Центр связывания (активный центр). Взаимодействие белка с лигандами Для осуществления своих функции – напр.каталитической, транспортной, рецепторной,
- 14. Физико-химические свойства белков. Высокая молекулярная масса – варьирует в широких пределах, т.к. варьирует кол-во в молекуле
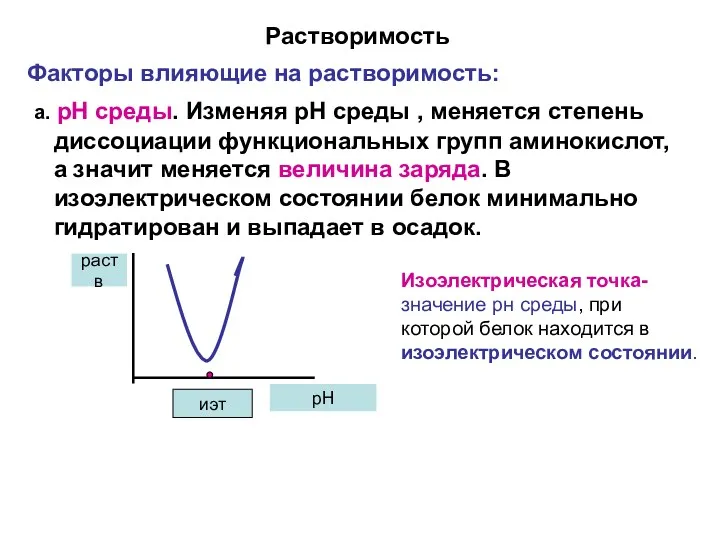
- 15. Растворимость Факторы влияющие на растворимость: а. рН среды. Изменяя рН среды , меняется степень диссоциации функциональных
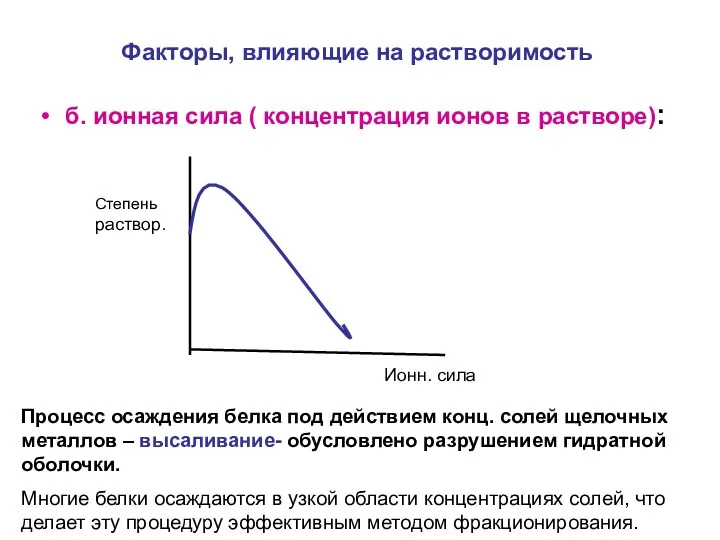
- 16. Факторы, влияющие на растворимость б. ионная сила ( концентрация ионов в растворе): Степень раствор. Ионн. сила
- 17. Классификация. Существуют классификации по молекулярной массе, по выполняемым функциям, по локализации в клетке, по локализации в
- 18. Классификация (продолжение) Принцип классификации: Наличие простетической ( небелковой группы): простые белки – состоят только из альфа
- 19. Простые белки На основании условно выработанных критериев – м. м; ам.состав, растворимость, условиях осаждения – простые
- 20. Простые белки ( продолжение) Проламины и глютелины – растительные белки. Особенность – не растворяются в воде.
- 21. Сложные белки (протеиды) Сложные белки в зависимости от химической природы небелкового компонента делят на следующие классы
- 22. Сложные белки (продолжение) Нуклеопротеиды. Небелковый компонент – ДНК, РНК. Связь между положительно заряженными аминокислотных остатков аргинина
- 24. Скачать презентацию
















 Класс Двудольные, семейство Пасленовые
Класс Двудольные, семейство Пасленовые Сравнительная характеристика клеток растений, животных и грибов. 10 класс
Сравнительная характеристика клеток растений, животных и грибов. 10 класс Транскрипция. Регуляция транскрипции
Транскрипция. Регуляция транскрипции Вегетативне розмноження рослин
Вегетативне розмноження рослин Образование и формирование условных рефлексов
Образование и формирование условных рефлексов Геоботаникаю лекция 2
Геоботаникаю лекция 2 Селекція тварин
Селекція тварин Функциональная анатомия костной системы
Функциональная анатомия костной системы Ткани растений и их виды
Ткани растений и их виды Сенсорные системы
Сенсорные системы Организм - единое целое
Организм - единое целое Как любят птицы
Как любят птицы Биологические основы клеточной сигнализации
Биологические основы клеточной сигнализации Haeckel-muller biogenetic law
Haeckel-muller biogenetic law Моё Приморье – мой край родной
Моё Приморье – мой край родной Птицы наземных и водных экосистем
Птицы наземных и водных экосистем Болезни хвои и листьев. (Лекция 10)
Болезни хвои и листьев. (Лекция 10) Клетка (цитология)
Клетка (цитология) Нервная ткань
Нервная ткань Ас қорыту жүйесіне
Ас қорыту жүйесіне Устройство бактериологической лаборатории
Устройство бактериологической лаборатории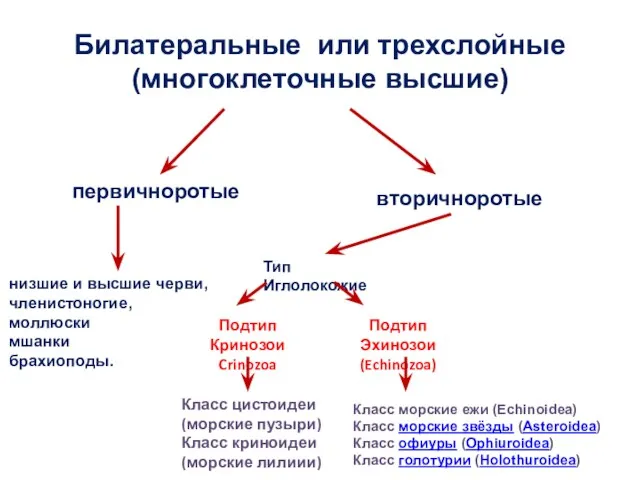 Билатеральные, или трехслойные (многоклеточные высшие)
Билатеральные, или трехслойные (многоклеточные высшие) Жизненный цикл клетки. Митотический цикл. Регуляция митотического цикла. Понятие об апоптозе
Жизненный цикл клетки. Митотический цикл. Регуляция митотического цикла. Понятие об апоптозе Цветочная поляна
Цветочная поляна 20. Біохімія мязів і сполучної тканини
20. Біохімія мязів і сполучної тканини Биоритмы. Сны и сновидения
Биоритмы. Сны и сновидения Імунна система людини, особливості її функціонування
Імунна система людини, особливості її функціонування Введение в методы анализа продуктов биотехнологии
Введение в методы анализа продуктов биотехнологии