Содержание
- 2. Белковый обмен координирует, регулирует и интегрирует процессы обмена веществ в организме. Общая скорость синтеза белков до
- 3. Гормональная регуляция белкового обмена Гормоны, влияющие на белковый обмен, делятся на две группы: Анаболические гормоны –
- 4. Анаболические гормоны СТГ (гормон роста) – повышает проницаемость клеточных мембран для аминокислот, активирует все этапы белкового
- 5. Половые гормоны: эстрогены - стимулируют все этапы синтеза белка в клетках – мишенях (органах репродукции); андрогены
- 6. Катаболические гормоны Тироксин - в больших дозах усиливает окислительные процессы, в том числе окисление аминокислот, усиливает
- 7. Глюкокортикоиды – ингибируют синтез белков мышечной, костной и лимфоидной тканей (иммунодепрессорное действие), т.к. активируют глюконеогенез из
- 8. Патология белкового обмена Врожденная - связана с генетическими дефектами синтеза белка. Известно около 2.000 наследственных болезней.
- 9. Врожденная патология белкового обмена Болезни белкового обмена –протеинопатии Нарушается синтез какого либо белка: ферментные неферментные Неферментные
- 10. Примеры Нарушение структуры белка: Гемоглобинозы – синтезируется Нв с аномальной структурой → анемия, метгемоглобинемия и др.
- 11. Выпадение синтеза белка: Агаммоглобулинемия – синдром дефицита антител. Неспособность сопротивляться инфекциям. Гемофилия А – отсутствие синтеза
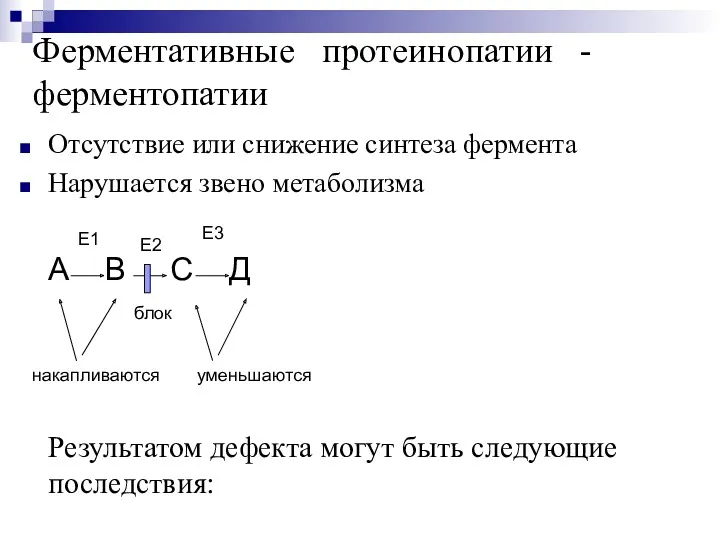
- 12. Ферментативные протеинопатии - ферментопатии Отсутствие или снижение синтеза фермента Нарушается звено метаболизма А В С Д
- 13. 1. Накапливающееся вещество оттесняет в клетке все органеллы, нарушается функция клетки. Болезни накопления - гликогенозы, липоидозы,
- 14. 3. Недостаток вещества после блока, необходимого для организма, возникает заболевание: Кретинизм - врожденный гипотиреоз, нарушен синтез
- 15. Приобретенная патология белкового обмена При заболевании почек нарушается синтез эритропоэтина (→ почечная анемия), кальцитриола (→ рахит).
- 16. Приобретенная патология белкового обмена При лучевых поражениях нарушен синтез иммуноглобулинов → резко снижается сопротивляемость к инфекциям.
- 17. Белковое голодание - недостаток полноценного белка или нехватка белков в питании. Уменьшается мышечная масса, сопротивляемость к
- 18. Белковое голодание тяжело протекает у детей: – болезнь Квашиоркор –«красный мальчик»: гидрокахексия, депигментация-отек (задержка роста, отеки
- 19. Нарушение переваривания и всасывания белков при инфекциях ЖКТ (холера, дизентерия), заболеваниях поджелудочной железы, гипо- и авитаминозах.
- 20. БИОСИНТЕЗ нуклеиновых кислот
- 21. Репликация ДНК Репликация (удвоение) – синтез дочерней молекулы ДНК на матрице материнской ДНК. Процесс идет в
- 22. Ферменты репликации Хеликаза (ДНК-раскручивающий белок) SSB-белок (стабилизация, препятствует обратному скручиванию) Топоизомеразы (релаксация сверхспирализации) ДНК-полимеразы (синтез, контроль,
- 23. инициация Образование репликативных вилок в различных участках ДНК Синтез праймеров – небольших кусочков РНК (10 –
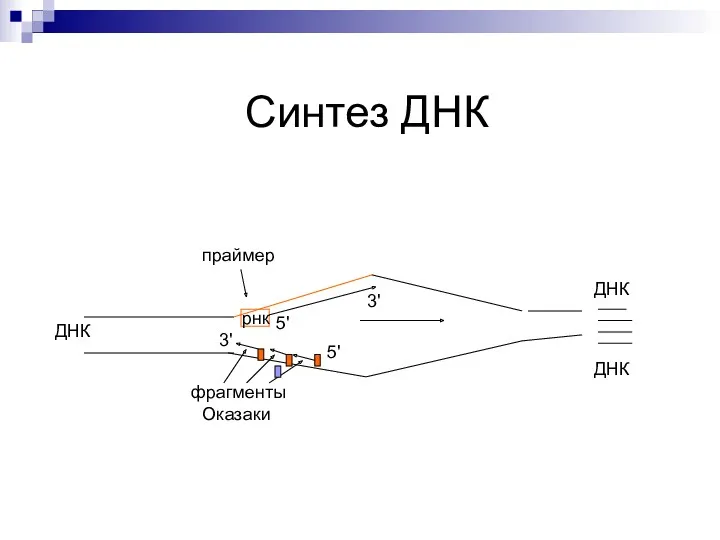
- 24. Синтез второй – отстающей цепи - прерывисто – фрагментами Оказаки (по 150 - 200 нуклеотидов) ДНК-полимераза
- 25. терминация Наступает, когда исчерпана ДНК матрица (ДНК-полимераза уходит с матрицы) Лидирующая цепь реплицируется полностью. Праймер у
- 26. Синтез ДНК ДНК праймер рнк 5' 3' 5' 3' фрагменты Оказаки ДНК ДНК
- 27. МУТАЦИИ Если ошибка синтеза не устраняется системами репарации, то искажение генетической программы. Сохраняющиеся при репликации изменения
- 28. Мутации точечные и хромосомные Точечные: Изменение смысла кодона – замена пар оснований (Г-Ц на А-Т) Бессмысленный
- 29. Транскрипция – синтез РНК Переписывание информации Идет в ядре клетки в 3 этапа. На одной из
- 30. Р Элонгация. Синтез в направлении 5´→3´ по принципу комплементарности (А-У, Г-Ц) ДНК О Структурные гены РНК-полимераза
- 31. Посттранскрипционное созревание РНК - процессинг Кепирование – присоединение метилгуанозина к 5′-концу. Полиаденилирование – присоединение к 3′-
- 32. Обратная транскрипция Синтез ДНК на матрице РНК Фермент – обратная транскриптаза (ревертаза, РНК-зависимая ДНК-полимераза) Матрицей для
- 33. 1. Синтез цепи ДНК на матрице РНК 2. Гидролиз матричной ДНК РНК-азой 3. Синтез на матрице
- 34. БИОСИНТЕЗ Б Е Л К А
- 35. Активация аминокислот Необходимым условием для синтеза белка является наличие не свободных, а активированный аминокислот. Активации аминокислот
- 36. Передача информации о последовательности аминокислот в синтезируемой полипептидной цепи осуществляется с помощью генетического кода. Аминокислотный код
- 37. Свойства кода: Универсален (для всех организмов) триплетен – сочетание из четырех по три дает 64 варианта
- 38. Биосинтез белка Осуществляется в цитоплазме, на рибосоме. Рибосома (80S) состоит из малой (40S) и большой (60S)
- 39. инициация Происходит при участии факторов инициации, ГТФ, Mg2+ . К малой субъединице рибосомы присоединяется мРНК К
- 40. элонгация Циклический процесс В результате каждого цикла пептидная цепочка удлиняется на одну аминокислоту В А-центр рибосомы
- 41. терминация Завершается биосинтез когда в рибосому заходит терминирующий (бессмысленный) кодон Действуют факторы терминации → диссоциация рибосомы,
- 42. Синтез белка протекает со значительной затратой энергии. При активации аминокислот: АТФ до АМФ (две макроэргические связи)
- 43. Регуляция синтеза белка на генетическом уровне В генах человека закодировано около 300 000 белков, но не
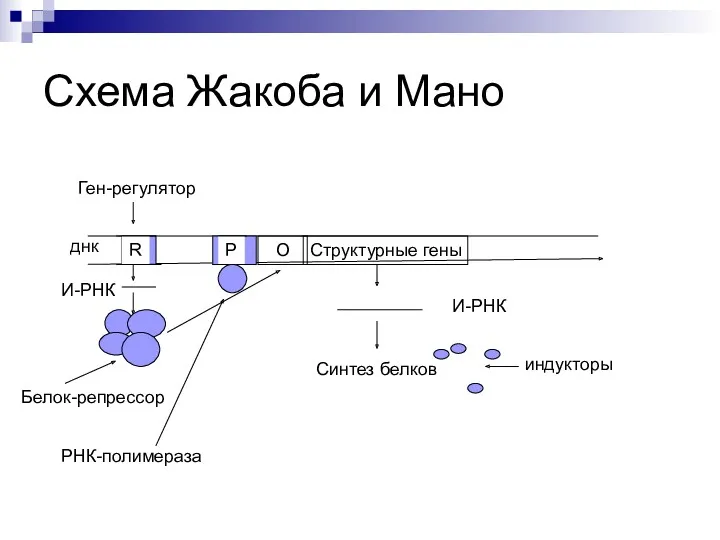
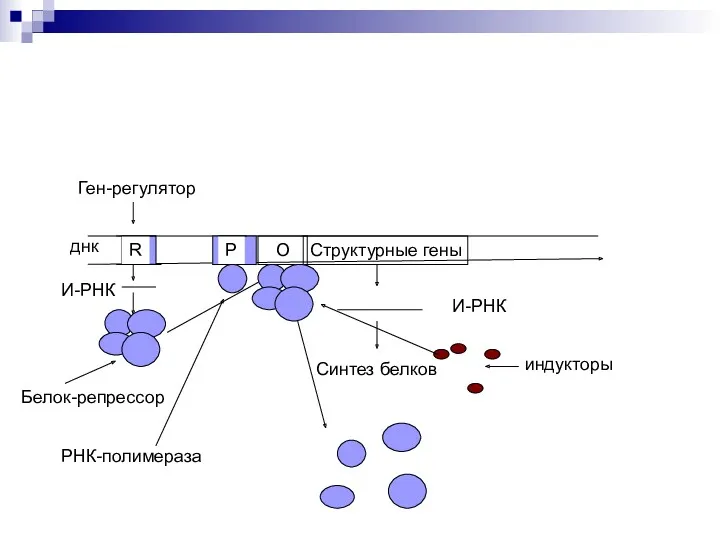
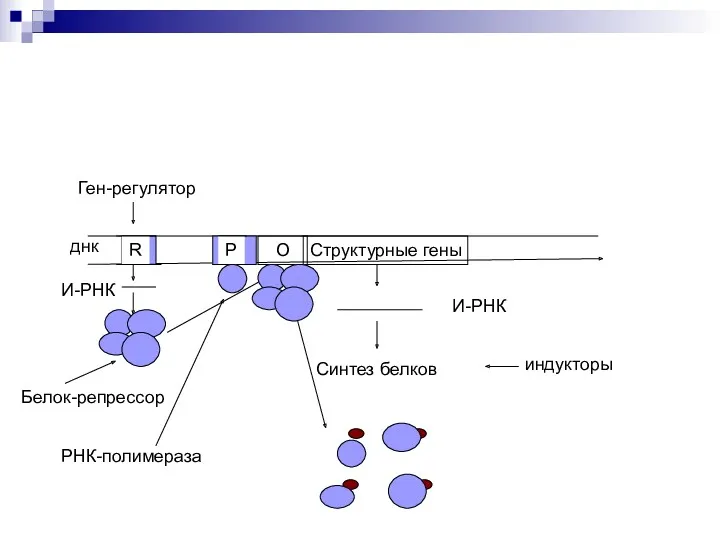
- 44. Оперон – совокупность генов. Ген-регулятор – контролирует синтез специфического белка-регулятора (активатора или репрессора). Промотор – начальный
- 45. Если белок-регулятор взаимодействует с опера-тором, частично блокирует область промотора, это препятствует присоединению РНК-полимеразы к промотору (репрессия
- 46. Значение этой регуляции Приспособление организмов к меняющимся условиям окружающей среды Экономия пластического материала Функцию индукторов и
- 47. Структурные гены О Схема Жакоба и Мано днк R Ген-регулятор О Р И-РНК Белок-репрессор РНК-полимераза И-РНК
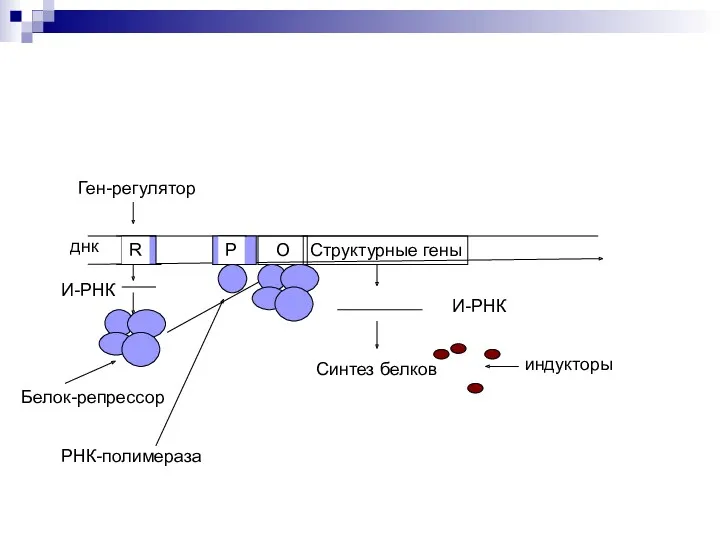
- 48. Структурные гены О днк R Ген-регулятор О Р И-РНК Белок-репрессор РНК-полимераза И-РНК Синтез белков индукторы
- 49. Структурные гены О днк R Ген-регулятор О Р И-РНК Белок-репрессор РНК-полимераза И-РНК Синтез белков индукторы
- 50. Структурные гены О днк R Ген-регулятор О Р И-РНК Белок-репрессор РНК-полимераза И-РНК Синтез белков индукторы
- 51. Ингибиторы синтеза белка Многие эффективные антибиотики избирательно взаимодействуют с белками бактериальных рибосом, ингибируют их синтез белка
- 52. Ингибиторы репликации Антибиотики – актиномицин Д, новобиоцин Алкилирующие агенты (иприт) Аналоги азотистых оснований и нуклеозидов (5-бромурацил,
- 53. Ингибиторы транскрипции Антибиотики – рифампицин (связывается с РНК-полимеразой и препятствует началу транскрипции) Аналоги нуклеозидов (цитозин, арабинозид)
- 54. Ингибиторы трансляции Антибиотики: Тетрациклин тормозит связывание с 30S субъединицей рибосомы и блокирует присоединение аминоацил-т-РНК в А-центр
- 56. Скачать презентацию















































 Кто такие насекомые
Кто такие насекомые Вид. Критерии вида
Вид. Критерии вида Жасушалардың бөлінуі. Митоз. Мейоз
Жасушалардың бөлінуі. Митоз. Мейоз Презентация, Обобщающий урок по теме скелет.
Презентация, Обобщающий урок по теме скелет. Органоиды клетки
Органоиды клетки Отруйні та їстівні гриби
Отруйні та їстівні гриби Сущность жизни и свойства живого
Сущность жизни и свойства живого 20230923_metod_klassifikatsii_organizmov_primenenie_dvoynyh_nazvaniy_organizmov_5_klass
20230923_metod_klassifikatsii_organizmov_primenenie_dvoynyh_nazvaniy_organizmov_5_klass Внешнее строение листа
Внешнее строение листа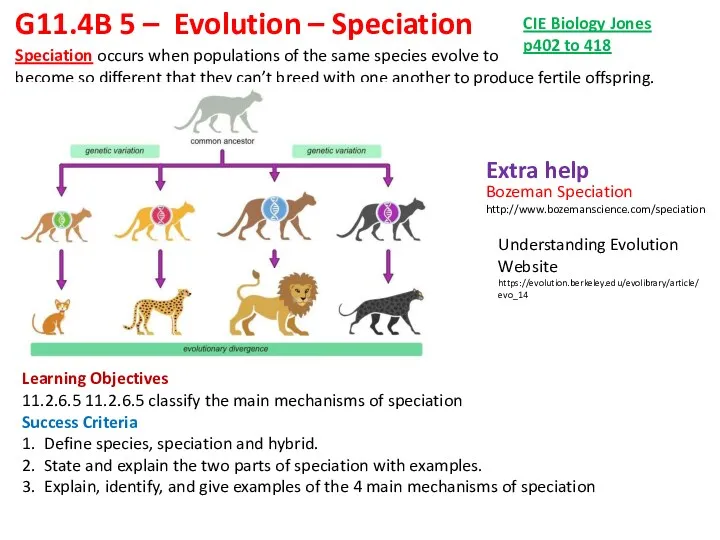 Evolution – Speciation
Evolution – Speciation Наука генетика. Генетика пола и наследование, сцепленное с полом
Наука генетика. Генетика пола и наследование, сцепленное с полом Ефiрнi олii
Ефiрнi олii Цитология. Методы фиксации и окрашивания клеток и тканей
Цитология. Методы фиксации и окрашивания клеток и тканей Су жағалап өсетін зостералар, наядалар, алисмалар тұқымдастары
Су жағалап өсетін зостералар, наядалар, алисмалар тұқымдастары Биология развития
Биология развития Человек и природа. Красная и черная книги
Человек и природа. Красная и черная книги Түйеқұстар отряды
Түйеқұстар отряды Пищеварительная система человека
Пищеварительная система человека обмен веществ и энергии в клетке.
обмен веществ и энергии в клетке. Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3)
Межклеточная сигнализация. Сигнальные молекулы. Гормоны. (Тема 3) Белки плазмы крови
Белки плазмы крови История развития генетики как науки
История развития генетики как науки Половая система
Половая система Класс насекомые. Общая характеристика
Класс насекомые. Общая характеристика Бұршақ тұқымдас дақылдарының зиянкестері
Бұршақ тұқымдас дақылдарының зиянкестері Вирень ракшатне. Тест
Вирень ракшатне. Тест Растения, которые используются в промышлености. Эвкалипт
Растения, которые используются в промышлености. Эвкалипт Система крови
Система крови