Содержание
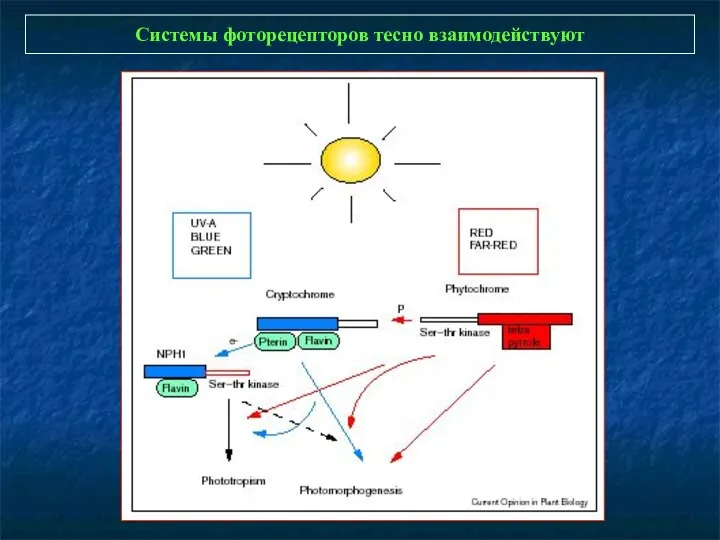
- 2. Системы фоторецепторов тесно взаимодействуют
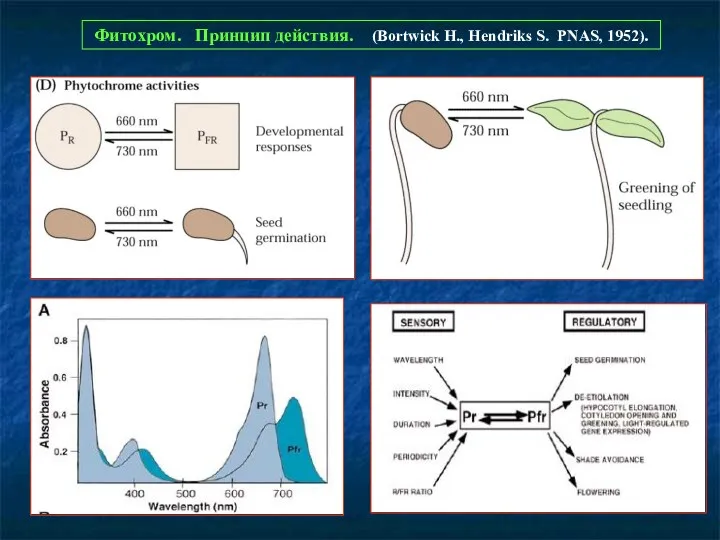
- 3. Фитохром. Принцип действия. (Bortwick H., Hendriks S. PNAS, 1952).
- 4. Фотообращаемые эффекты фитохромов. Покрытосеменные салат-латук семена Стимуляция прорастания овес этиолированные Стимуляция деэтиоляции проростки горчица проростки Стимуляция
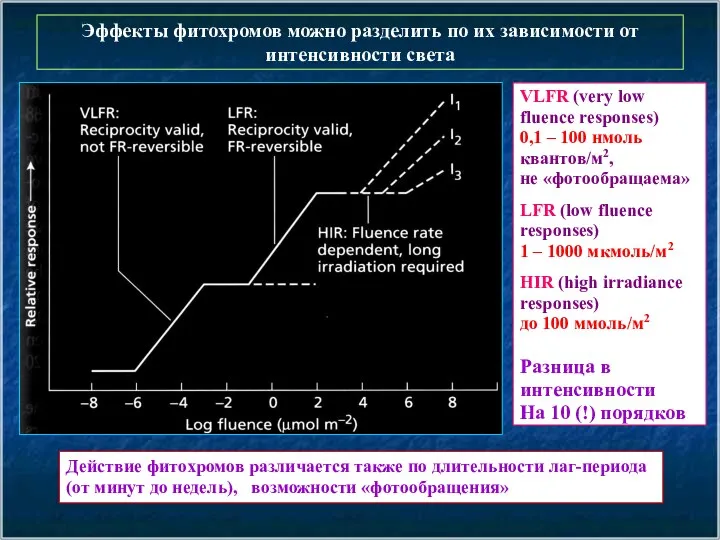
- 5. Эффекты фитохромов можно разделить по их зависимости от интенсивности света VLFR (very low fluence responses) 0,1
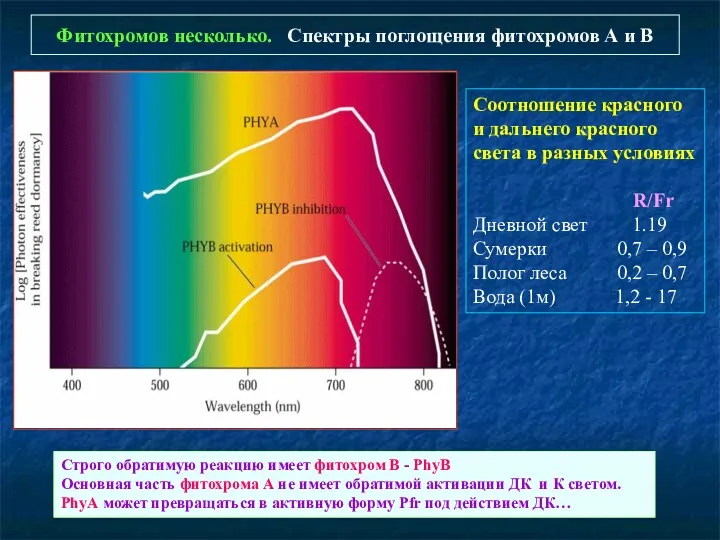
- 6. Фитохромов несколько. Спектры поглощения фитохромов А и В Соотношение красного и дальнего красного света в разных
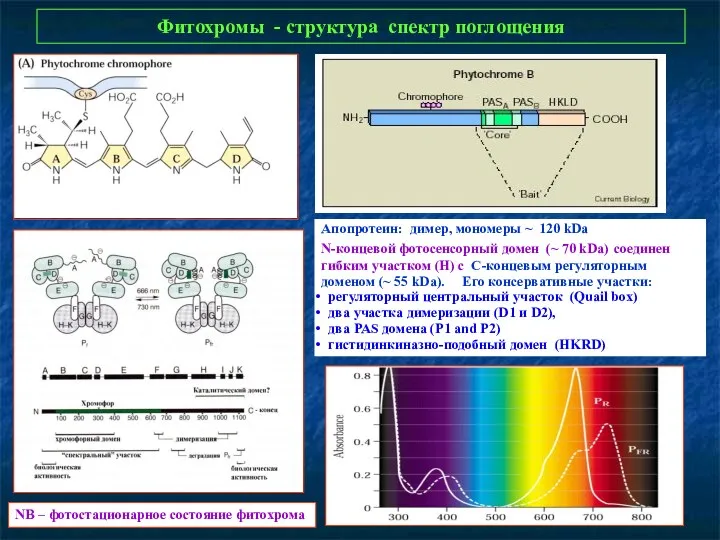
- 7. Фитохромы - структура спектр поглощения NB – фотостационарное состояние фитохрома Апопротеин: димер, мономеры ~ 120 kDa
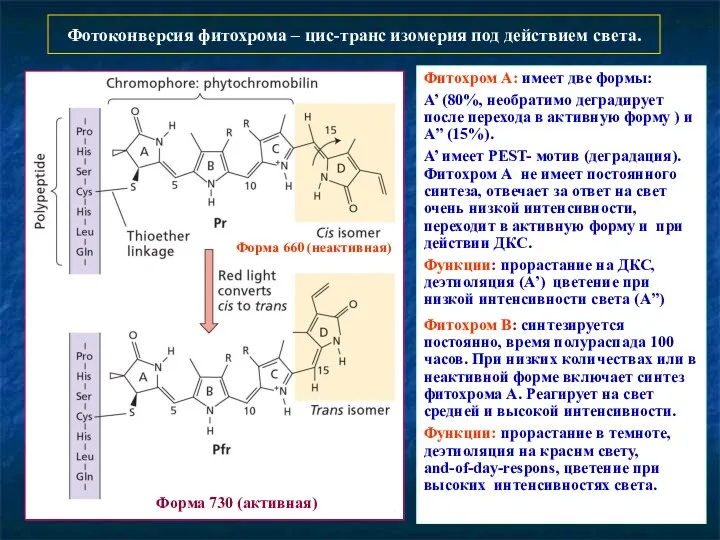
- 8. Фотоконверсия фитохрома – цис-транс изомерия под действием света. Форма 660 (неактивная) Форма 730 (активная) Фитохром А:
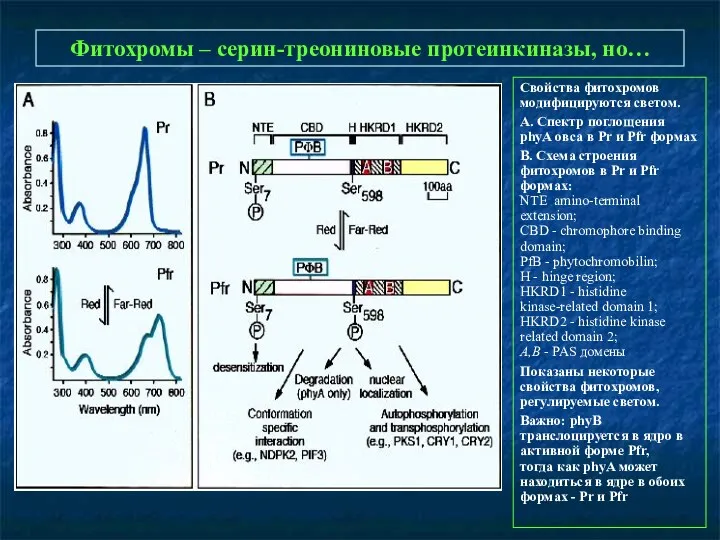
- 9. Фитохромы – серин-треониновые протеинкиназы, но… Свойства фитохромов модифицируются светом. А. Спектр поглощения phyA овса в Pr
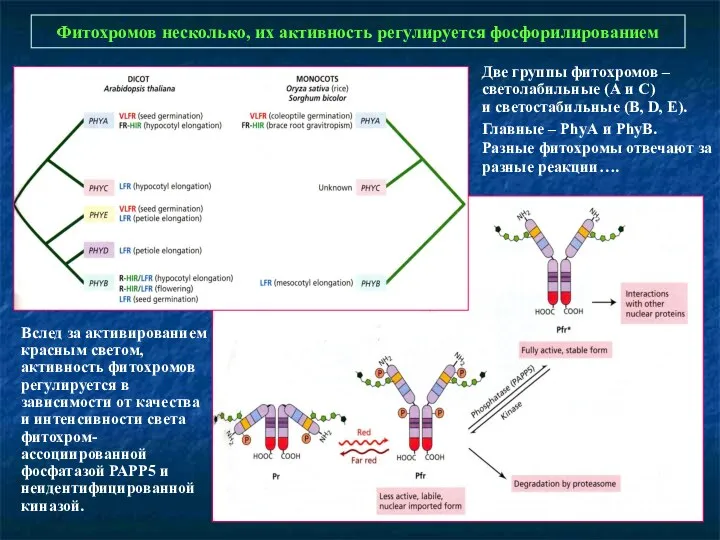
- 10. Фитохромов несколько, их активность регулируется фосфорилированием Вслед за активированием красным светом, активность фитохромов регулируется в зависимости
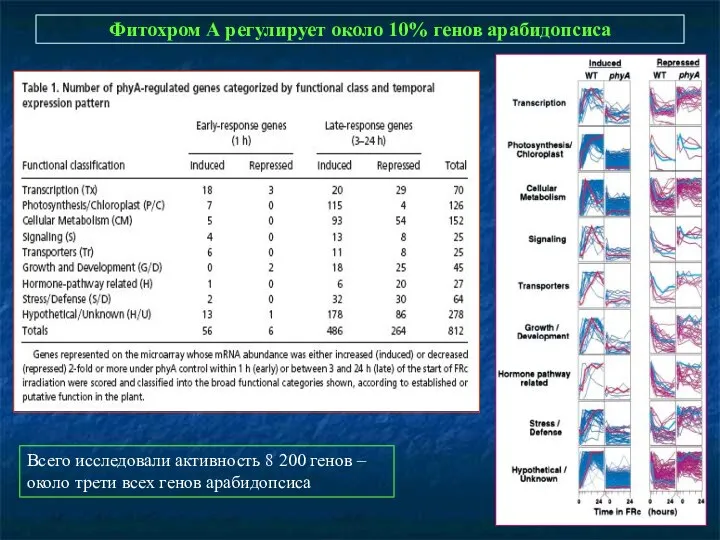
- 11. Фитохром А регулирует около 10% генов арабидопсиса Всего исследовали активность 8 200 генов – около трети
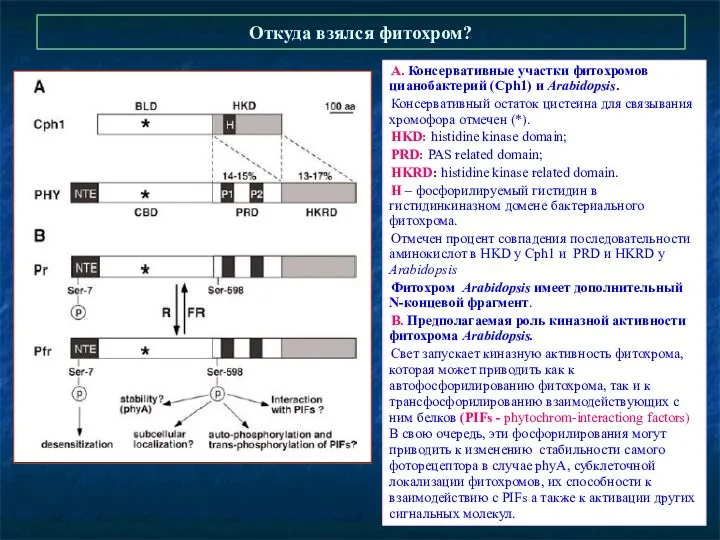
- 12. Откуда взялся фитохром? А. Консервативные участки фитохромов цианобактерий (Cph1) и Arabidopsis. Консервативный остаток цистеина для связывания
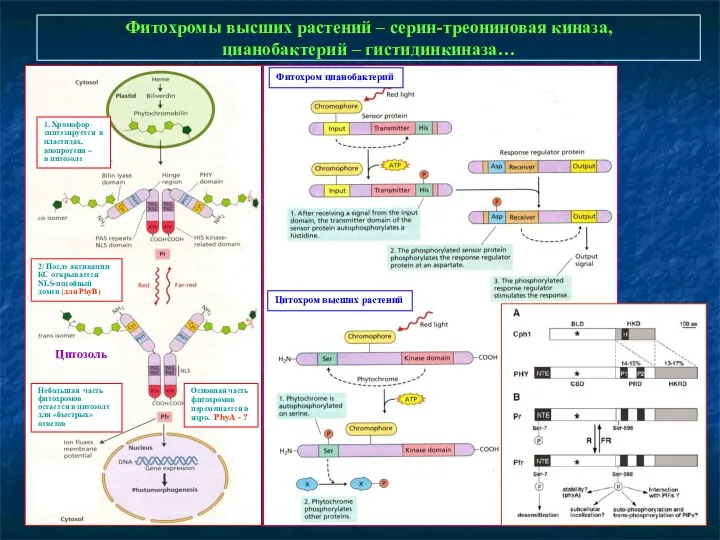
- 13. Фитохромы высших растений – серин-треониновая киназа, цианобактерий – гистидинкиназа… 1. Хромофор синтезируется в пластидах, апопротеин –
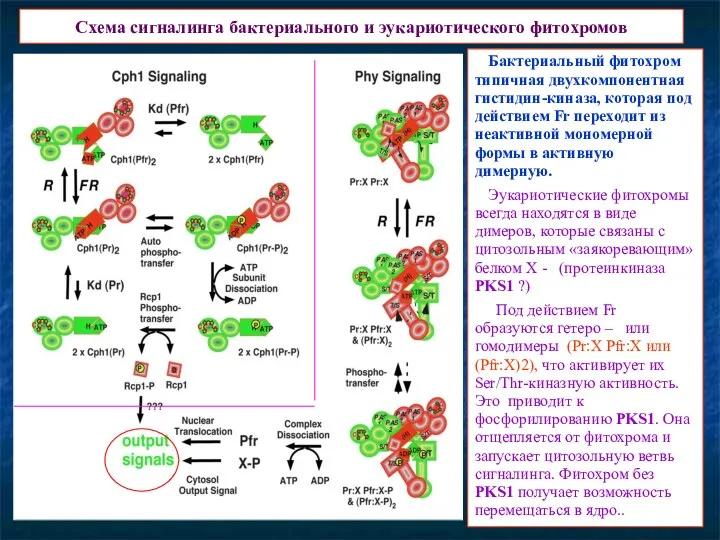
- 14. Схема сигналинга бактериального и эукариотического фитохромов Бактериальный фитохром типичная двухкомпонентная гистидин-киназа, которая под действием Fr переходит
- 15. Сигналинг фитохромов. Основные «игроки» и общие положения Два типа ответов – быстрые (секунды) и «глобалные». Быстрые
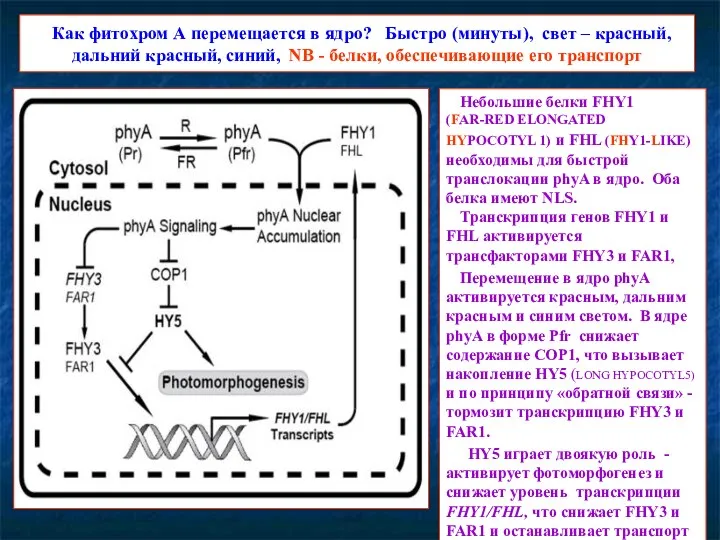
- 16. Как фитохром А перемещается в ядро? Быстро (минуты), свет – красный, дальний красный, синий, NB -
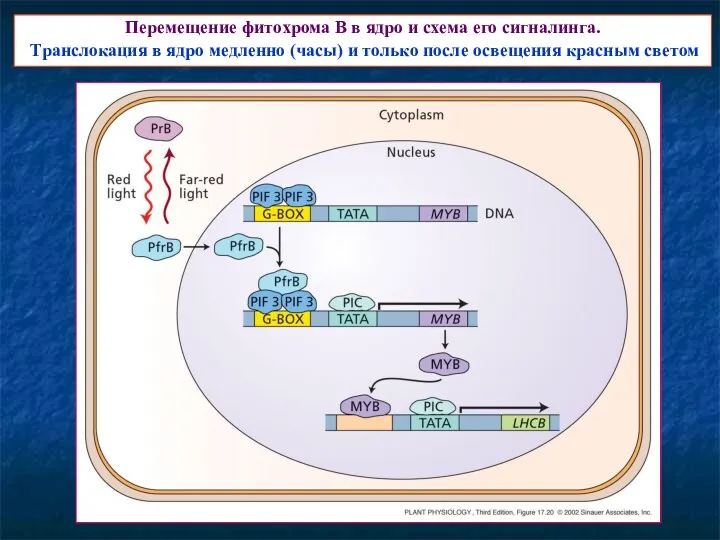
- 17. Перемещение фитохрома В в ядро и схема его сигналинга. Транслокация в ядро медленно (часы) и только
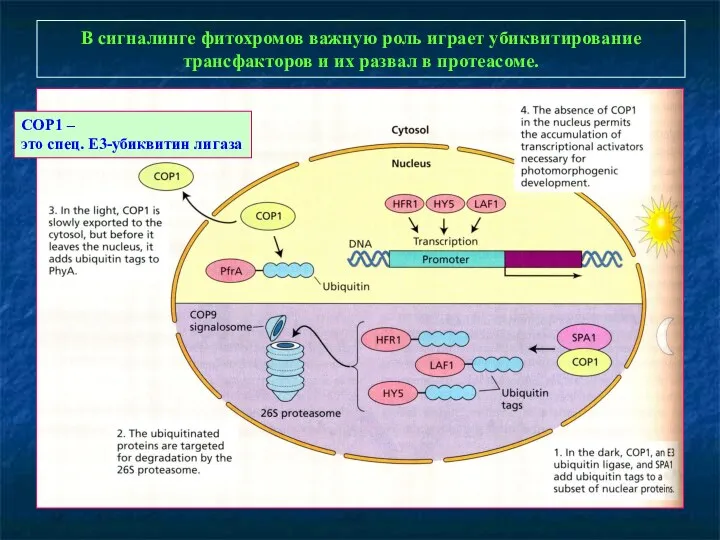
- 18. В сигналинге фитохромов важную роль играет убиквитирование трансфакторов и их развал в протеасоме. COP1 – это
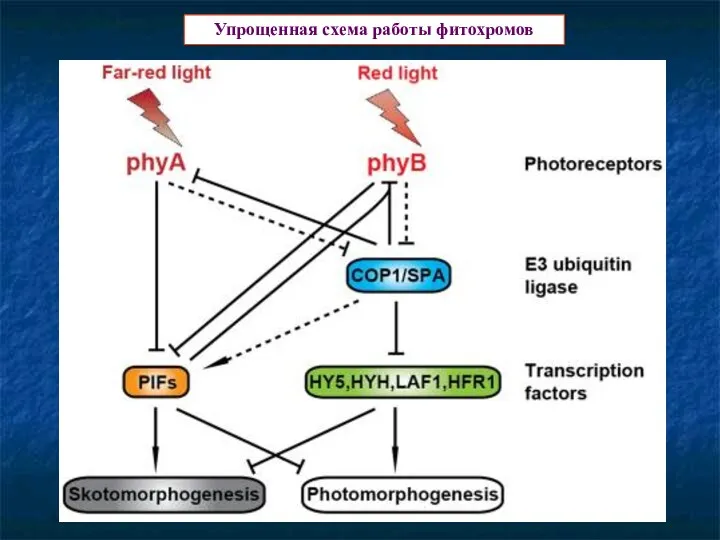
- 19. Упрощенная схема работы фитохромов
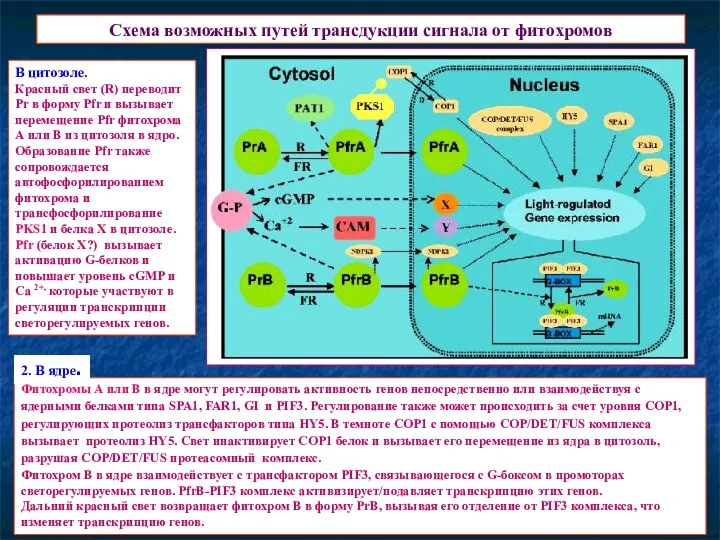
- 20. Схема возможных путей трансдукции сигнала от фитохромов Фитохромы А или В в ядре могут регулировать активность
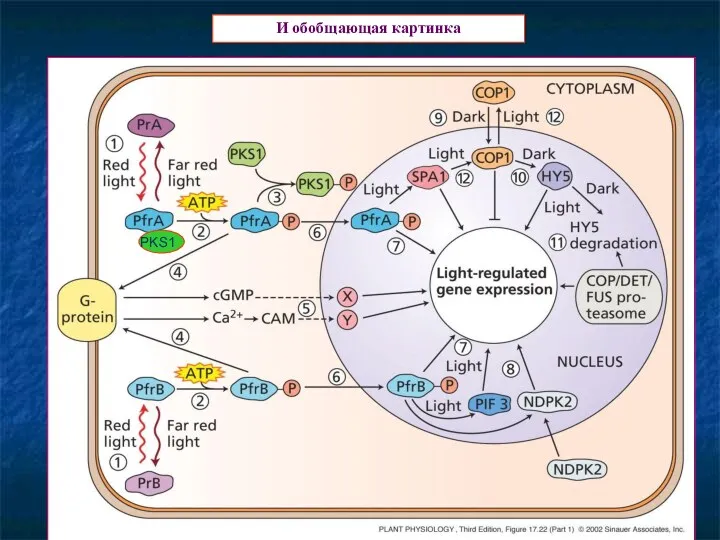
- 21. И обобщающая картинка PKS1
- 22. Рецепторы синего света отвечают за многое… Реакция фототропизма Движение хлоропластов Циркадные ритмы: открытие устьиц «сонные» движения
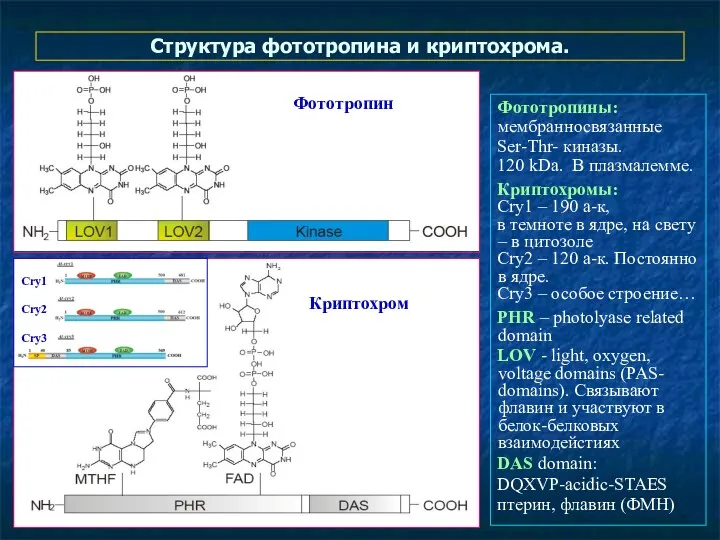
- 23. Структура фототропина и криптохрома. Фототропины: мембранносвязанные Ser-Thr- киназы. 120 kDa. В плазмалемме. Криптохромы: Cry1 – 190
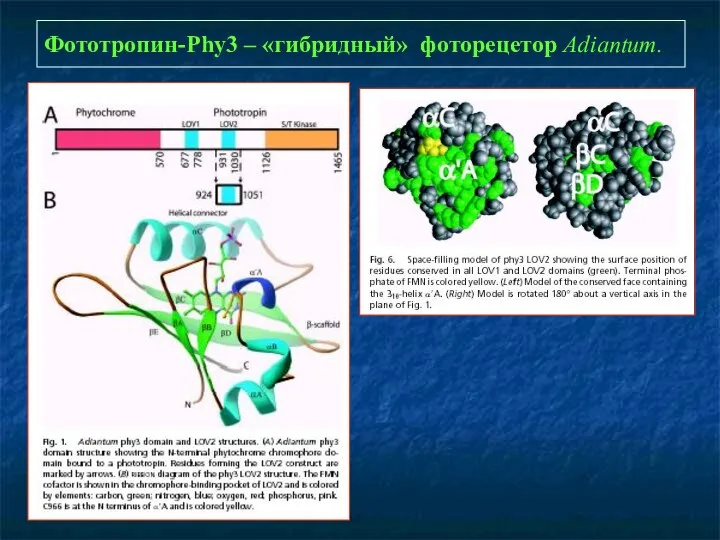
- 24. Фототропин-Phy3 – «гибридный» фоторецетор Adiantum.
- 25. Схема строения фоторецепторов и их взаимодействие
- 26. Фототропины участвуют в регуляции разных фотодвижений Изгибание колеоптиля Движение хлоропластов Открывание устьиц У Arabidopsis работают два
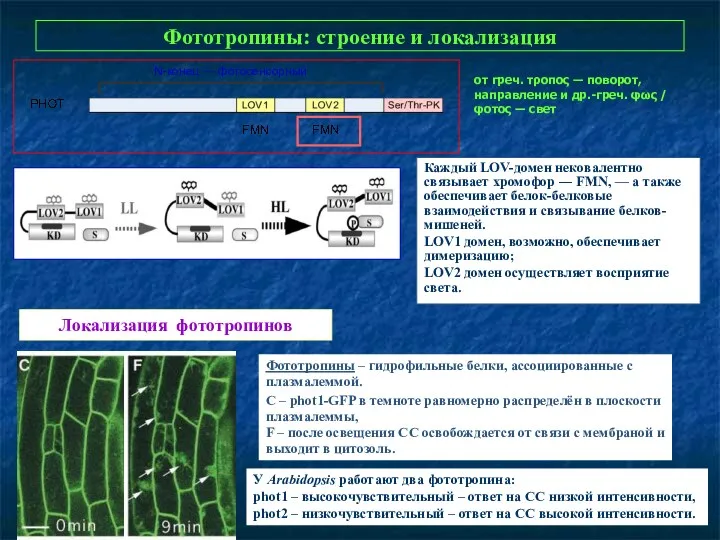
- 27. Фототропины: строение и локализация Каждый LOV-домен нековалентно связывает хромофор ― FMN, — а также обеспечивает белок-белковые
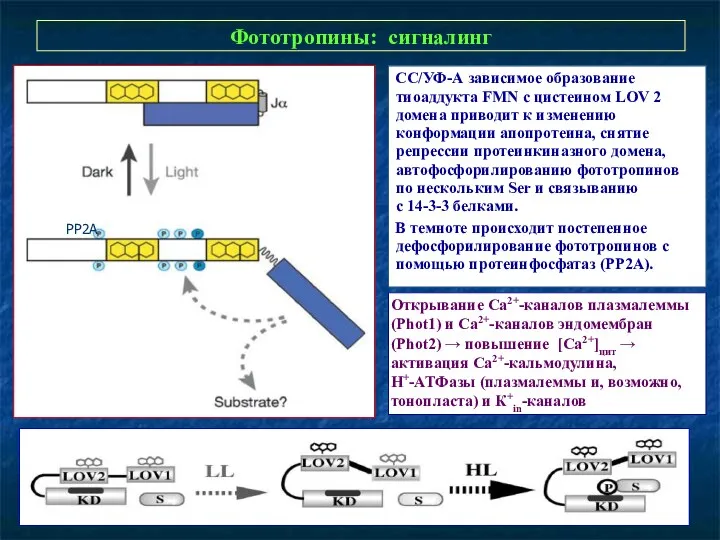
- 28. Фототропины: сигналинг СС/УФ-А зависимое образование тиоаддукта FMN с цистеином LOV 2 домена приводит к изменению конформации
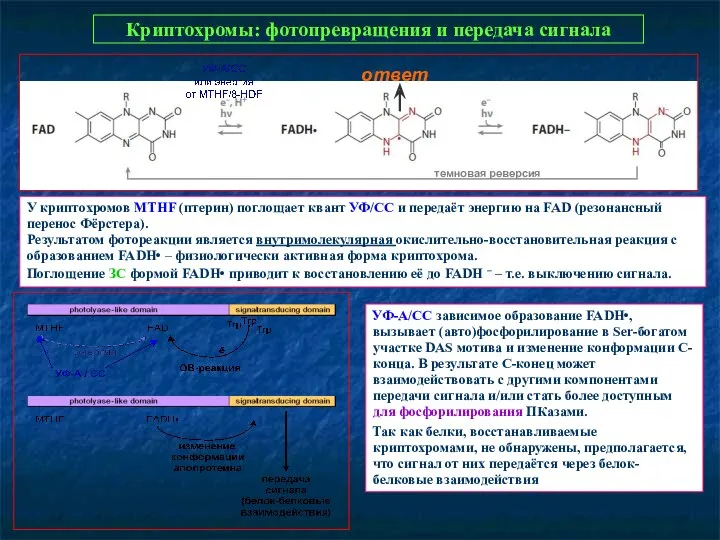
- 29. Криптохромы: фотопревращения и передача сигнала У криптохромов MTHF (птерин) поглощает квант УФ/СС и передаёт энергию на
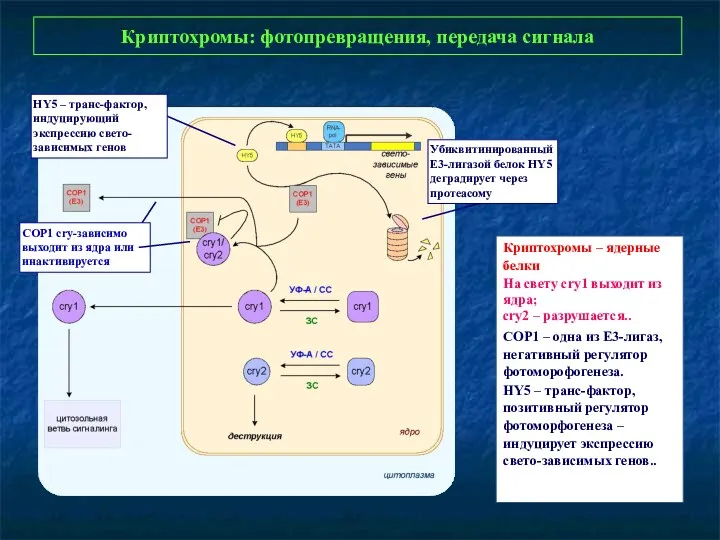
- 30. Криптохромы: фотопревращения, передача сигнала Криптохромы – ядерные белки На свету cry1 выходит из ядра; cry2 –
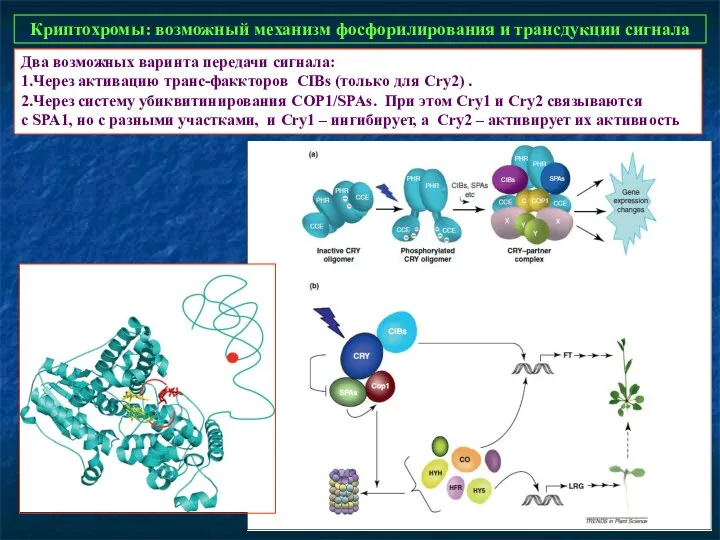
- 31. Криптохромы: возможный механизм фосфорилирования и трансдукции сигнала Два возможных варинта передачи сигнала: 1.Через активацию транс-факкторов CIBs
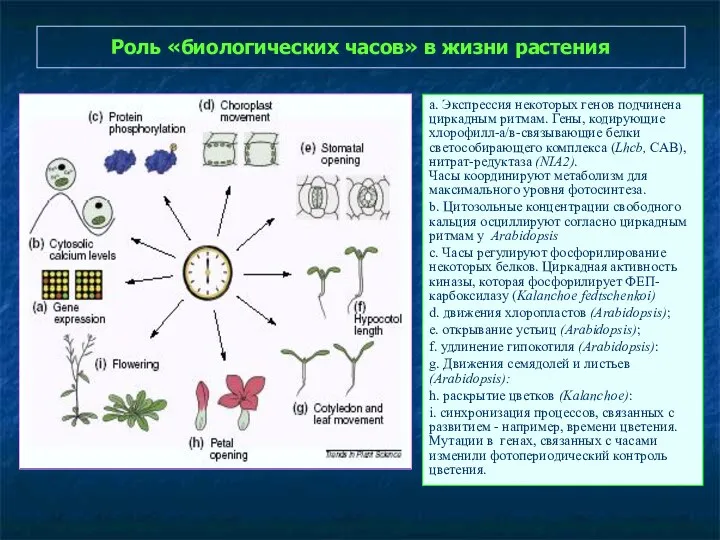
- 32. Роль «биологических часов» в жизни растения а. Экспрессия некоторых генов подчинена циркадным ритмам. Гены, кодирующие хлорофилл-а/в-связывающие
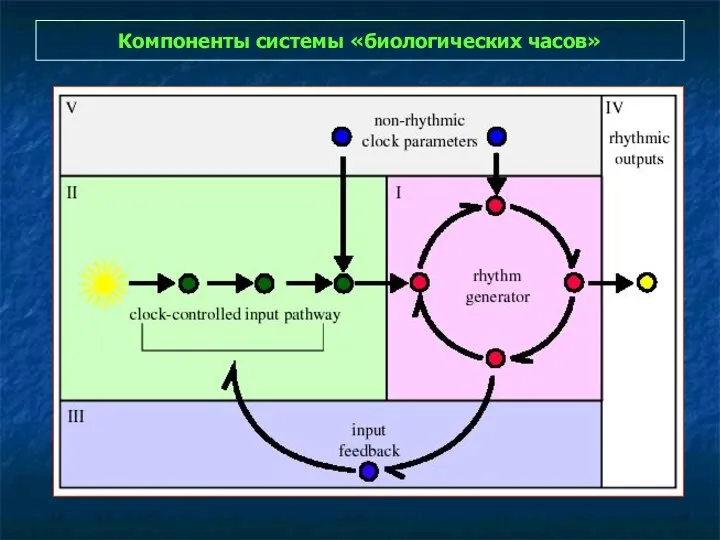
- 33. Компоненты системы «биологических часов»
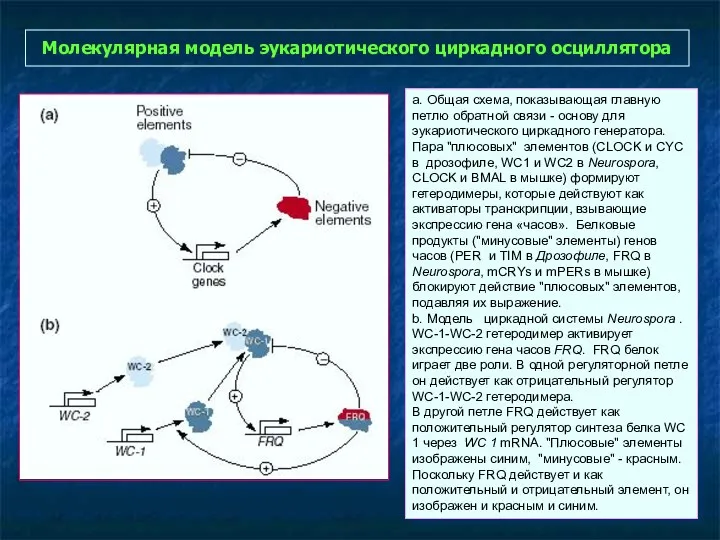
- 34. Молекулярная модель эукариотического циркадного осциллятора a. Общая схема, показывающая главную петлю обратной связи - основу для
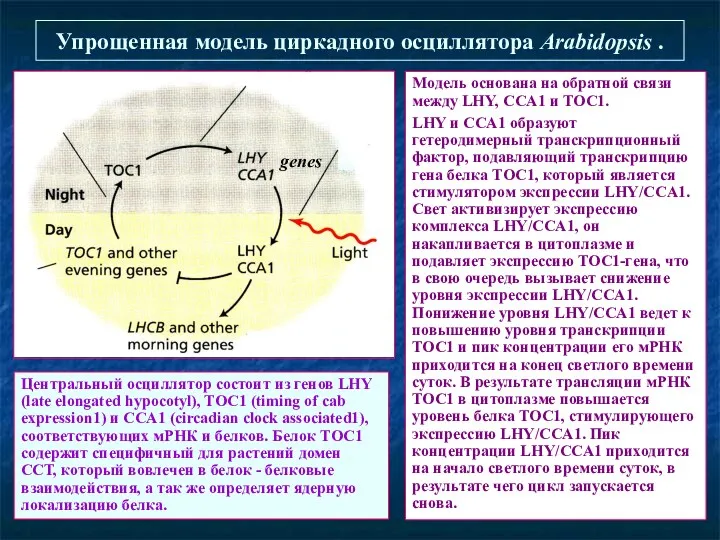
- 35. Упрощенная модель циркадного осциллятора Arabidopsis . Модель основана на обратной связи между LHY, CCA1 и TOC1.
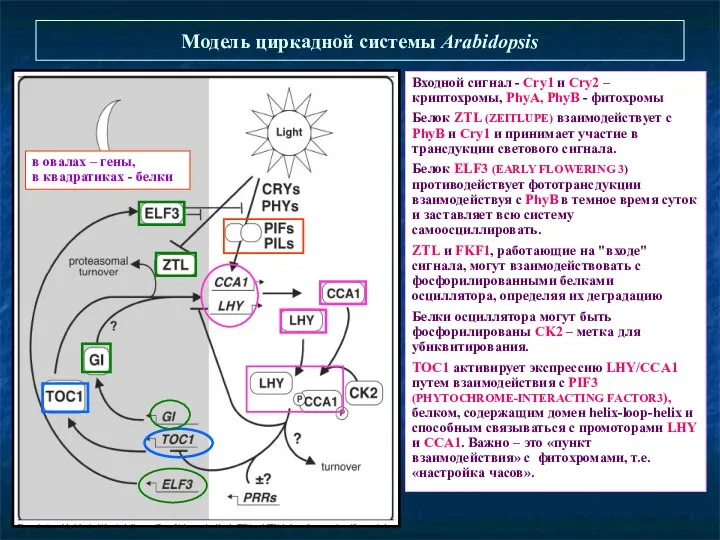
- 36. Модель циркадной системы Arabidopsis Входной сигнал - Сry1 и Сry2 – криптохромы, PhyA, PhyB - фитохромы
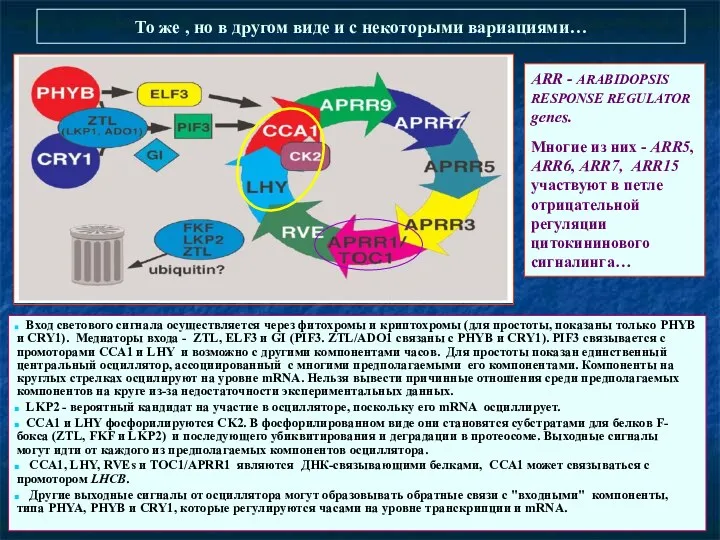
- 37. То же , но в другом виде и с некоторыми вариациями… Вход светового сигнала осуществляется через
- 38. Стратегии развития животных и растений различны. У животных: развитие – серия сложных преобразований, которые ведут к
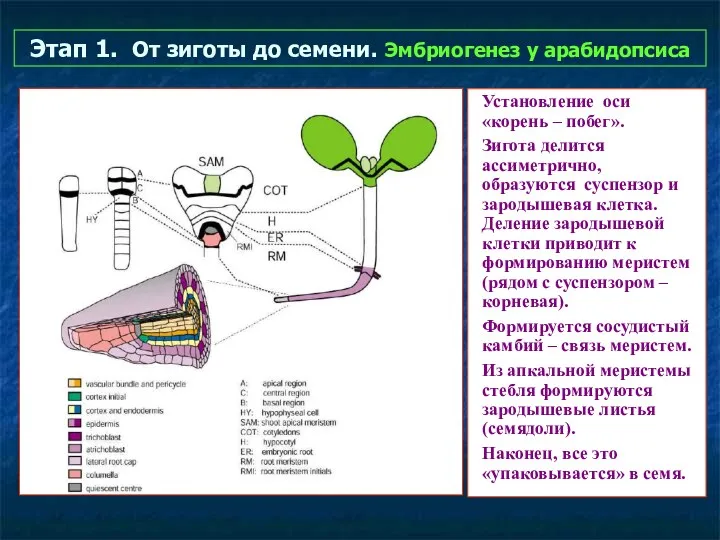
- 39. Этап 1. От зиготы до семени. Эмбриогенез у арабидопсиса Установление оси «корень – побег». Зигота делится
- 40. Особенности и механизмы эмбрионального развития растений Формирование зародыша у растений происходит за счет изменения скорости и
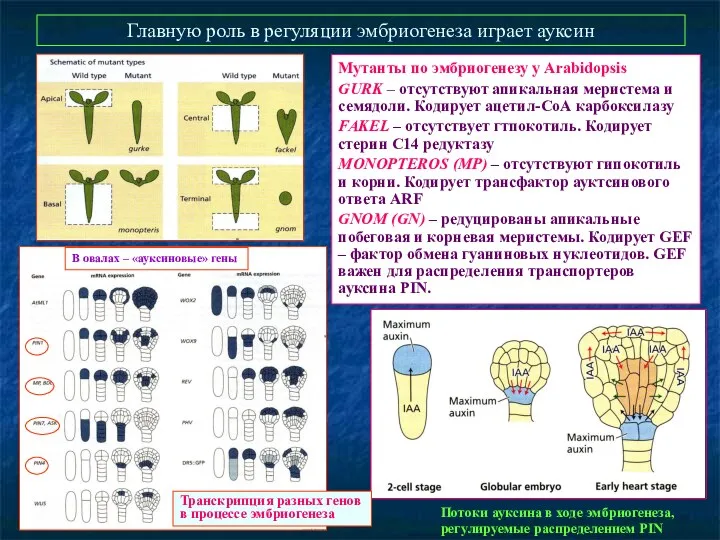
- 41. Главную роль в регуляции эмбриогенеза играет ауксин Мутанты по эмбриогенезу у Arabidopsis GURK – отсутствуют апикальная
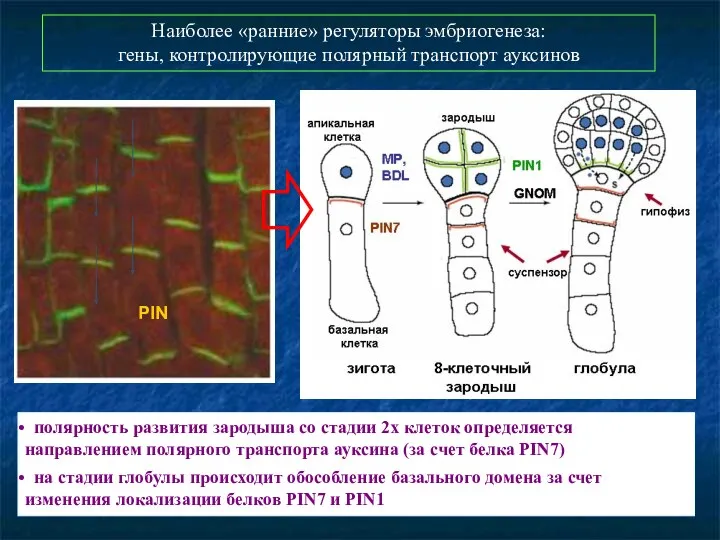
- 42. Наиболее «ранние» регуляторы эмбриогенеза: гены, контролирующие полярный транспорт ауксинов полярность развития зародыша со стадии 2х клеток
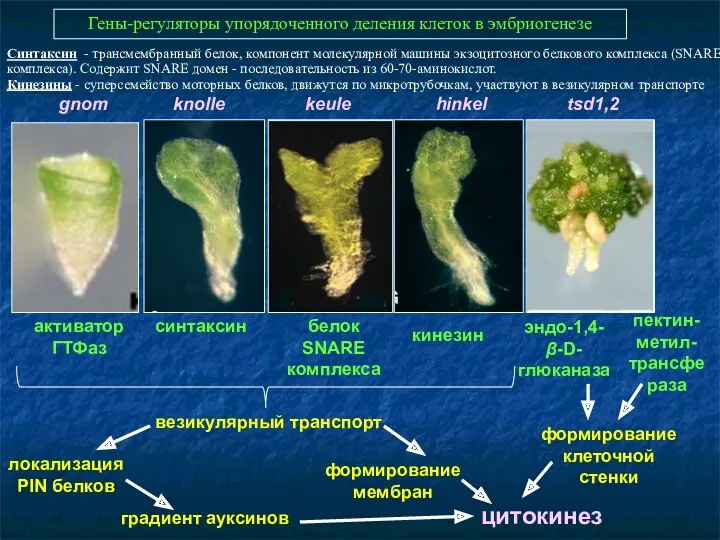
- 43. Гены-регуляторы упорядоченного деления клеток в эмбриогенезе gnom knolle keule hinkel tsd1,2 эндо-1,4-β-D-глюканаза синтаксин кинезин белок SNARE
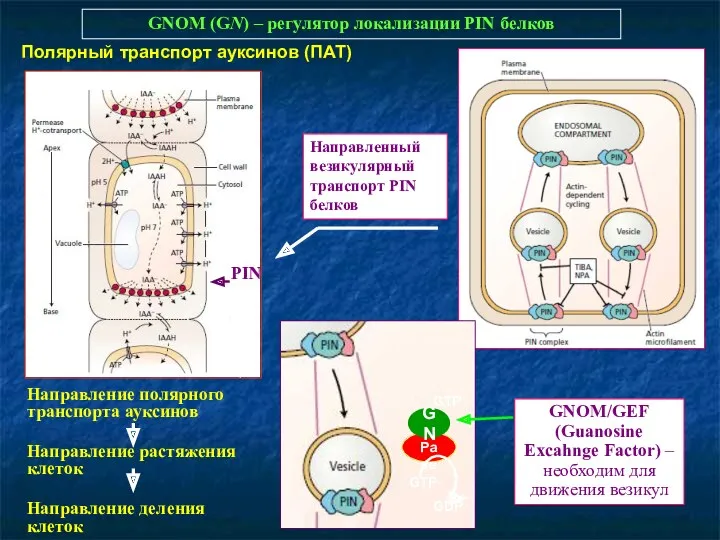
- 44. GNOM (GN) – регулятор локализации PIN белков PIN Направление полярного транспорта ауксинов Направление растяжения клеток Направление
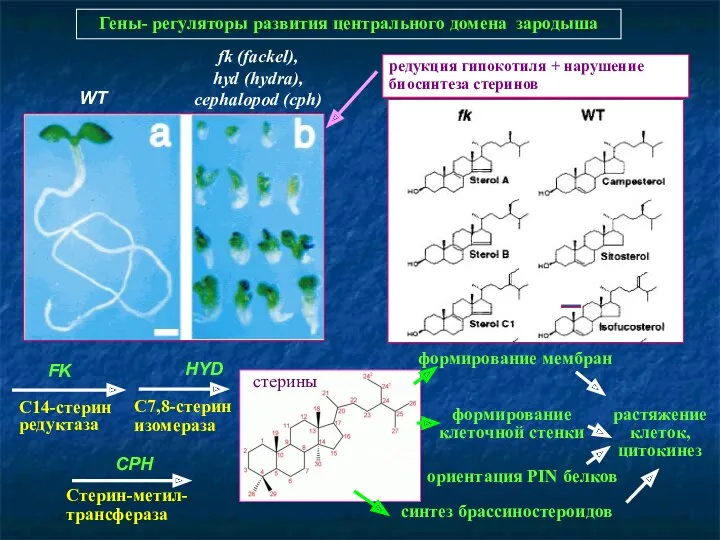
- 45. Гены- регуляторы развития центрального домена зародыша WT fk (fackel), hyd (hydra), cephalopod (cph) редукция гипокотиля +
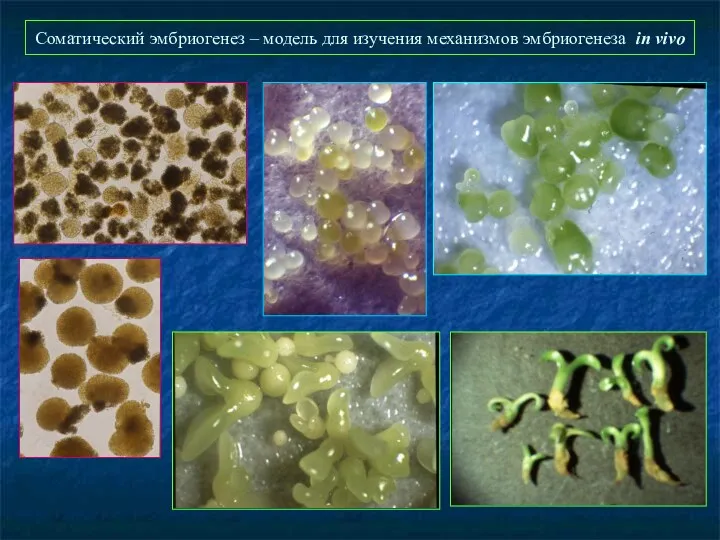
- 46. Соматический эмбриогенез – модель для изучения механизмов эмбриогенеза in vivo
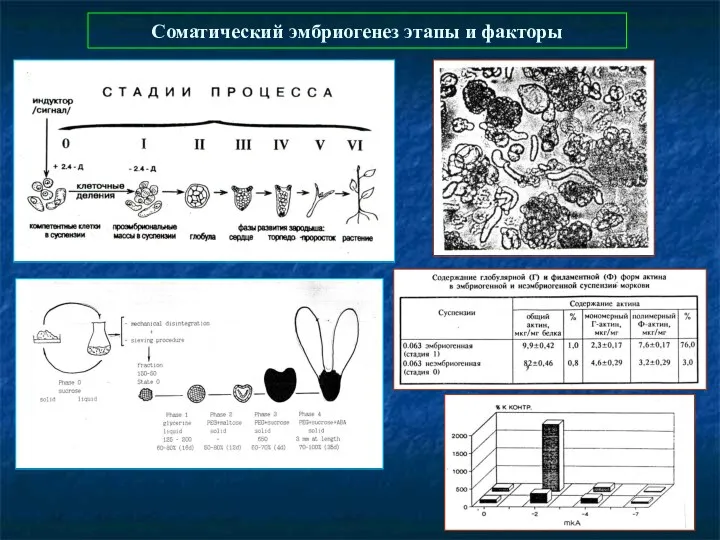
- 47. Соматический эмбриогенез этапы и факторы
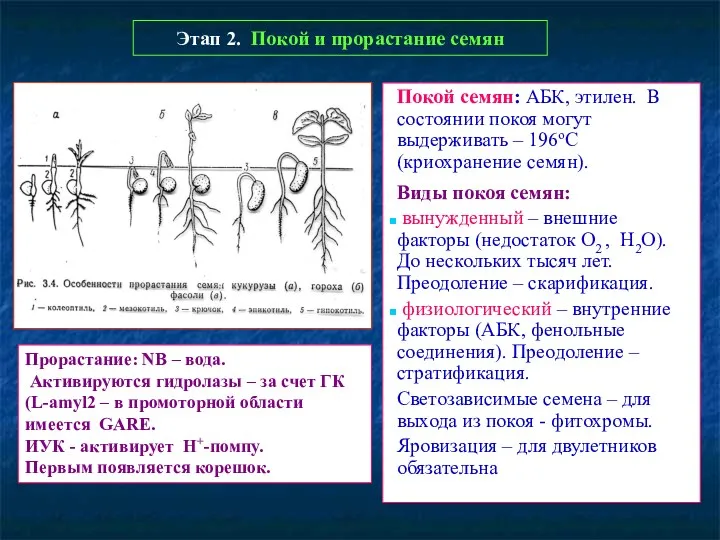
- 48. Этап 2. Покой и прорастание семян Покой семян: АБК, этилен. В состоянии покоя могут выдерживать –
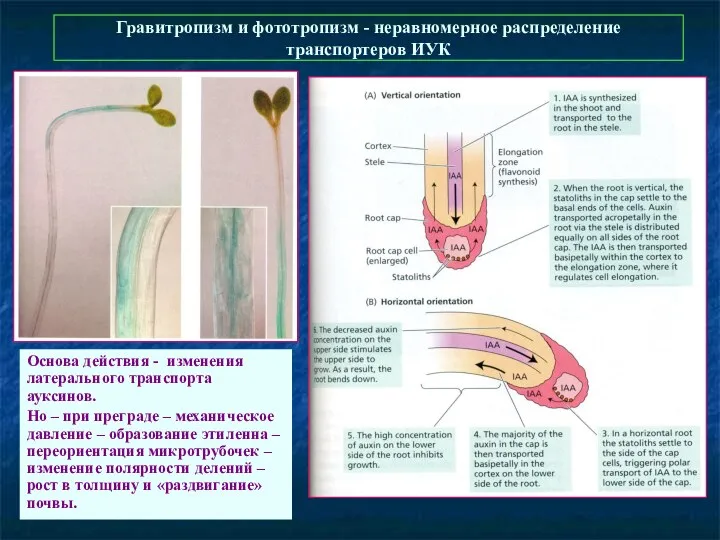
- 49. Гравитропизм и фототропизм - неравномерное распределение транспортеров ИУК Основа действия - изменения латерального транспорта ауксинов. Но
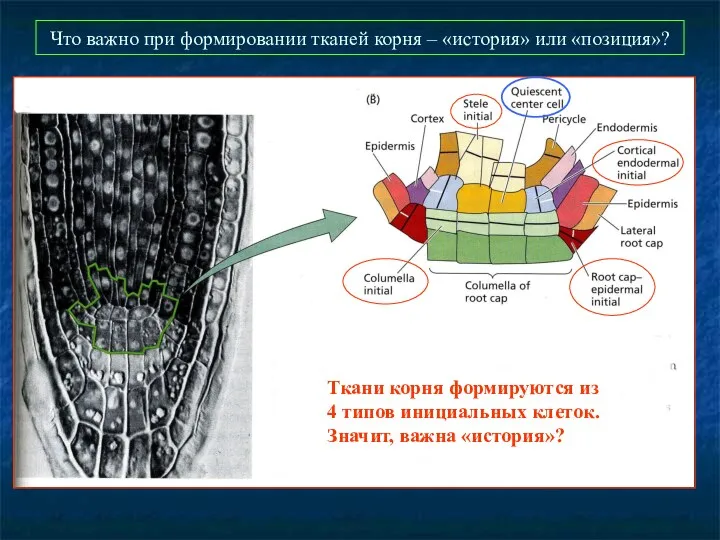
- 50. Что важно при формировании тканей корня – «история» или «позиция»? Ткани корня формируются из 4 типов
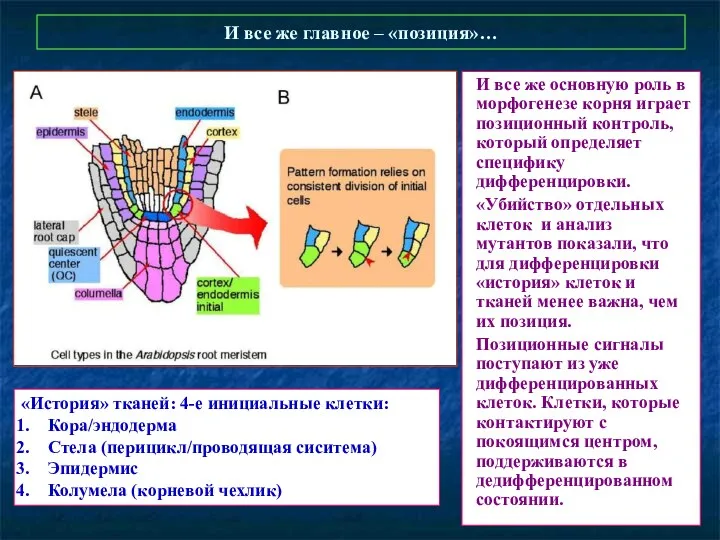
- 51. И все же главное – «позиция»… И все же основную роль в морфогенезе корня играет позиционный
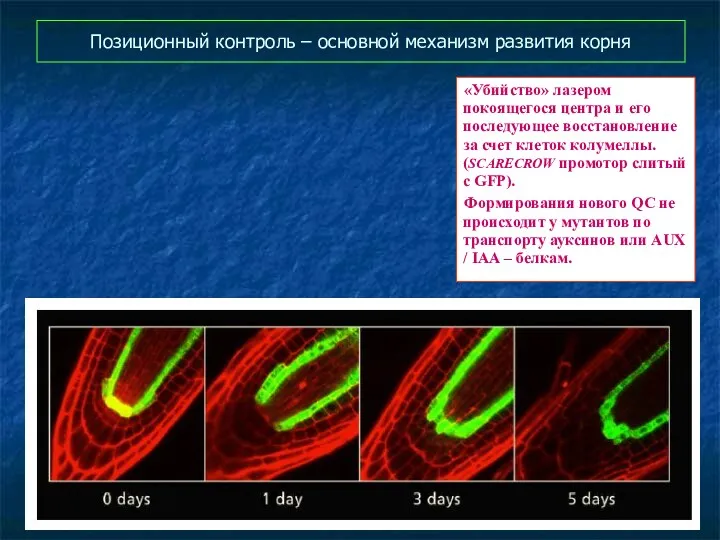
- 52. Позиционный контроль – основной механизм развития корня «Убийство» лазером покоящегося центра и его последующее восстановление за
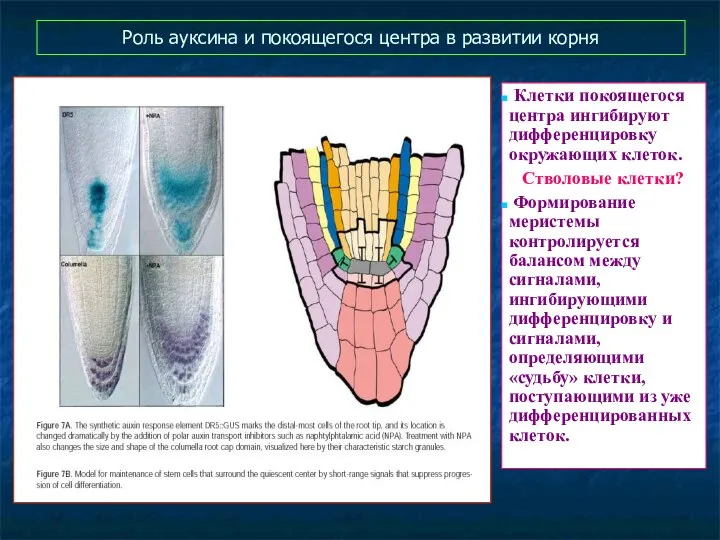
- 53. Роль ауксина и покоящегося центра в развитии корня Клетки покоящегося центра ингибируют дифференцировку окружающих клеток. Стволовые
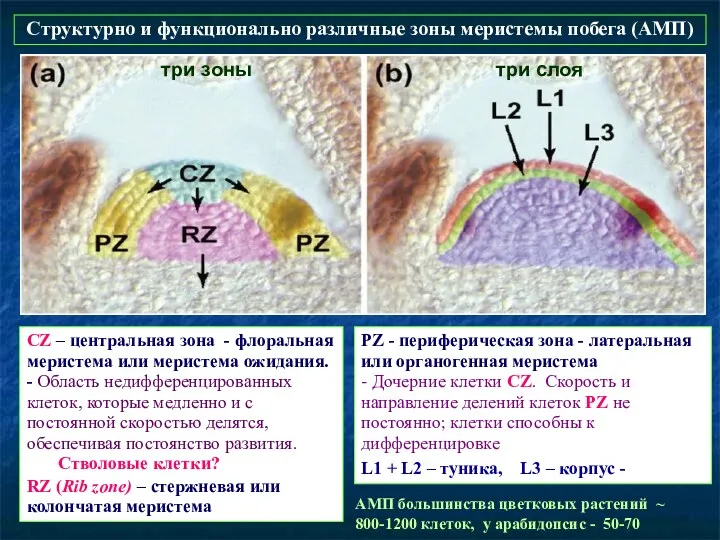
- 54. PZ - периферическая зона - латеральная или органогенная меристема - Дочерние клетки CZ. Скорость и направление
- 55. Генетический контроль структуры и функции АМП («классическая генетика») Выявлены два классов мутантов, имеющих альтернативный фенотип: мутанты
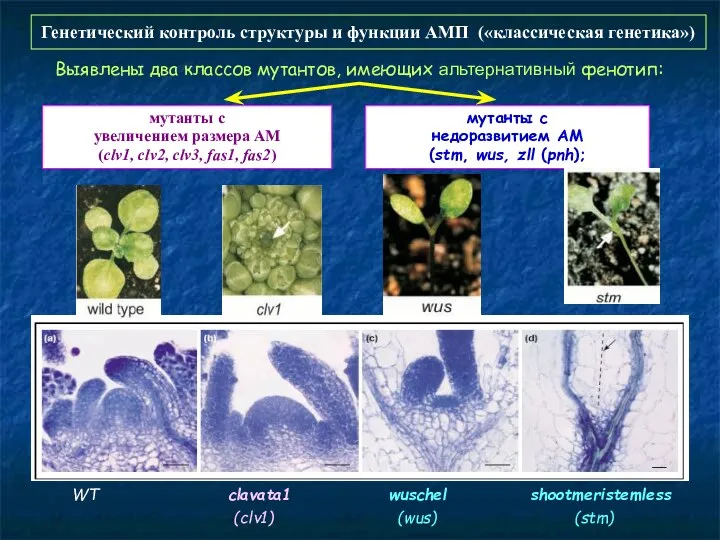
- 56. Ауксин играет ключевую роль и в формирование побеговой апикальной меристемы и билатеральной симметрии CUP-SHAPED COTYLEDON («чашевидные
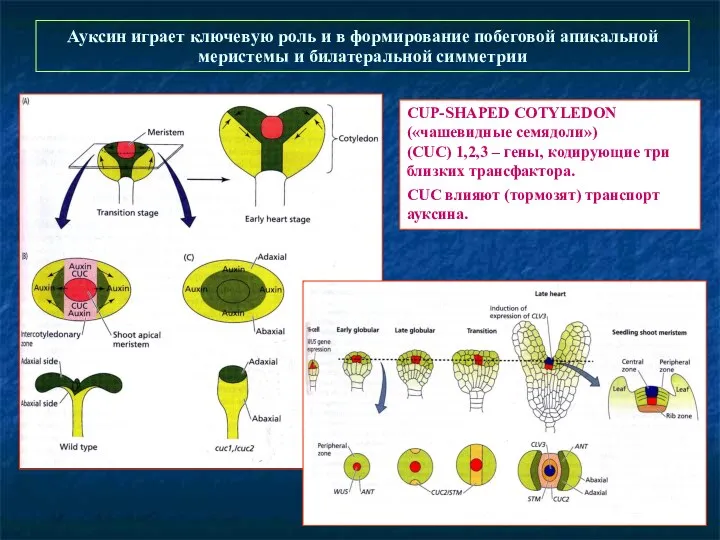
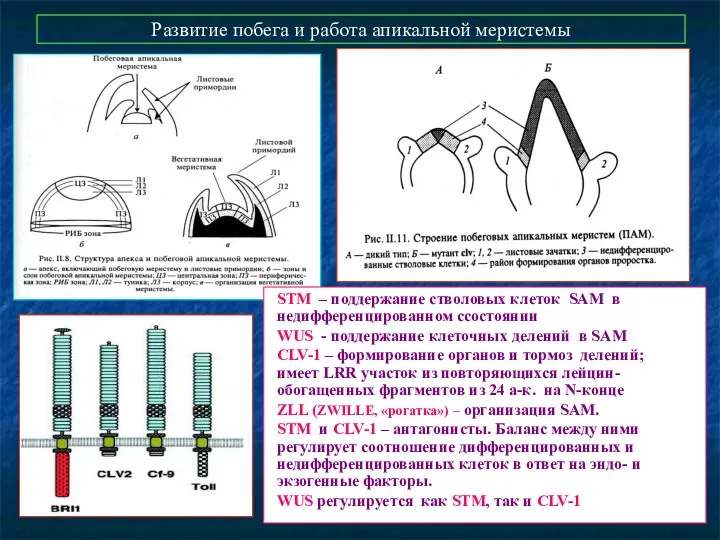
- 57. Развитие побега и работа апикальной меристемы STM – поддержание стволовых клеток SAM в недифференцированном cсостоянии WUS
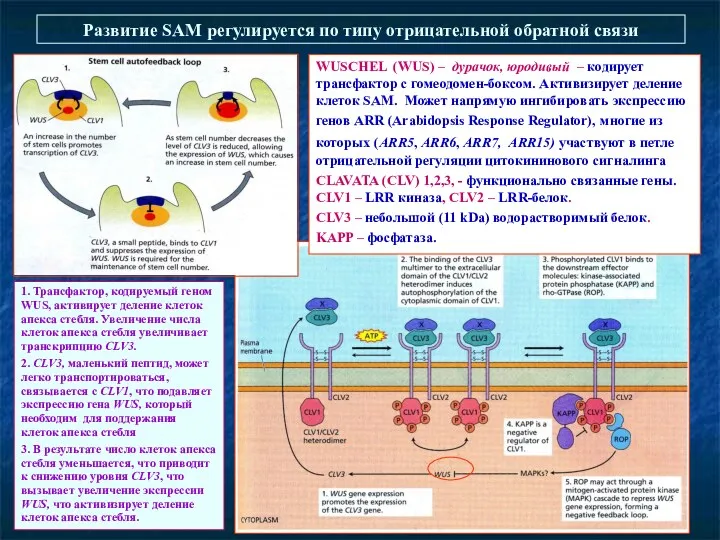
- 58. Развитие SAM регулируется по типу отрицательной обратной связи WUSCHEL (WUS) – дурачок, юродивый – кодирует трансфактор
- 59. Система WOX - CLE Wang, Fiers 2010. CLE peptide signaling during plant development. Protoplasma 240: 33-43
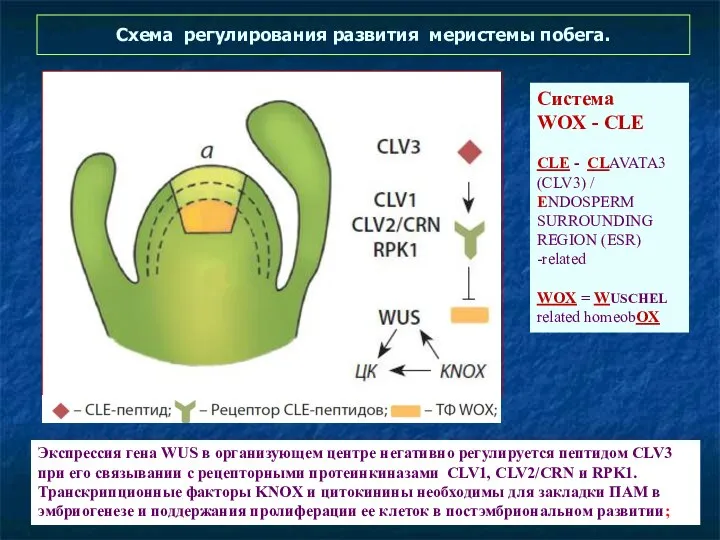
- 60. Схема регулирования развития меристемы побега. Экспрессия гена WUS в организующем центре негативно регулируется пептидом CLV3 при
- 61. CLE - пептиды участвуют в определении судьбы клеток меристем Wang, Fiers 2010. CLE peptide signaling during
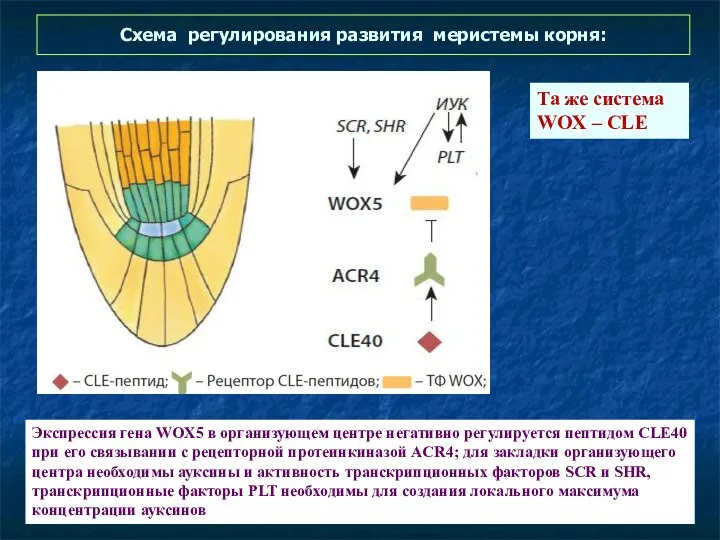
- 62. Схема регулирования развития меристемы корня: Экспрессия гена WOX5 в организующем центре негативно регулируется пептидом CLE40 при
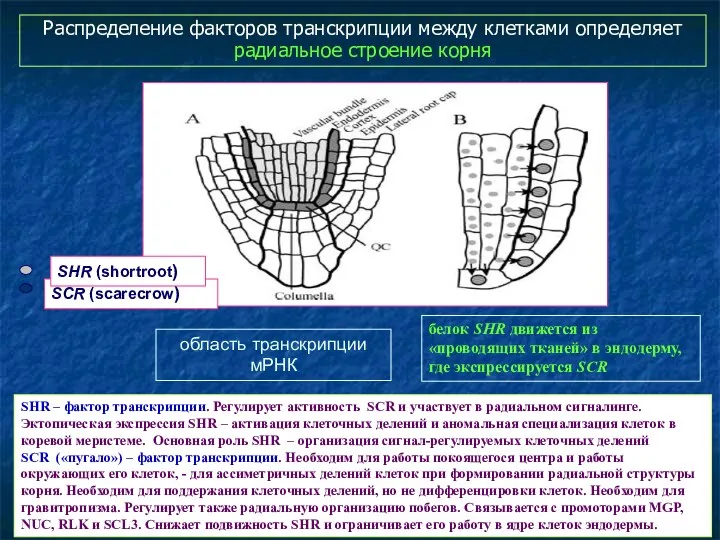
- 63. Распределение факторов транскрипции между клетками определяет радиальное строение корня SHR – фактор транскрипции. Регулирует активность SCR
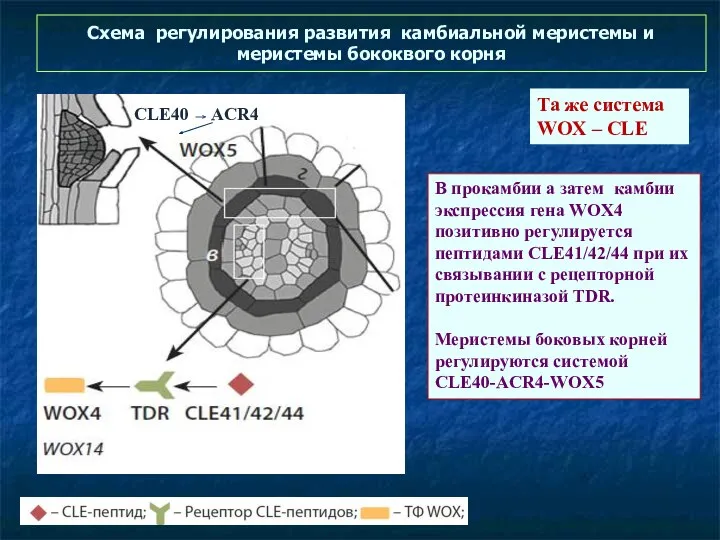
- 64. Схема регулирования развития камбиальной меристемы и меристемы бококвого корня В прокамбии а затем камбии экспрессия гена
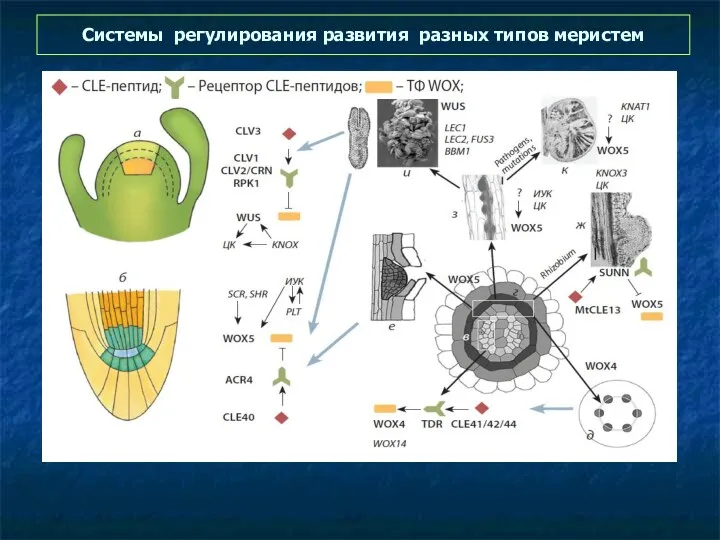
- 65. Системы регулирования развития разных типов меристем
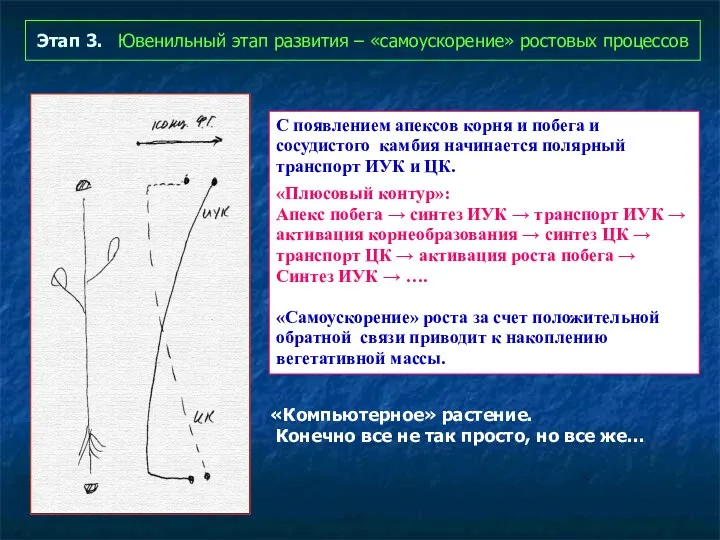
- 66. Этап 3. Ювенильный этап развития – «самоускорение» ростовых процессов С появлением апексов корня и побега и
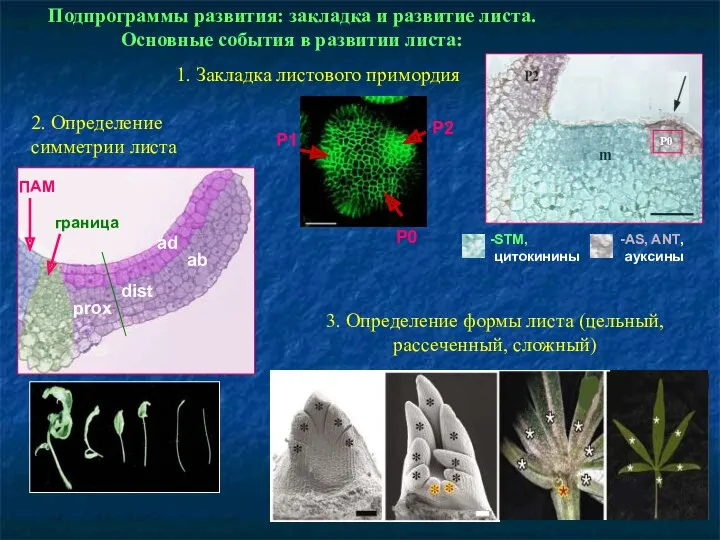
- 67. Подпрограммы развития: закладка и развитие листа. Основные события в развитии листа: 1. Закладка листового примордия 2.
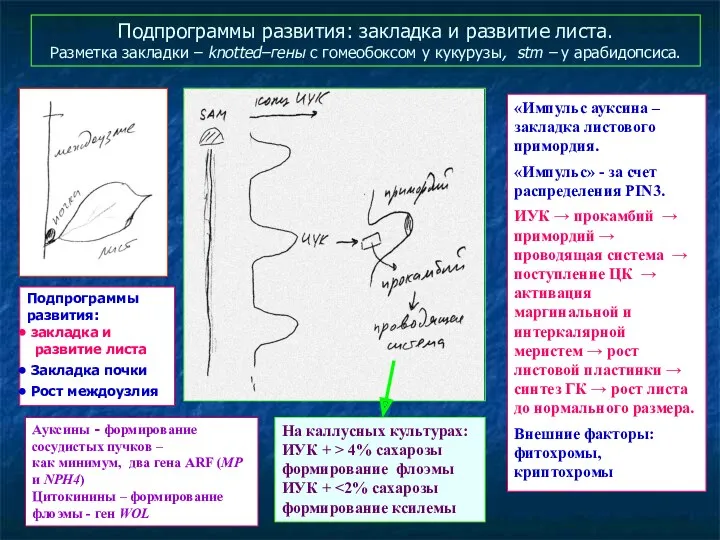
- 68. Подпрограммы развития: закладка и развитие листа. Разметка закладки – knotted–гены с гомеобоксом у кукурузы, stm –
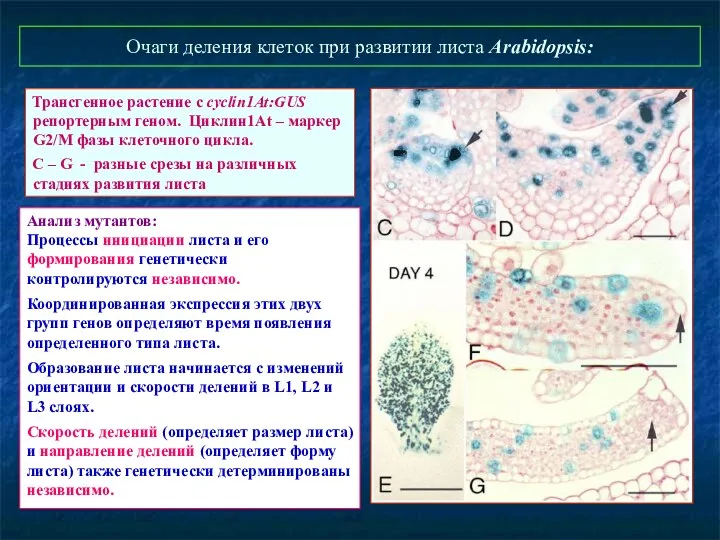
- 69. Очаги деления клеток при развитии листа Arabidopsis: Трансгенное растение с cyclin1At:GUS репортерным геном. Циклин1At – маркер
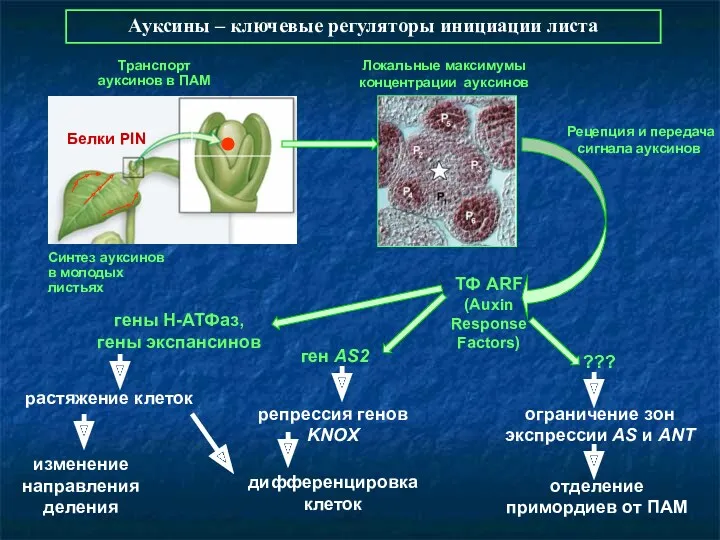
- 70. Ауксины – ключевые регуляторы инициации листа Белки PIN Синтез ауксинов в молодых листьях Транспорт ауксинов в
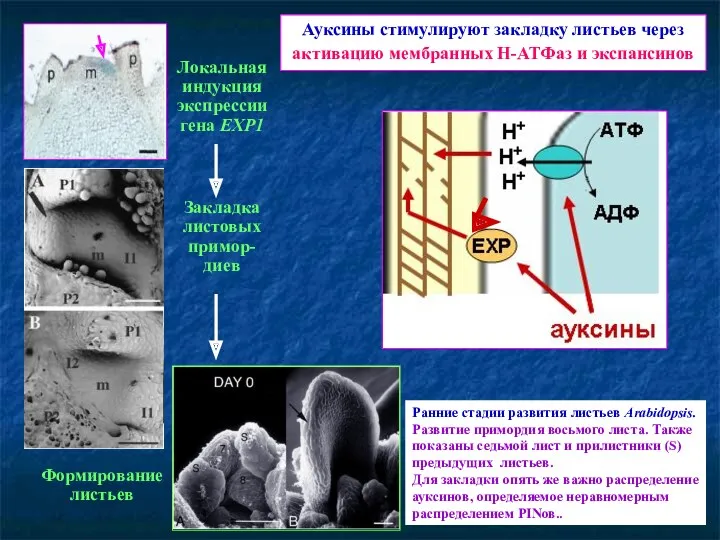
- 71. Ауксины стимулируют закладку листьев через активацию мембранных Н-АТФаз и экспансинов Локальная индукция экспрессии гена EXP1 Закладка
- 72. Гомеозисные гены Гомеозисные гены — гены, определяющие процессы роста и дифференцировки в организме. Кодируют транскрипционные факторы,
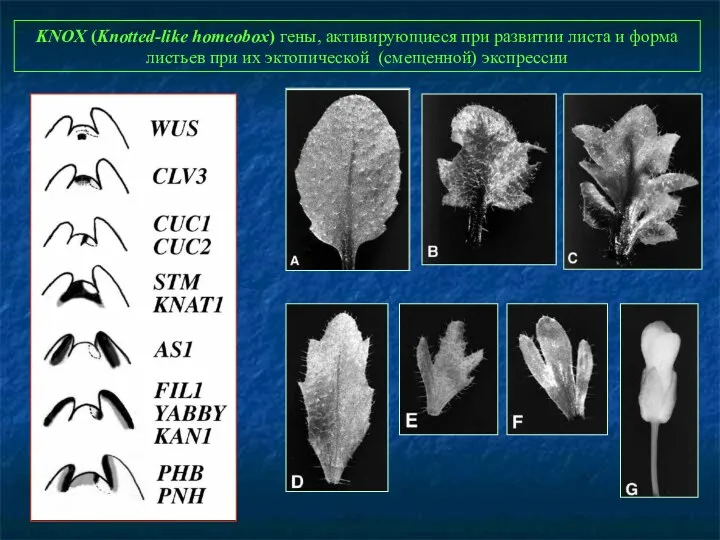
- 73. KNOX (Knotted-like homeobox) гены, активирующиеся при развитии листа и форма листьев при их эктопической (смещенной) экспрессии
- 74. Форма розеточных листьев у мутантов по KNOX - генам
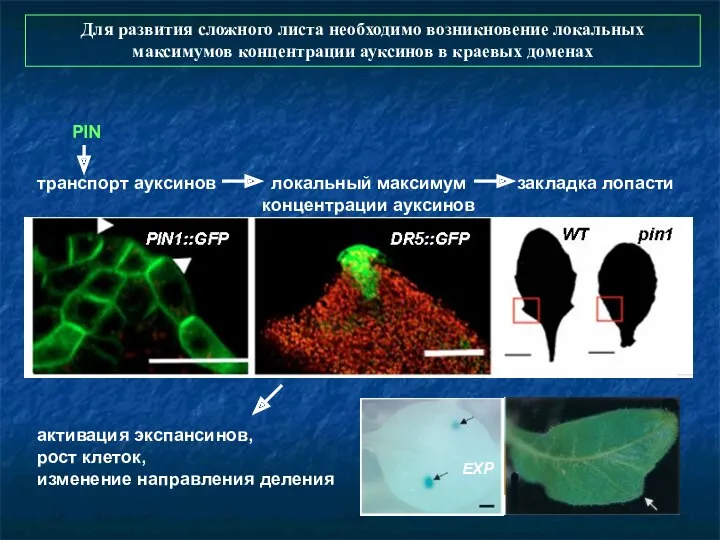
- 75. PIN транспорт ауксинов локальный максимум концентрации ауксинов закладка лопасти активация экспансинов, рост клеток, изменение направления деления
- 76. Подпрограммы развития: закладка пазушных почек и ветвление После образования листа (но никогда одновременно с листовым примордием!)
- 77. Подпрограммы развития: рост междоузлия Формирование листа → синтез ГК → транспорт в междоузлие → ГК активирует
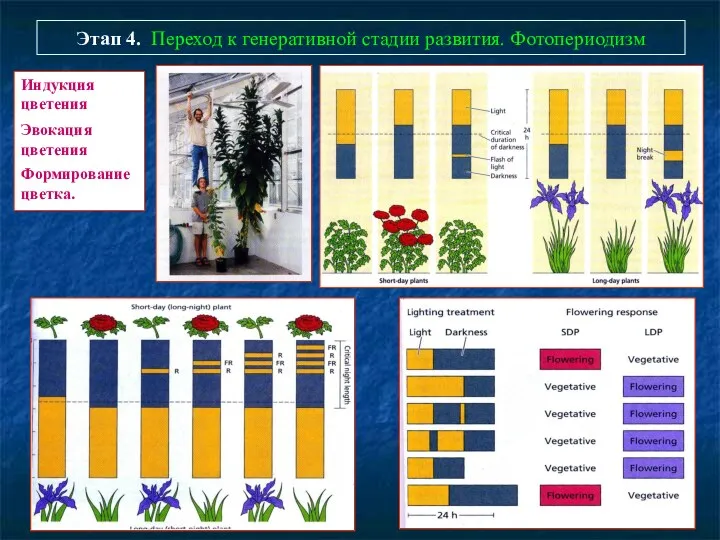
- 78. Этап 4. Переход к генеративной стадии развития. Фотопериодизм Индукция цветения Эвокация цветения Формирование цветка.
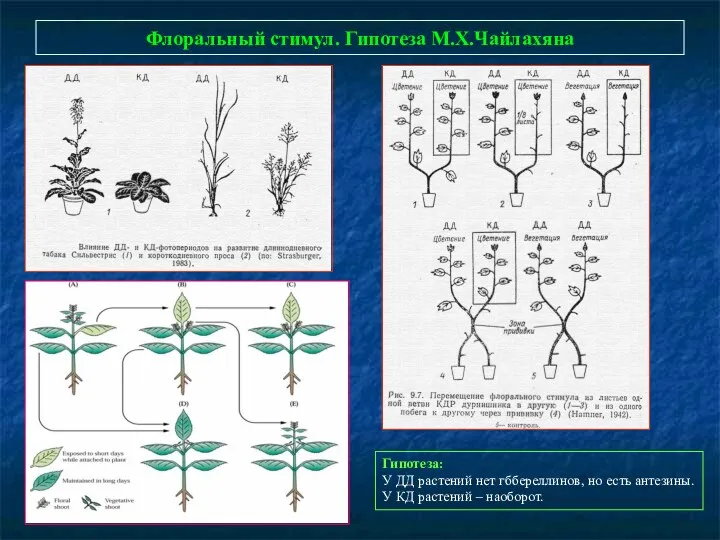
- 79. Флоральный стимул. Гипотеза М.Х.Чайлахяна Гипотеза: У ДД растений нет гббереллинов, но есть антезины. У КД растений
- 80. Регуляция индукции цветения. «Генетическая модель». GI – Gigantea. Кодирует большой белок неизвестной функции, локализованный в ядре.
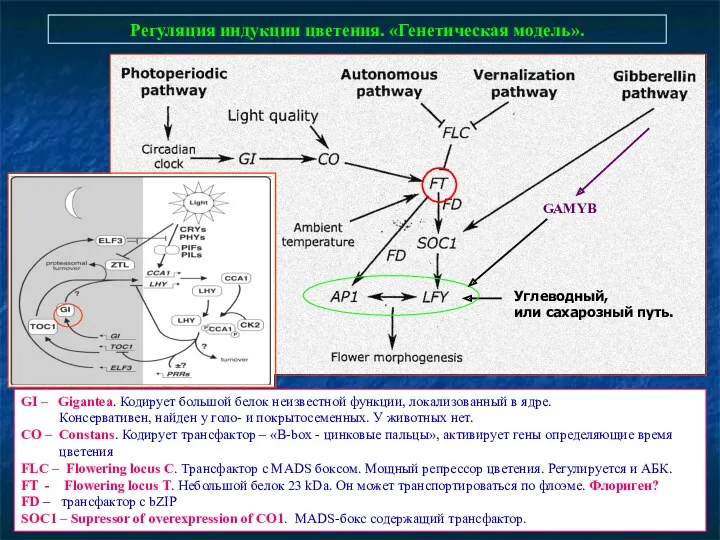
- 81. COP1 – специальная Е3-убиквитин лигаза. опосредует убиквитин-зависимую деградацию белка CO Как фоторецепторы могут влиять на индукцию
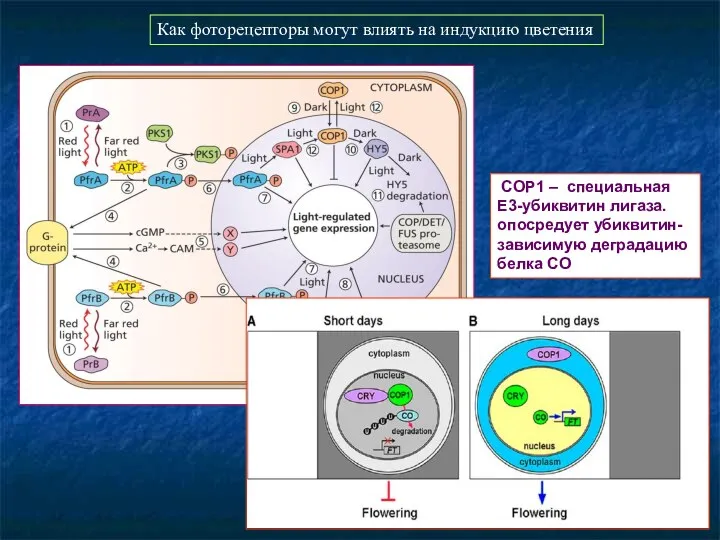
- 82. Общая схема регуляции цветения ДДР на длинном дне: фоторецепторы + часы - экспрессия СО-трансфактора в клетках-спутницах
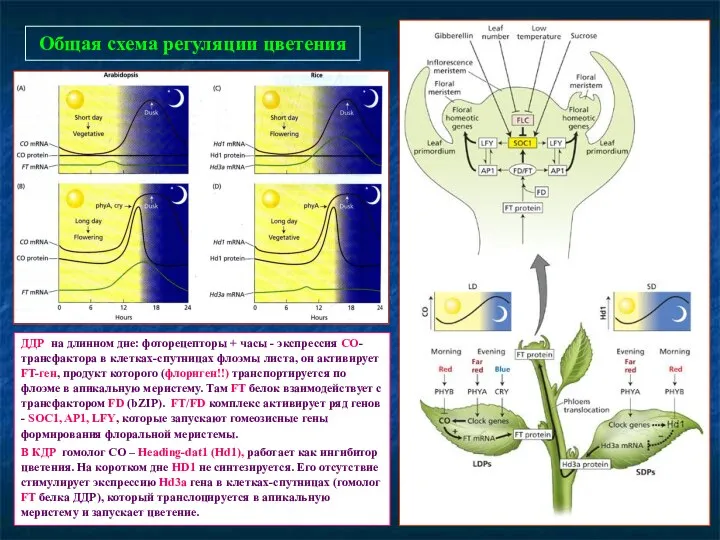
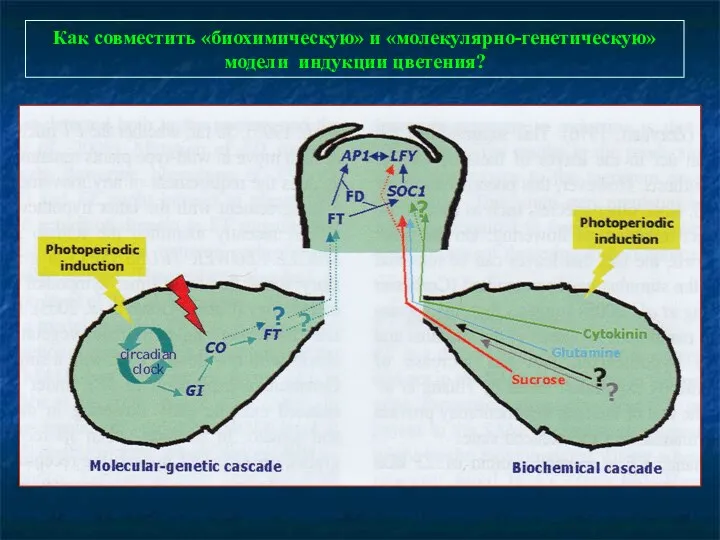
- 83. Как совместить «биохимическую» и «молекулярно-генетическую» модели индукции цветения?
- 84. Четыре пути регулирования цветения… Фотопериодический путь. Начинается в листьях. Участвуют фитохромы и криптохромы. Различно для ДДР
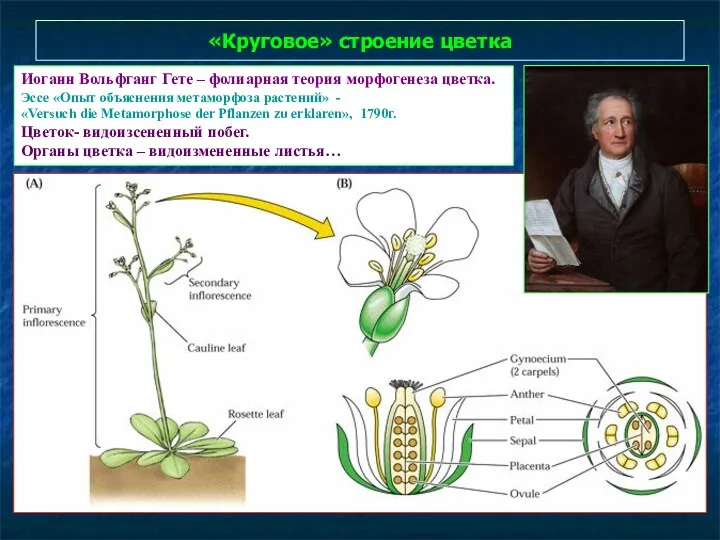
- 85. «Круговое» строение цветка Иоганн Вольфганг Гете – фолиарная теория морфогенеза цветка. Эссе «Опыт объяснения метаморфоза растений»
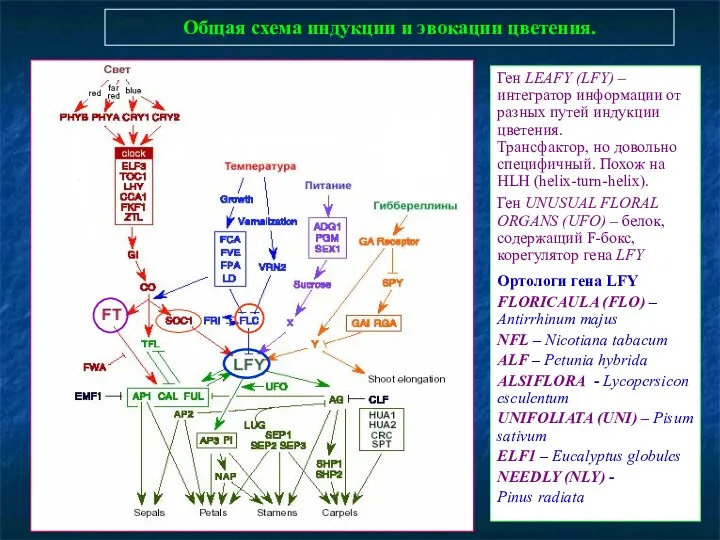
- 86. Общая схема индукции и эвокации цветения. Ген LEAFY (LFY) – интегратор информации от разных путей индукции
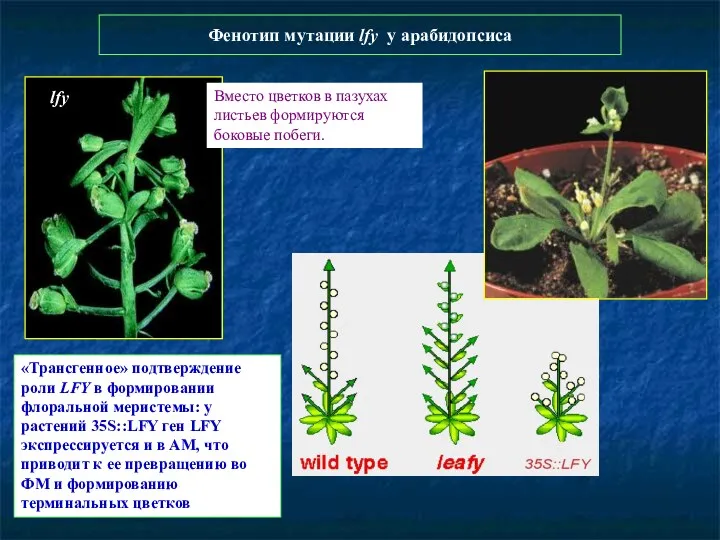
- 87. Фенотип мутации lfy у арабидопсиса lfy Вместо цветков в пазухах листьев формируются боковые побеги. «Трансгенное» подтверждение
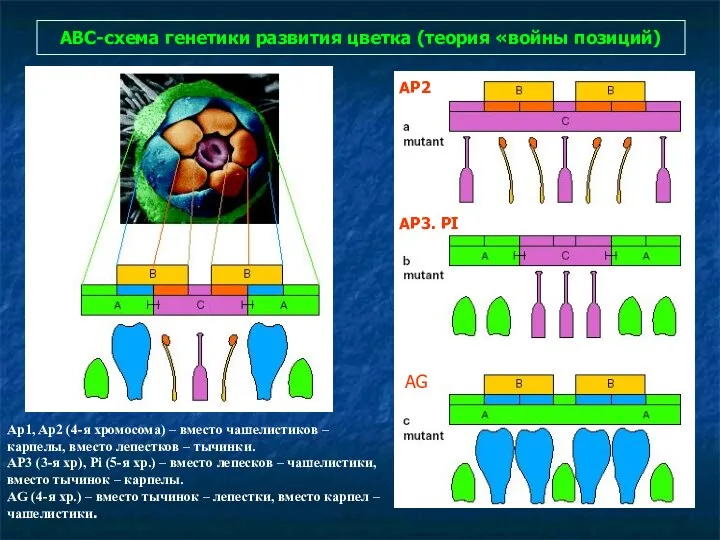
- 88. АВС-схема генетики развития цветка (теория «войны позиций) Ap1, Ap2 (4-я хромосома) – вместо чашелистиков – карпелы,
- 89. Мутанты арабидопсиса с точки зрения АВС-системы и гены. AP1, AP2 – функция А, трансфакторы, AP1 с
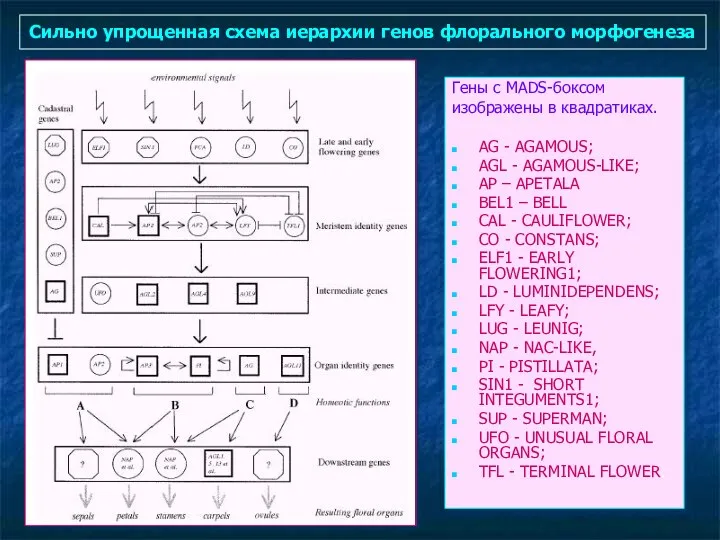
- 90. Сильно упрощенная схема иерархии генов флорального морфогенеза Гены с MADS-боксом изображены в квадратиках. AG - AGAMOUS;
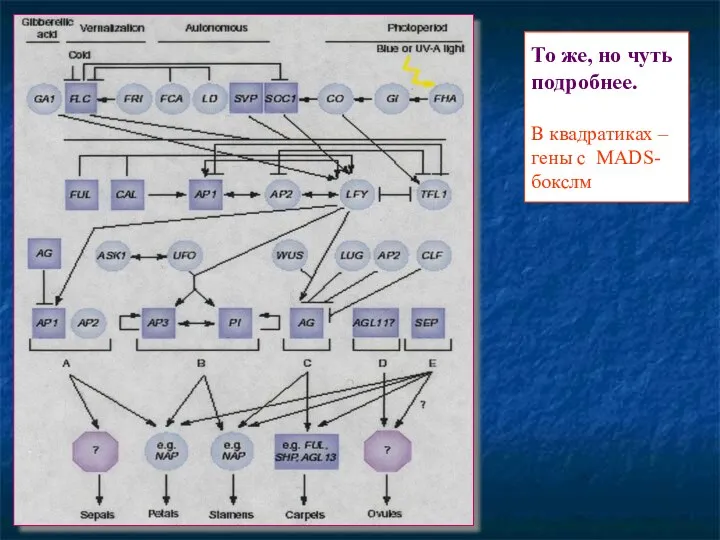
- 91. То же, но чуть подробнее. В квадратиках – гены с MADS-бокслм
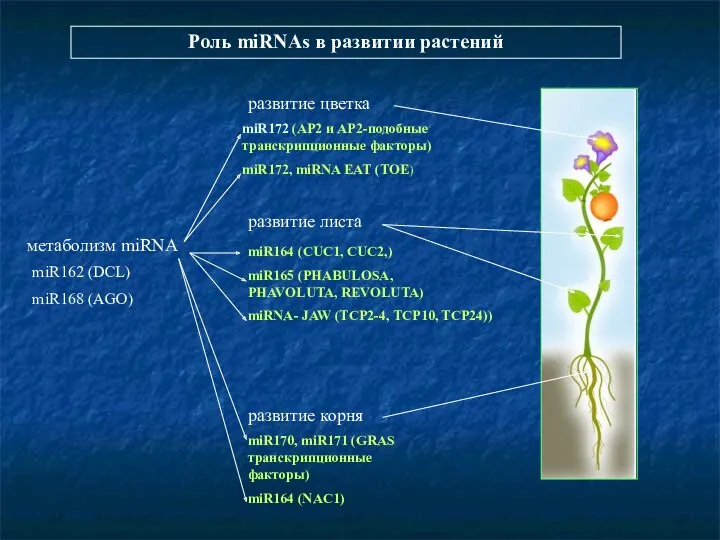
- 92. Роль miRNAs в развитии растений развитие цветка развитие листа развитие корня miR170, miR171 (GRAS транскрипционные факторы)
- 93. A. wt B. ap2-9 C. 35S::MIR172a-1 Фенотип трансгенных растений 35S::MIR172a-1 повторяет фенотипическое проявление мутации ap2-9 miR172
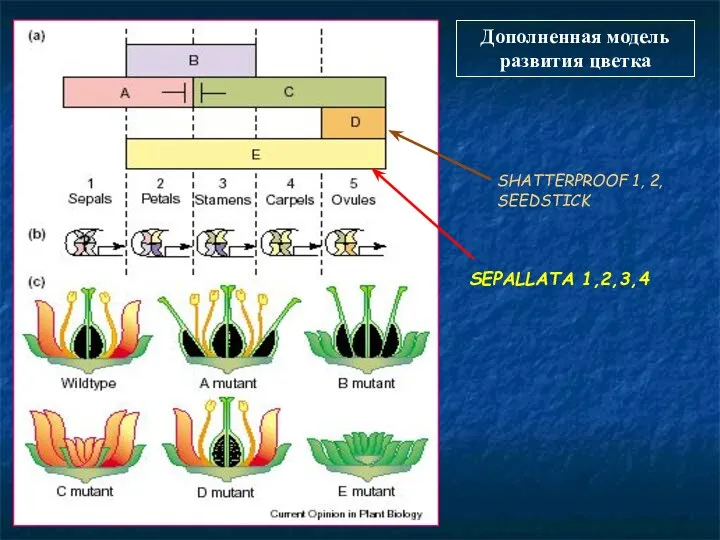
- 94. Дополненная модель развития цветка SHATTERPROOF 1, 2, SEEDSTICK SEPALLATA 1,2,3,4
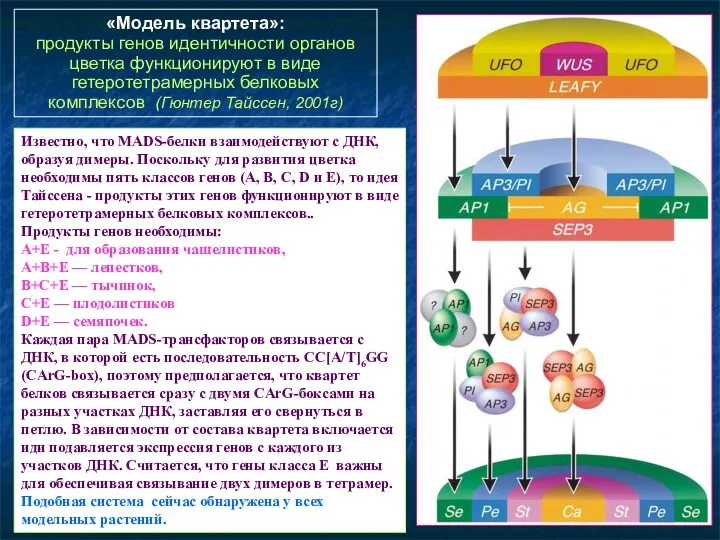
- 95. «Модель квартета»: продукты генов идентичности органов цветка функционируют в виде гетеротетрамерных белковых комплексов (Гюнтер Тайссен, 2001г)
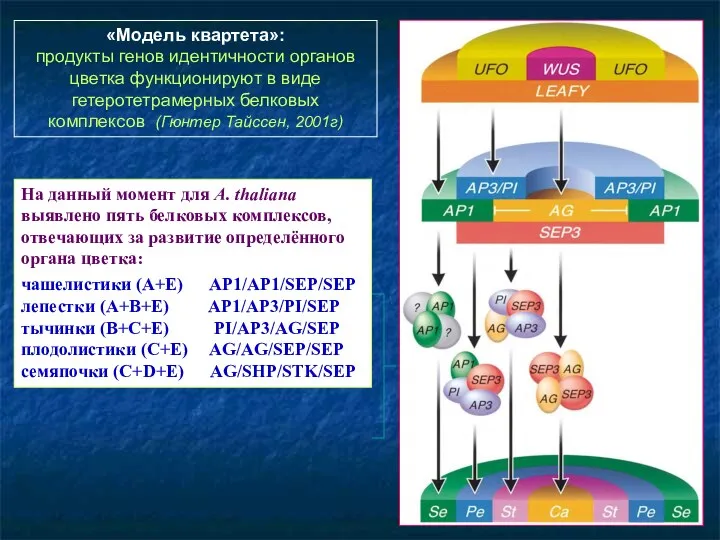
- 96. «Модель квартета»: продукты генов идентичности органов цветка функционируют в виде гетеротетрамерных белковых комплексов (Гюнтер Тайссен, 2001г)
- 97. Мутанты по структуре цветка сходны у разных растений
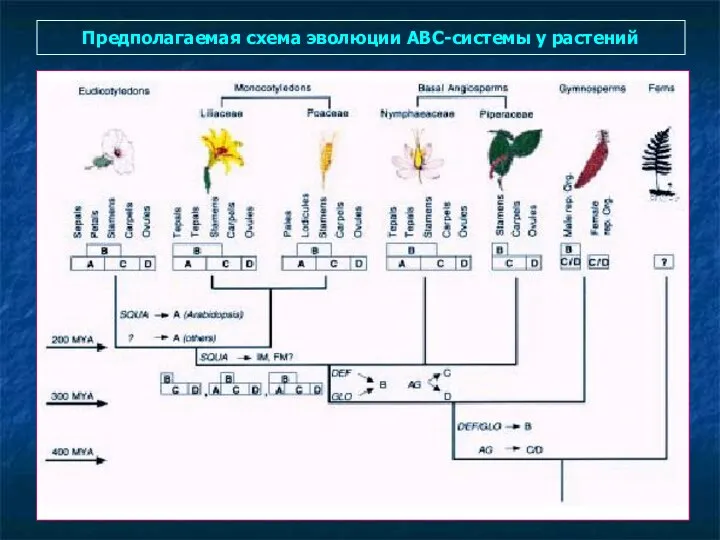
- 98. Предполагаемая схема эволюции АВС-системы у растений
- 99. Детерминация пола у растений Определение (детерминация) пола у растений - формирование признаков пола у клеток, органов
- 100. Аллосомы или sex-хромосомы - хромосомы отличающиеся по морфологии и количеству в мужской и женской особи и
- 101. Хромосомное определение пола у растений Большинство видов растений, у которых определение пола определяется хромосомами, могут быть
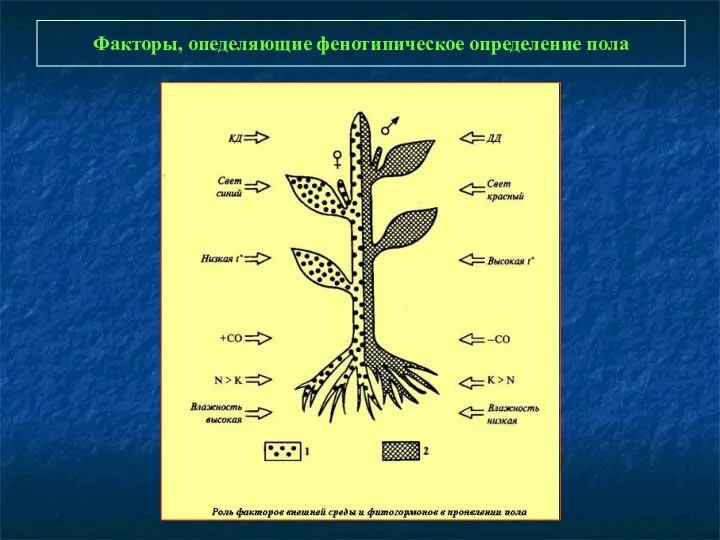
- 102. Факторы, опеделяющие фенотипическое определение пола
- 106. Скачать презентацию






















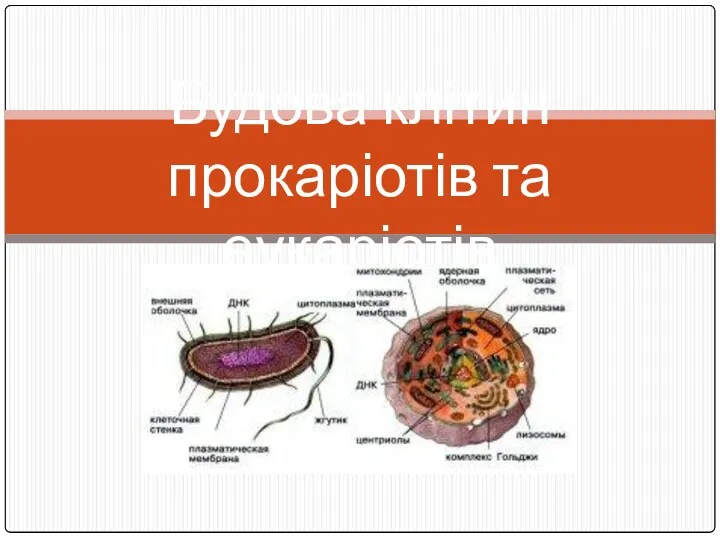 Будова клітин прокаріотів та еукаріотів
Будова клітин прокаріотів та еукаріотів Наследственность и патология
Наследственность и патология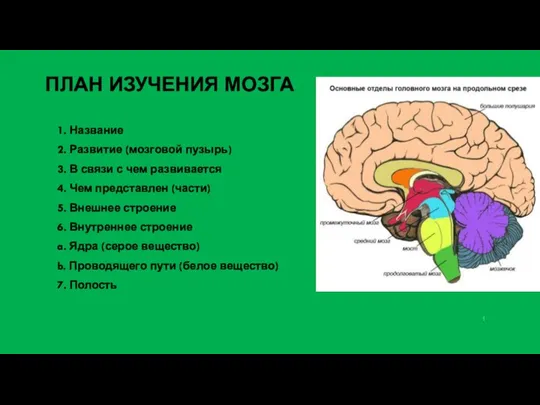 Развитие (мозговой пузырь)
Развитие (мозговой пузырь) Многолетние декоративные травянистые растения
Многолетние декоративные травянистые растения Организменная среда обитания. 5 класс
Организменная среда обитания. 5 класс Половое размножение животных
Половое размножение животных Витамины. Классификация витаминов
Витамины. Классификация витаминов Транскрипция у эукариот
Транскрипция у эукариот Пищеварительная система. Ротовая полость
Пищеварительная система. Ротовая полость Tissues: group of cells that are similar in structure and function
Tissues: group of cells that are similar in structure and function Общая вирусология
Общая вирусология Биотехнология, ее направления
Биотехнология, ее направления Индустрия ферментов
Индустрия ферментов Значение растений в природе и жизни человека
Значение растений в природе и жизни человека Строение и работа сердца. Круги кровообращения
Строение и работа сердца. Круги кровообращения Мутации: закономерность или парадокс?
Мутации: закономерность или парадокс? Онтогенез и филогенез нервной системы
Онтогенез и филогенез нервной системы Внешнее строение рыб
Внешнее строение рыб Презентация к уроку Насекомые
Презентация к уроку Насекомые Высшая нервная деятельность человека. 8 класс
Высшая нервная деятельность человека. 8 класс Растительные сообщества
Растительные сообщества Синквейн Жизнь
Синквейн Жизнь Кожа. Анатомия кожи. Функции кожи
Кожа. Анатомия кожи. Функции кожи Семейства Розоцветные и Паслёновые
Семейства Розоцветные и Паслёновые Проект. Использование современных технологий в обучении биологии школьников
Проект. Использование современных технологий в обучении биологии школьников Экологические группы растений
Экологические группы растений Хижі птахи
Хижі птахи Физиология продолговатого мозга и моста
Физиология продолговатого мозга и моста