Содержание
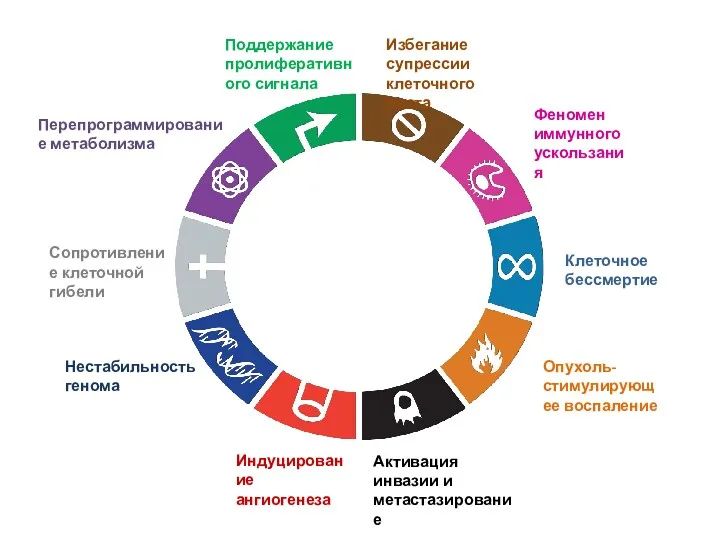
- 2. Поддержание пролиферативного сигнала Избегание супрессии клеточного роста Сопротивление клеточной гибели Клеточное бессмертие Индуцирование ангиогенеза Активация инвазии
- 3. Геномная нестабильность В результате воздействия: Экзогенных факторов (ии, инсоляция, бензол, радон, нитрозамины, ВПЧ 16 типа). Эндогенных
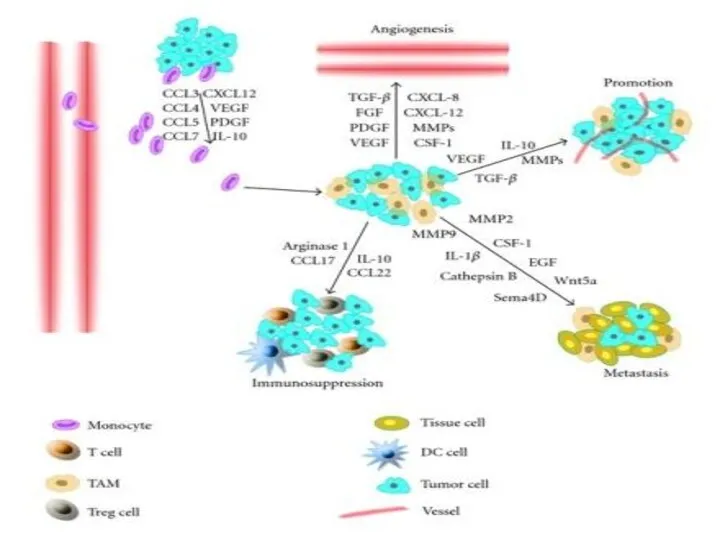
- 6. Стимулирующее опухоль воспаление Хроническое воспаление (бактериальное, аутоиммунное, паразитарное) может обусловливать появление канцерогенных мутаций в клеточном геноме.
- 8. Иммунное ускользание Большая часть микроскопических опухолей уничтожаются иммунной системой (CD8+ T-киллеры; NK-клетки) Теория иммунного контроля -
- 9. Поддержание пролиферативного сигнала Фундаментальный признак опухолевого роста.
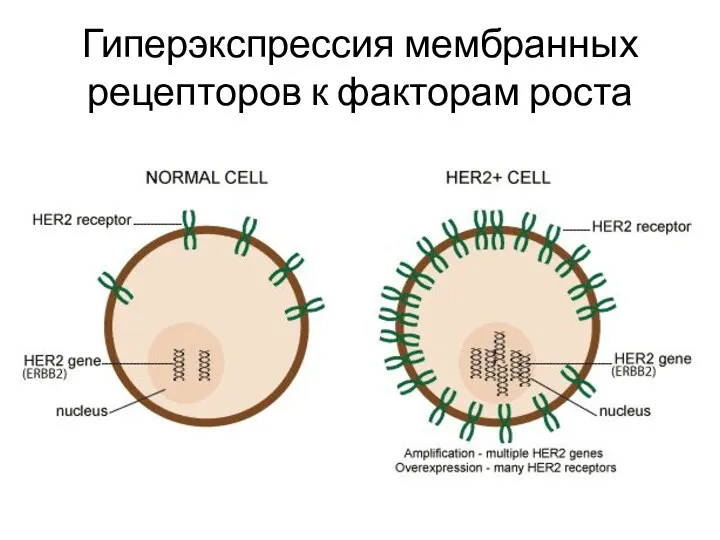
- 10. Механизмы поддержания пролиферативного сигнала Аутокринная стимуляция Паракринная стимуляция опухоль-ассоциированной стромы Гиперэкспрессия мембранных рецепторов к факторам роста
- 11. Гиперэкспрессия мембранных рецепторов к факторам роста
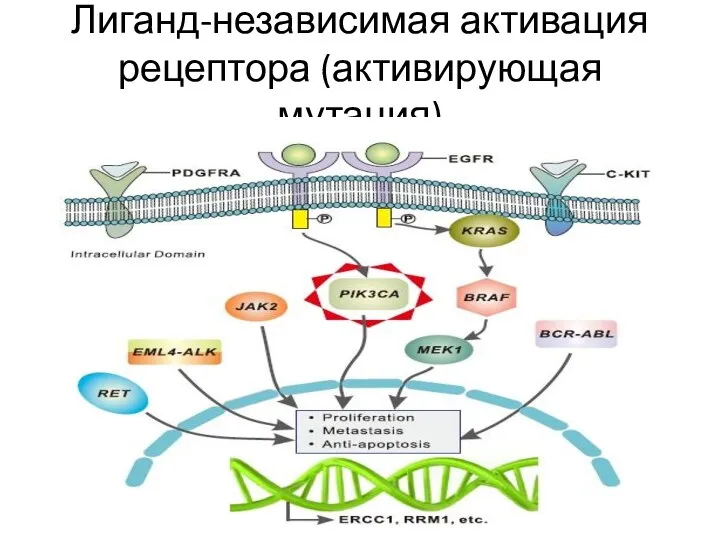
- 12. Механизмы поддержания пролиферативного сигнала Аутокринная стимуляция Паракринная стимуляция опухоль-ассоциированной стромы Гиперэкспрессия мембранных рецепторов к факторам роста
- 13. Лиганд-независимая активация рецептора (активирующая мутация)
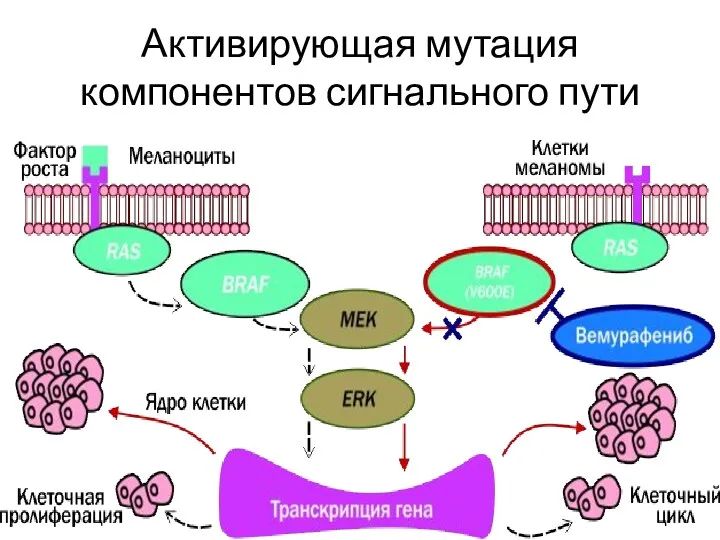
- 14. Механизмы поддержания пролиферативного сигнала Аутокринная стимуляция Паракринная стимуляция опухоль-ассоциированной стромы Гиперэкспрессия мембранных рецепторов к факторам роста
- 15. Активирующая мутация компонентов сигнального пути
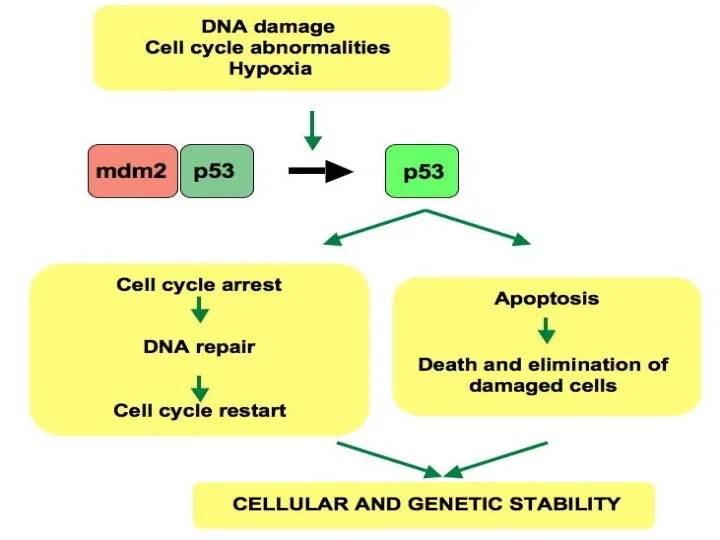
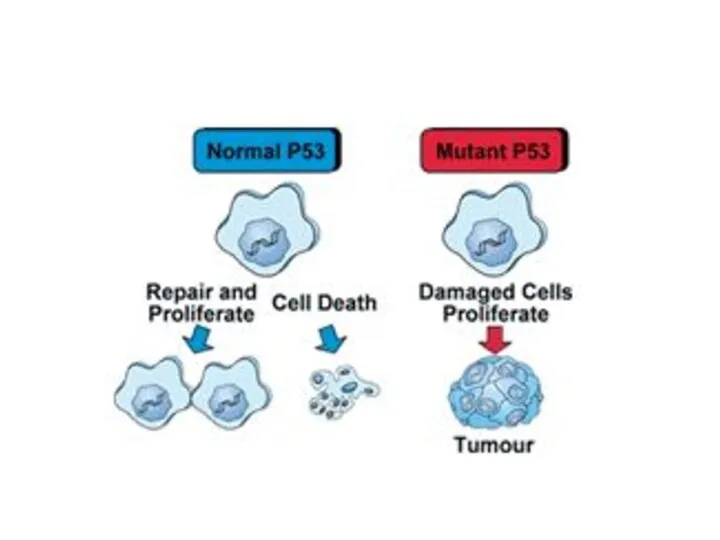
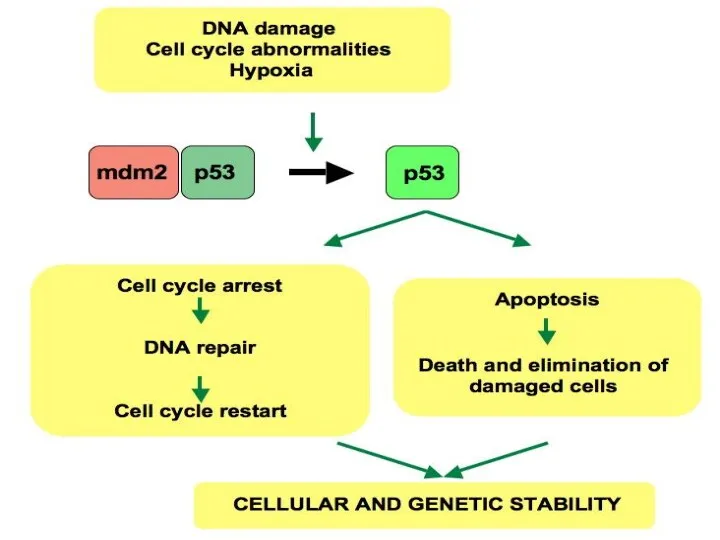
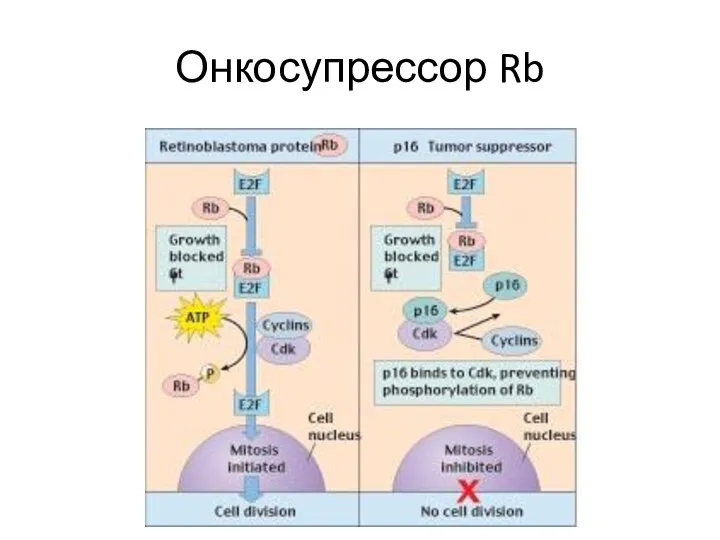
- 16. Избегание супрессоров клеточного роста Действие «каноничных» онкосупрессоров (TP53, RB1) Действие TGF-b (в микроскопических опухолях – антипролиферативное)
- 18. Онкосупрессор Rb
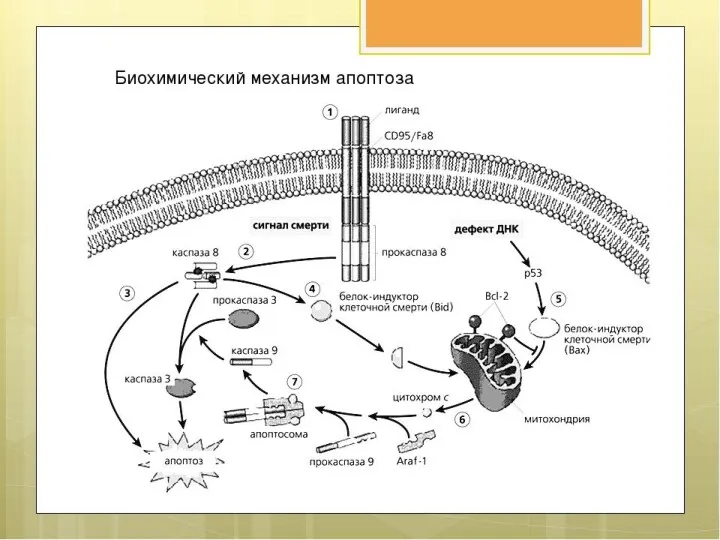
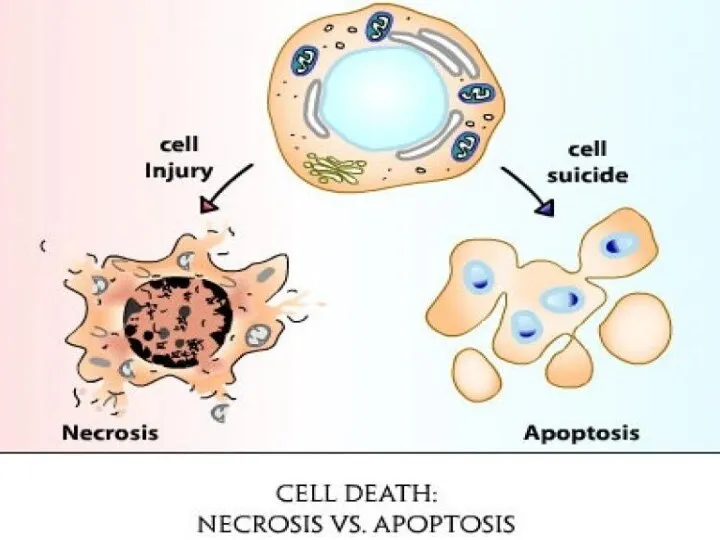
- 19. Сопротивление клеточной гибели Апоптоз – барьер для развития рака. Должен происходить в опухолевых клетках, потому что:
- 21. Но не происходит Потому что: Теряется функция TP53 Опухолевое микроокружение вырабатывает много ИЛ-3, PgE2 Теряется функция
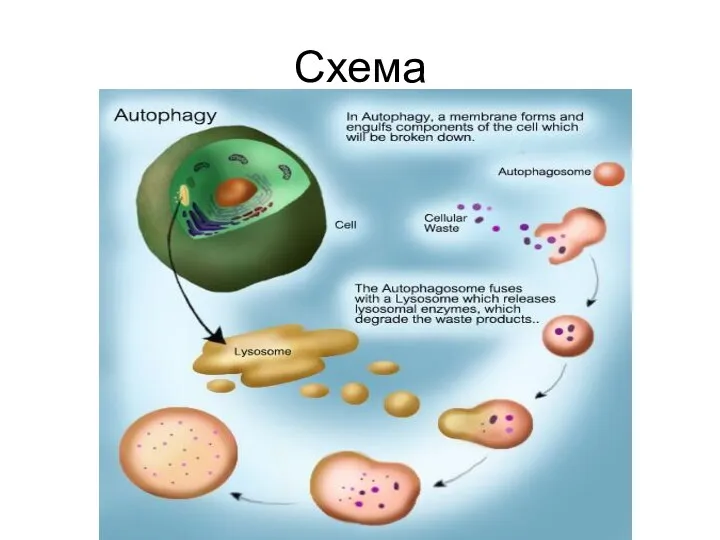
- 22. Аутофагия Также форма клеточной смерти. Разрушаются органеллы клетки, чтобы получившиеся катаболиты были использованы клеткой для нужд
- 23. Схема
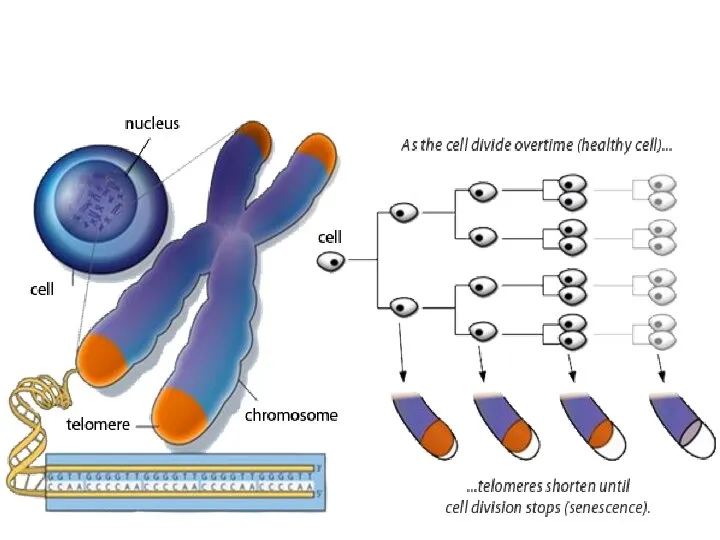
- 25. Обретение клеточного бессмертия Или феномен «иммортализации». Нормальные клеточные линии организма могут пройти лишь через ограниченное число
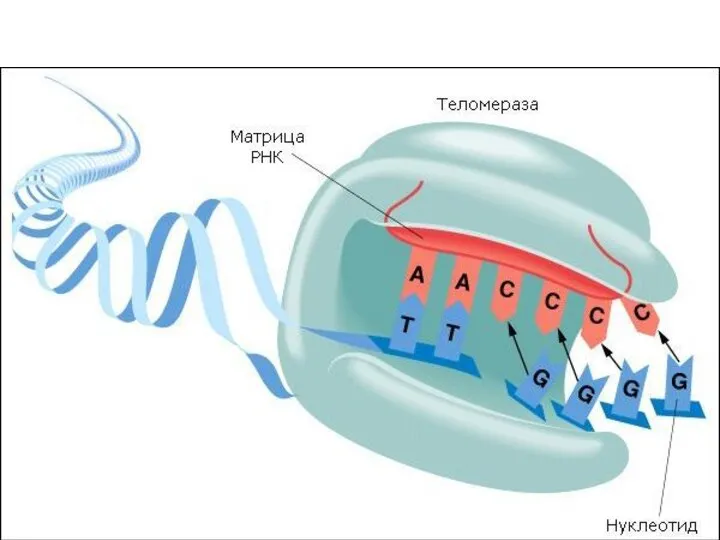
- 28. Иммортализация Таким образом, теломераза «достраивает» отделенные фрагменты теломер в ходе деления, предохраняя клетку от перехода в
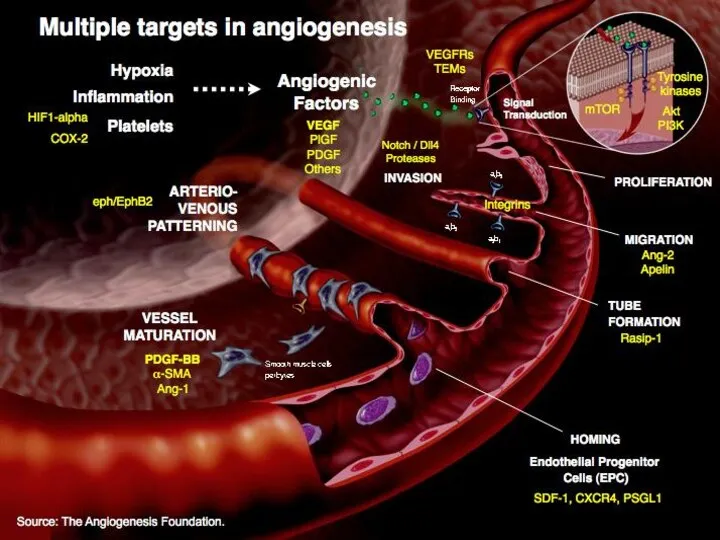
- 29. Индуцирование ангиогенеза В опухолевой ткани формируется новообразованная сосудистая сеть. Ангиогенез регулируется рядом факторов: VEGF, FGF –
- 31. Характеристики сосудистой сети опухоли Кровеносные сосуды в опухолях аномальны: Они запутанны, чрезмерно ветвятся, искривлены Увеличены Поток
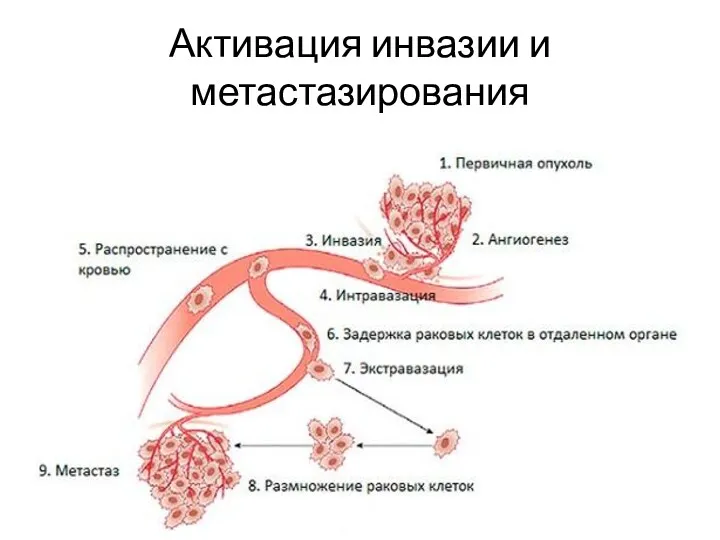
- 32. Активация инвазии и метастазирования
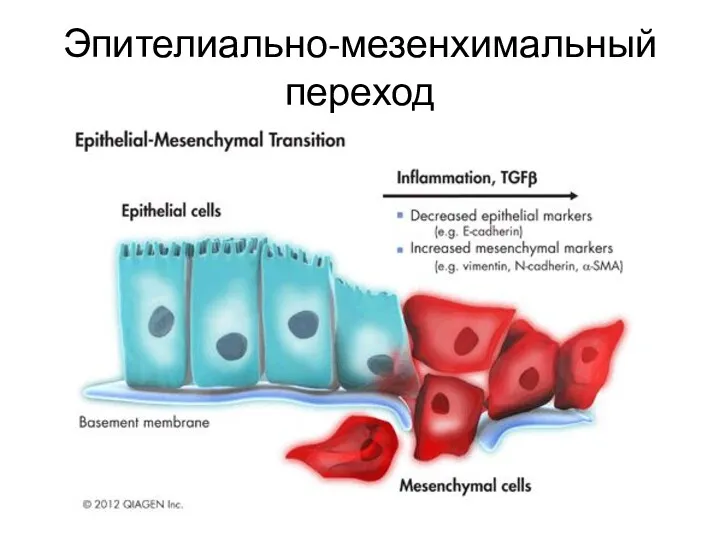
- 33. Эпителиально-мезенхимальный переход Приобретение опухолевой клеткой эпителия свойств фибробласта. ЭМП – запрограммированный процесс (SNAIL, SLUG, TWIST). ЭМП
- 34. Эпителиально-мезенхимальный переход
- 35. Энергетическое перепрограммирование Длительная гиперпролиферация также включает в себя корректировки в энергометаболизме, с ориентировкой на то, чтобы
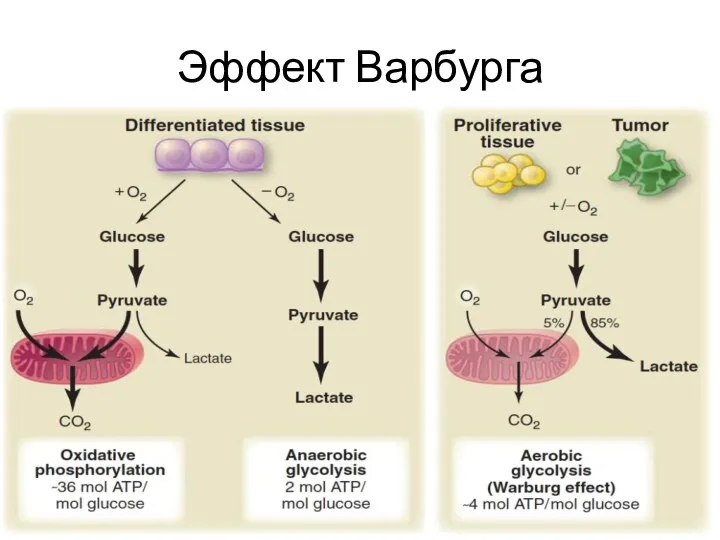
- 36. Эффект Варбурга
- 37. Эффект Варбурга Опухолевые клетки возмещают недостаток энергии, получаемой через аэробный гликолиз, за счет гиперэкспрессии GLUT1. А
- 39. Скачать презентацию


















 Пигментация волос
Пигментация волос Новогодняя викторина Сохраним леса России. Хвойная викторина
Новогодняя викторина Сохраним леса России. Хвойная викторина Строение сердечно-сосудистой системы. Топография и строение сердца
Строение сердечно-сосудистой системы. Топография и строение сердца Пути передачи сигнала. Мембранные рецепторы
Пути передачи сигнала. Мембранные рецепторы Стресс и его регуляция у растений. Механизмы оксидативного стресса
Стресс и его регуляция у растений. Механизмы оксидативного стресса Характеристика и состав микробиоты активного ила и биопленки
Характеристика и состав микробиоты активного ила и биопленки Wild and Domestic Animals
Wild and Domestic Animals Улытауский и Кызыларайский заказники
Улытауский и Кызыларайский заказники Анамнії та амніоти
Анамнії та амніоти Пищеварение в желудке и кишечнике
Пищеварение в желудке и кишечнике Для чего нам нужны домашние животные
Для чего нам нужны домашние животные Витамины
Витамины Влияние факторов внешней среды на онтогенез
Влияние факторов внешней среды на онтогенез Введение в курс физиологии. Возбудимые ткани. Биопотенциалы
Введение в курс физиологии. Возбудимые ткани. Биопотенциалы Докази еволюції
Докази еволюції Роль гормонов в обмене веществ, росте и развитии организма
Роль гормонов в обмене веществ, росте и развитии организма Знаете ли вы грибы?
Знаете ли вы грибы? Classification of plants
Classification of plants Комнатные растения в интерьере
Комнатные растения в интерьере Онтогенез нервной системы человека
Онтогенез нервной системы человека Особенности высшей нервной деятельности человека. Познавательные процессы
Особенности высшей нервной деятельности человека. Познавательные процессы Презентация к уроку биологии на тему Положение человека в системе органического мира. 11 класс
Презентация к уроку биологии на тему Положение человека в системе органического мира. 11 класс Углеводы. Классификация углеводов. Глюкоза
Углеводы. Классификация углеводов. Глюкоза Химический состав клетки. Органические и неорганические вещества. Урок №1
Химический состав клетки. Органические и неорганические вещества. Урок №1 Земноводные. Внешнее строение. Образ жизни. Многообразие
Земноводные. Внешнее строение. Образ жизни. Многообразие Слуховая сенсорная система
Слуховая сенсорная система ATP – Structure & Function/ Anaerobic and Aerobic Respiration Mitochondria Structure and Function
ATP – Structure & Function/ Anaerobic and Aerobic Respiration Mitochondria Structure and Function Animal Reproduction
Animal Reproduction