Содержание
- 2. Є у всіх органах (50 % від маси тіла). Шкіра Підшкірна жирова тканина Кістки Зуби Фасції
- 3. Сполучна тканина виконує такі функції: 1. Біомеханічна (опорна) функція 2.Метаболічна функція 3.Захисна (бар’єрна) функція 4.Структуроутворююча функція.
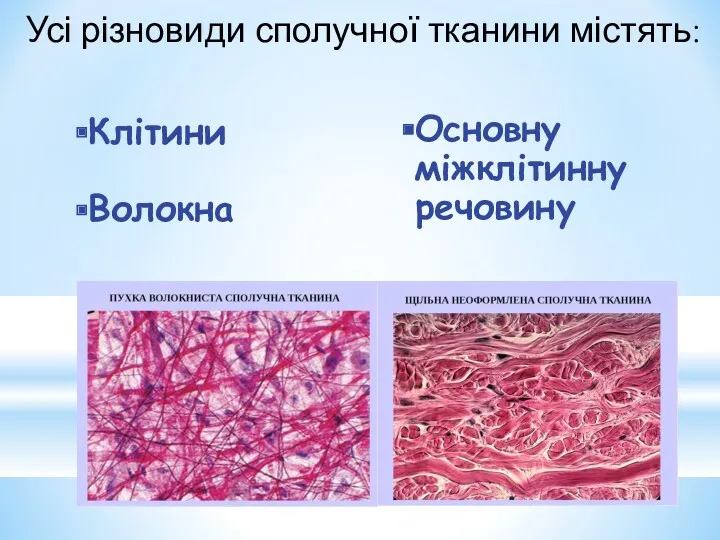
- 4. Усі різновиди сполучної тканини містять: Основну міжклітинну речовину Клітини Волокна
- 5. Волокна: Колаген Еластин Основна міжклітинна речовина: Вуглеводно-білкові комплекси – протеоглікани. Вуглеводні компоненти протеогліканів –гетерополісахариди глікозаміноглікани (мукополісахариди)
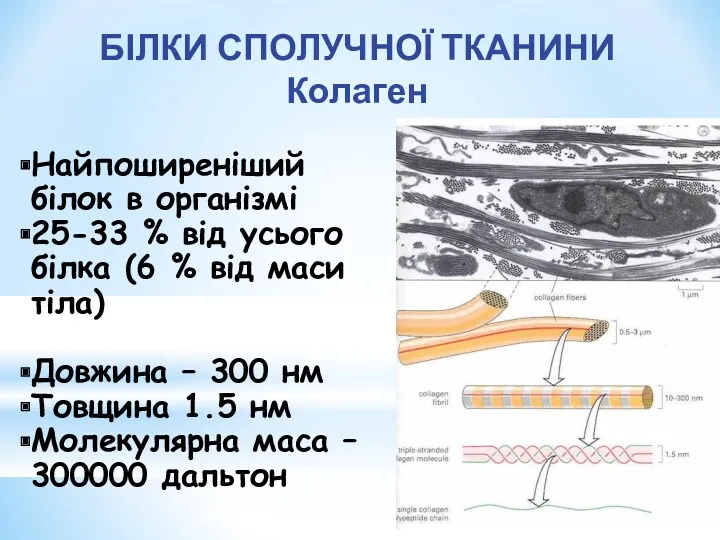
- 6. БІЛКИ СПОЛУЧНОЇ ТКАНИНИ Колаген Найпоширеніший білок в організмі 25-33 % від усього білка (6 % від
- 7. Побудований з 3 поліпептидних ланцюгів, що мають форму лівозакрученої спіралі Три лівоспіральних ланцюги разом закручуються у
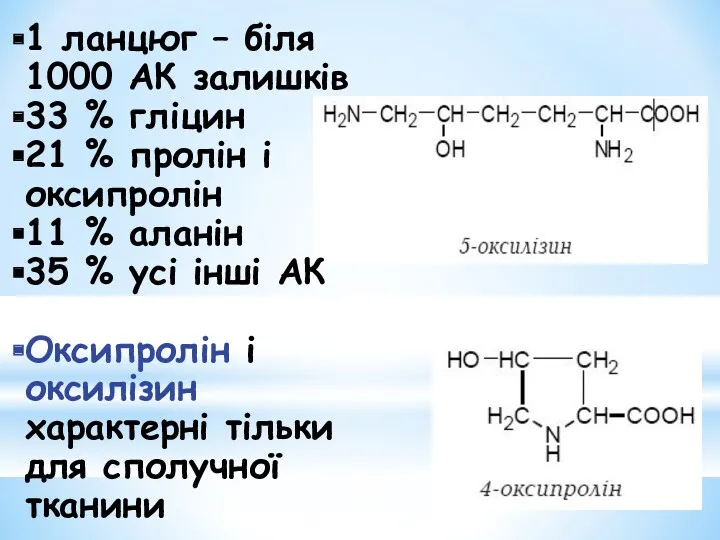
- 8. 1 ланцюг – біля 1000 АК залишків 33 % гліцин 21 % пролін і оксипролін 11
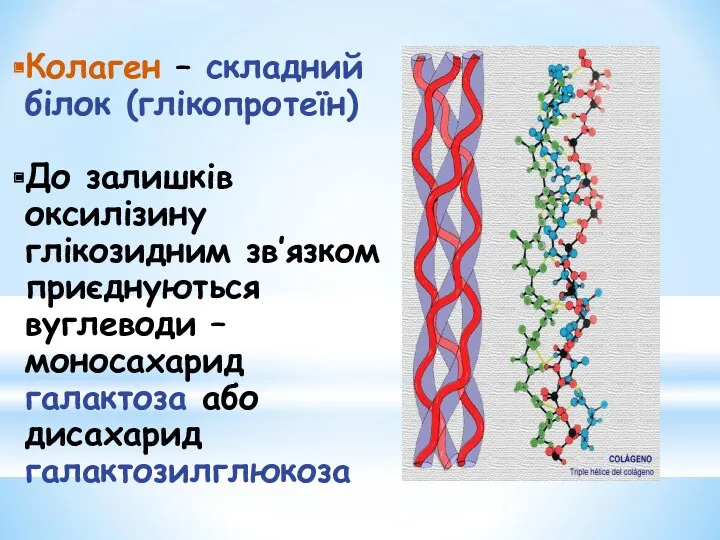
- 9. Колаген – складний білок (глікопротеїн) До залишків оксилізину глікозидним зв’язком приєднуються вуглеводи – моносахарид галактоза або
- 10. Унікальність будови колагену обумовлена амінокислотним складом : з яких 33 % становить гліцин, близько 21 %
- 11. Міцність трьохспіральної структури обумолена водневими зв”язками між пептидними групами СО – NH. Ланцюги стабілізуються водневими зв’язками
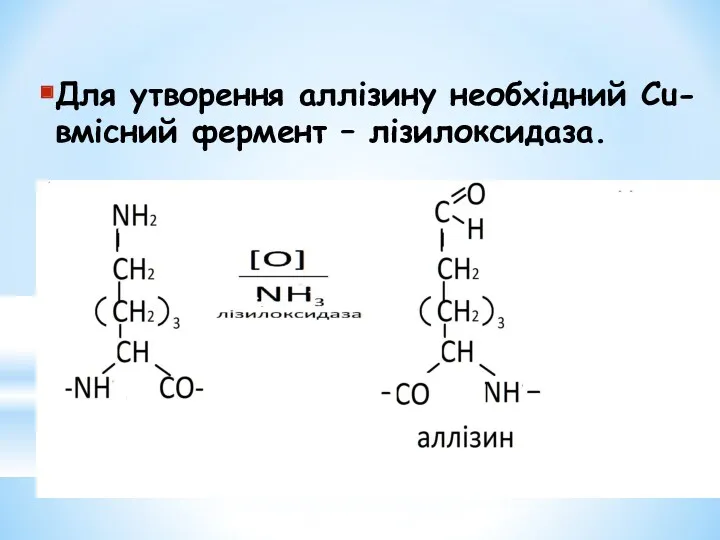
- 12. Для утворення аллізину необхідний Сu-вмісний фермент – лізилоксидаза.
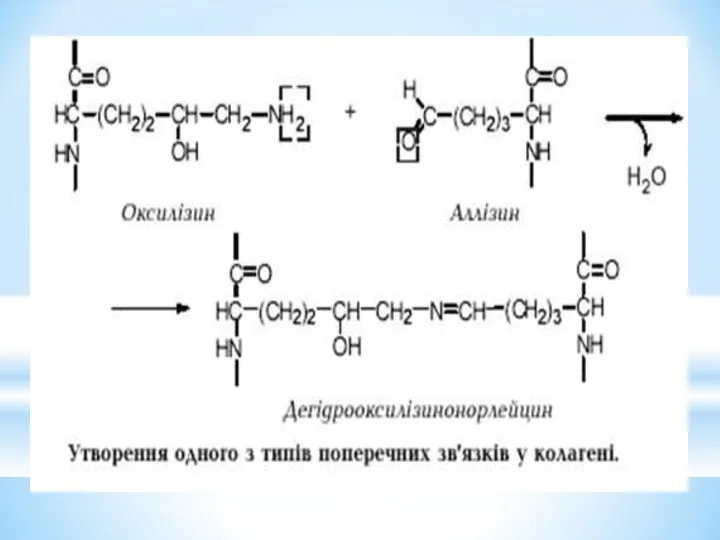
- 13. Поперечні ковалентні зшивки в молекулі колагену утворюються при взаємодії оксилізину одного ланцюга з аллізином другого. Міцність
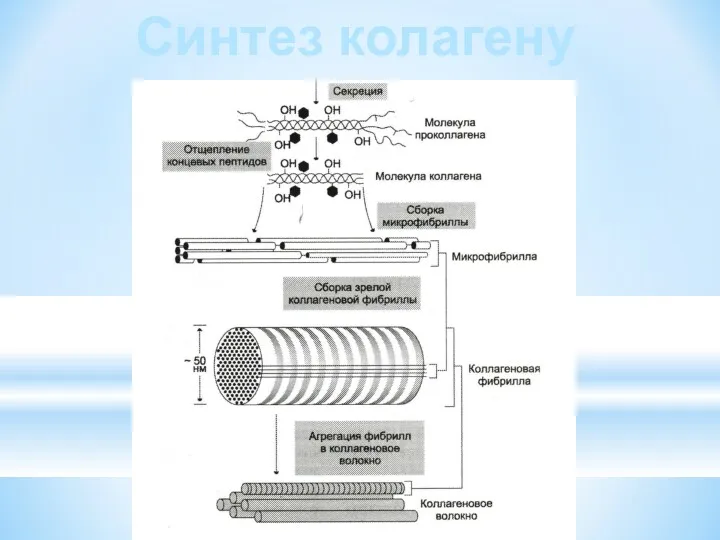
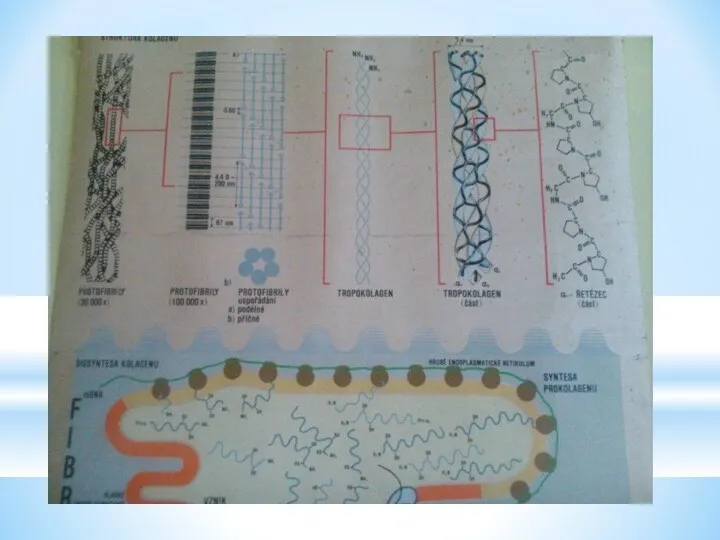
- 15. Стержневидні молекули тропоколагену укладаються в мікрофібрили. Мікрофібрили формують фібрили, з яких утворюються волокна та пучки волокон
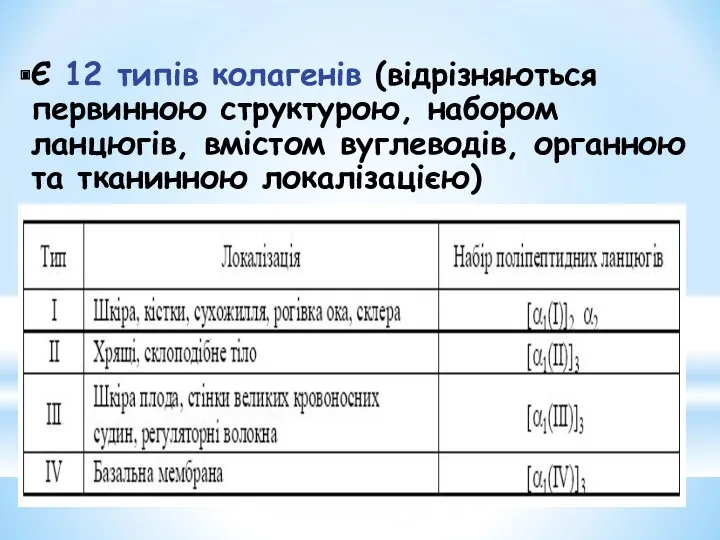
- 16. Є 12 типів колагенів (відрізняються первинною структурою, набором ланцюгів, вмістом вуглеводів, органною та тканинною локалізацією)
- 17. При рідкісній спадковій хворобі (синдром Елерса-Данлоса, тип V) внаслідок відсутності чи зниженої активності лізилоксидази в колагенових
- 18. При кип'ятінні у воді нерозчинних колагенових волокон отримують розчин желатин. Деякі ковалентні зв'язки колагену гідролізуються, в
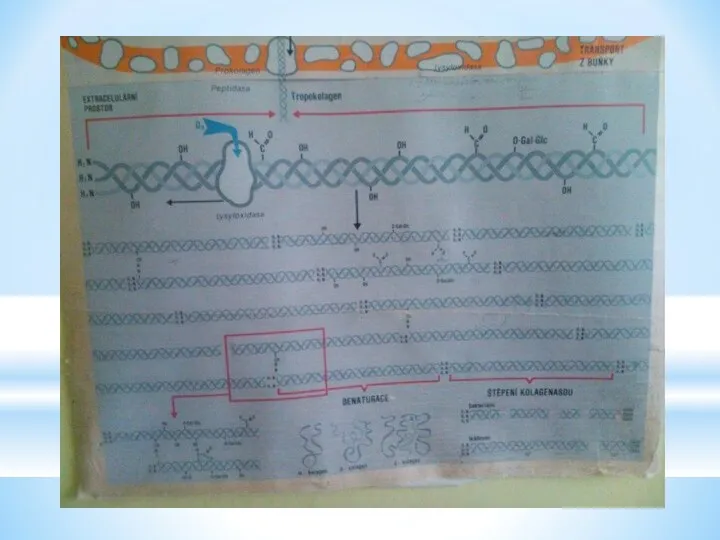
- 19. Синтез колагену
- 22. Інтенсивний синтез колагену має місце під час загоювання ран. Швидкість загоювання гальмується при недостатності в організмі
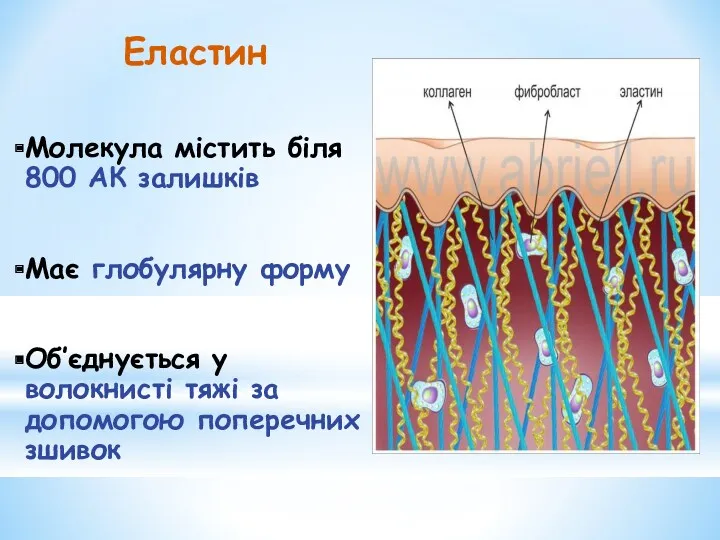
- 23. Еластин Молекула містить біля 800 АК залишків Має глобулярну форму Об’єднується у волокнисті тяжі за допомогою
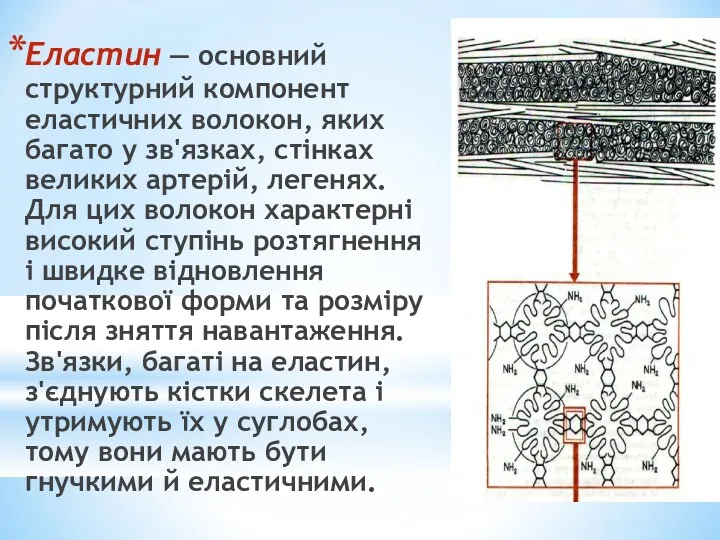
- 24. Еластин — основний структурний компонент еластичних волокон, яких багато у зв'язках, стінках великих артерій, легенях. Для
- 25. Містить багато гліцину, аланіну, проліну, валіну Оксилізин і цистеїн відсутні Залишки лізину утворюють поперечні ковалентні зв’язки
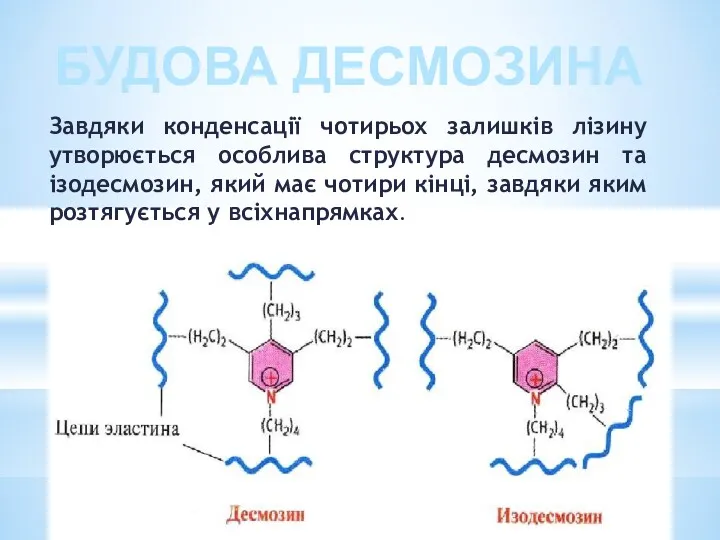
- 26. Завдяки конденсації чотирьох залишків лізину утворюється особлива структура десмозин та ізодесмозин, який має чотири кінці, завдяки
- 27. ПРОТЕОГЛІКАНИ Протеоглікани – основна міжклітинна речовина сполучної тканини. Високо молекулярні білково-вуглеводні комплекси.Займають 30 % від сухої
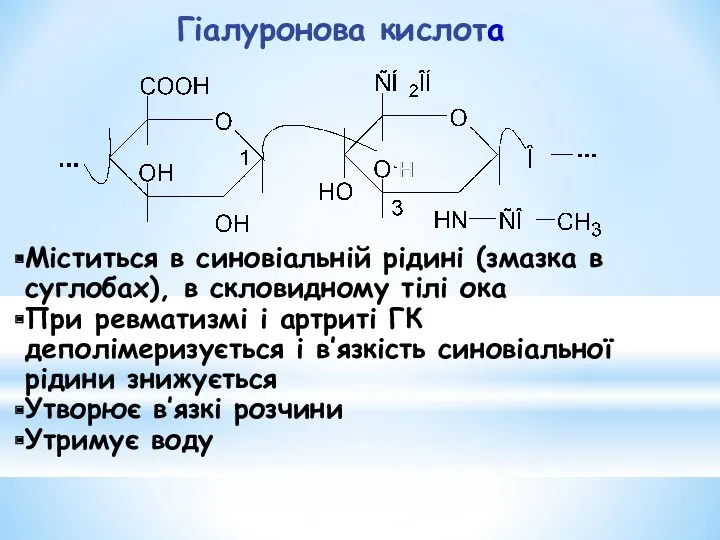
- 28. Гіалуронова кислота Міститься в синовіальній рідині (змазка в суглобах), в скловидному тілі ока При ревматизмі і
- 29. Гідроліз гіалуронової кислоти під дією гіалуронідази збільшує проникність міжклітинної речовини. Багато патогенних мікроорганізмів виділяють гіалуронідазу, що
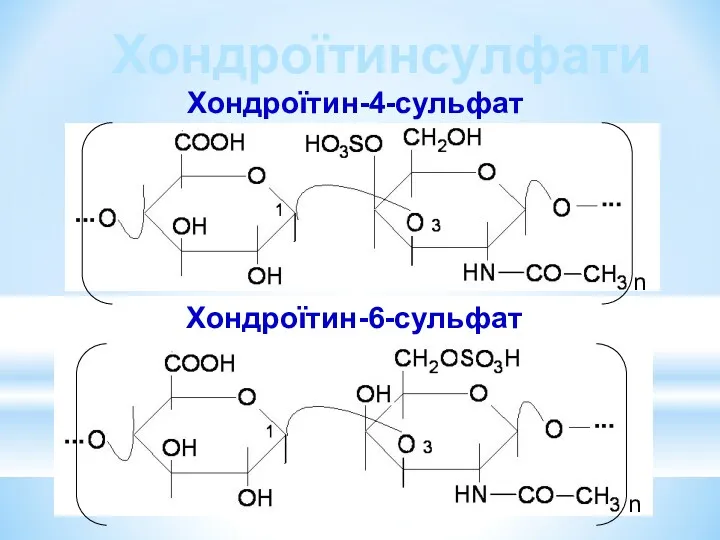
- 30. Хондроїтин-4-сульфат n n Хондроїтин-6-сульфат Хондроїтинсулфати
- 31. Хондроїтин-4-сульфат знаходиться в кістках, хрящах. Хондроїтин-6-сульфат міститься в серцевих клапанах, шкірі, сухожилках, зв’язках. Молекулярна маса 10-60
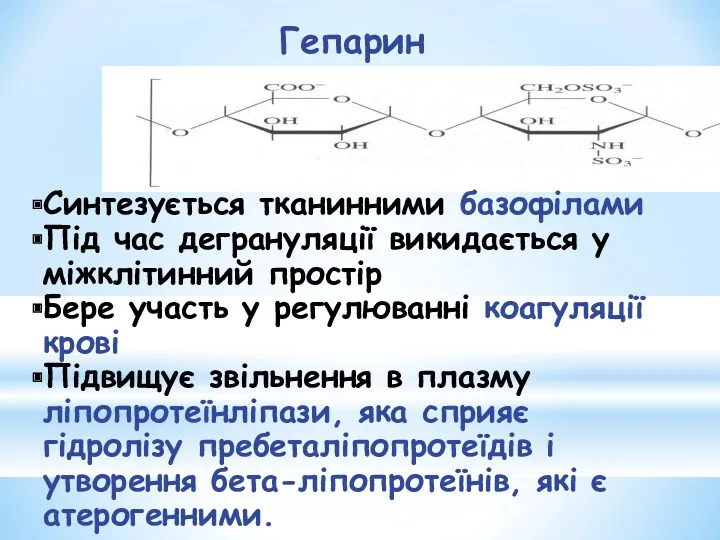
- 32. Гепарин Синтезується тканинними базофілами Під час дегрануляції викидається у міжклітинний простір Бере участь у регулюванні коагуляції
- 33. Із віком у хрящовій тканині знижується кількість протеогліканів, зростає вміст колагенових волокон, які можуть затримувати солі
- 35. Скачать презентацию
















 Обмен аминокислот и белков
Обмен аминокислот и белков Тип Хордовые (Chordata). Подтип Бесчерепные (Acrania). Класс Головохордовые (Cephalochordata)
Тип Хордовые (Chordata). Подтип Бесчерепные (Acrania). Класс Головохордовые (Cephalochordata) Растения рекордсмены
Растения рекордсмены Влияние никотина и алкоголя на развитие зародыша человека
Влияние никотина и алкоголя на развитие зародыша человека Многообразие организмов
Многообразие организмов Белки соединительной ткани – коллаген, эластин, протеогликаны. Особенности структуры и функции
Белки соединительной ткани – коллаген, эластин, протеогликаны. Особенности структуры и функции Значение водорослей в природе
Значение водорослей в природе Биоэтика. Управление живой системой
Биоэтика. Управление живой системой Урок Класс Ракообразные
Урок Класс Ракообразные Класс пресмыкающиеся. Биологические и экологические особенности, среда обитания, образ жизни
Класс пресмыкающиеся. Биологические и экологические особенности, среда обитания, образ жизни Ферменты 2. Теории о механизмах действия ферментов
Ферменты 2. Теории о механизмах действия ферментов Почка - зачаточный побег
Почка - зачаточный побег Что такое метаболизм и как его измерить
Что такое метаболизм и как его измерить Презентация Плоды к открытому уроку
Презентация Плоды к открытому уроку Растительные ткани
Растительные ткани Healthy eating
Healthy eating Отряд дневные хищные птицы
Отряд дневные хищные птицы Рыбы Онежского озера
Рыбы Онежского озера Животные Австралии animals of Australia
Животные Австралии animals of Australia Лабораторна робота Вивчення модифікаційної мінливості. Побудова варіаційного ряду і варіаційної кривої
Лабораторна робота Вивчення модифікаційної мінливості. Побудова варіаційного ряду і варіаційної кривої Влияние концентрации соли и сахара на жизнедеятельность микроорганизмов под воздействием пищевой биотехнологии
Влияние концентрации соли и сахара на жизнедеятельность микроорганизмов под воздействием пищевой биотехнологии Будова рослин. Клітини та тканини рослин
Будова рослин. Клітини та тканини рослин Опорно-двигательная система. Скелет. Мышцы
Опорно-двигательная система. Скелет. Мышцы Откуда берутся шоколад, изюм и мед
Откуда берутся шоколад, изюм и мед Життя підводних мешканців
Життя підводних мешканців Действие на растения радиации
Действие на растения радиации Исследование растений в XVI-XVIII века. (Лекция 6)
Исследование растений в XVI-XVIII века. (Лекция 6) Генетика
Генетика