Содержание
- 2. План 1. Загальна характеристика ферментів. 2. Властивості ферментів. 3. класифікація ферментів.
- 3. Спільність між хімічними каталізаторами і ферментами: 1. Каталізують тільки термодинамічно можливі реакції. 2. Не змінюються в
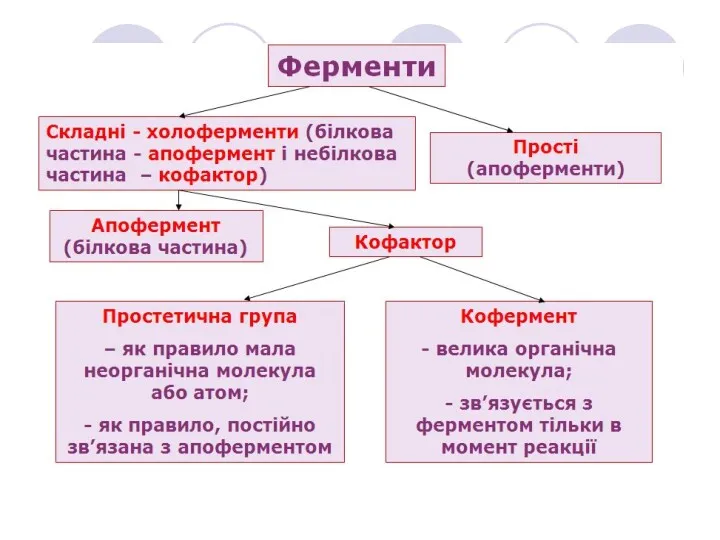
- 5. Металоферменти містять міцно зв’язані іони металів в активному центрі фермента (наприклад, залізо, цинк, мідь, кобальт). Приклади
- 6. Активні центри ферментів Активний центр – специфічна ділянка фермента до якої приєднується субстрат Субстрат, як правило,
- 7. Функціональна значимість окремих ділянок активного центру ферменту Активний центр ферменту Ділянка зв'язування Каталітична ділянка забезпечує субстратну
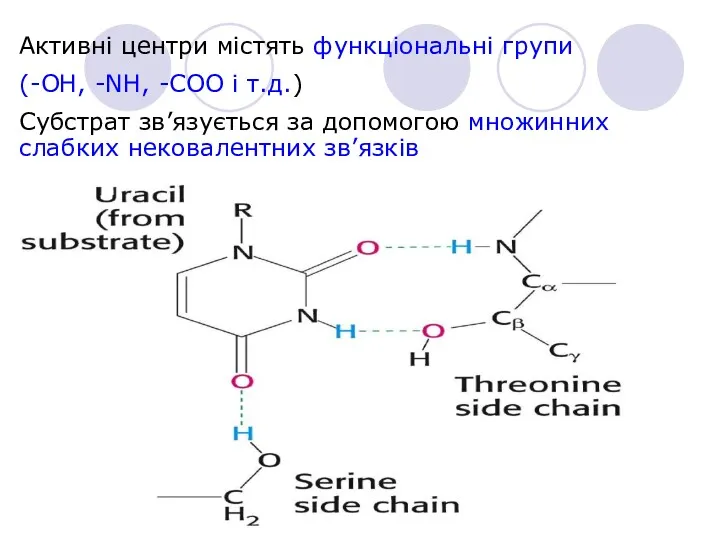
- 8. Активні центри містять функціональні групи (-OH, -NH, -COO і т.д.) Субстрат зв’язується за допомогою множинних слабких
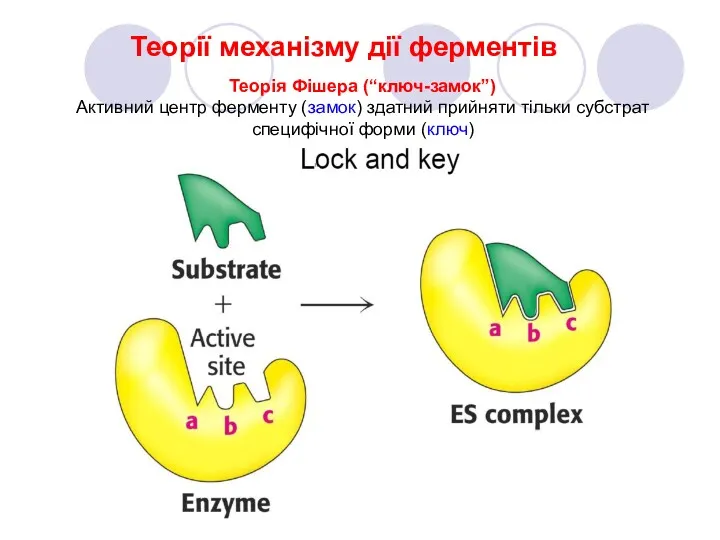
- 9. Теорії механізму дії ферментів Теорія Фішера (“ключ-замок”) Активний центр ферменту (замок) здатний прийняти тільки субстрат специфічної
- 10. Абсолютна – один фермент діє тільки на один субстрат (уреаза розщеплює тільки сечовину; аргіназа розщеплює тільки
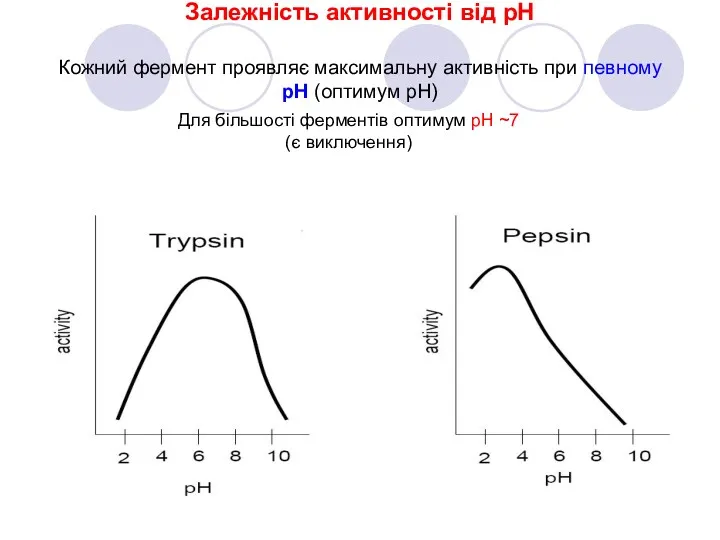
- 11. Залежність активності від рН Кожний фермент проявляє максимальну активність при певному pH (оптимум pH) Для більшості
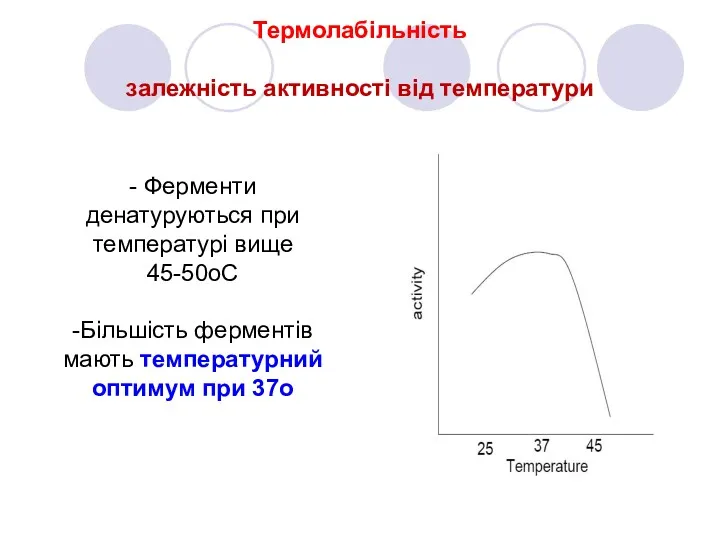
- 12. Термолабільність залежність активності від температури - Ферменти денатуруються при температурі вище 45-50oC -Більшість ферментів мають температурний
- 13. Класифікація ферментів Загальні назви Утворюються додаванням суфікса –аза до назви субстрату Приклад: - тирозиназа – окислює
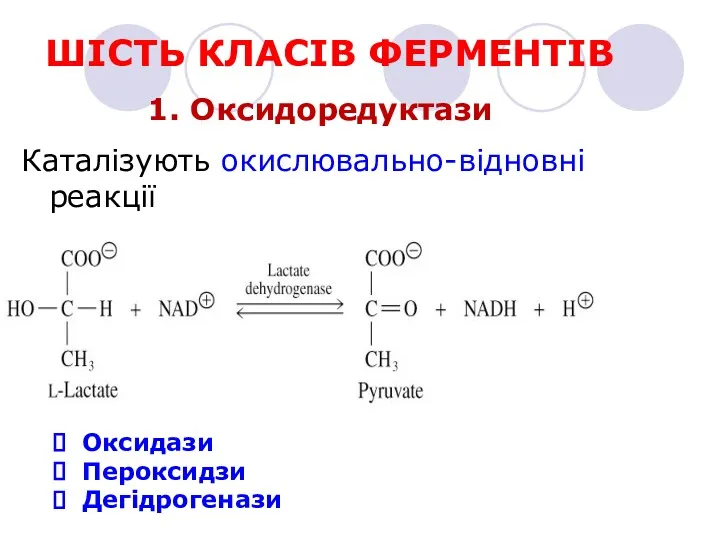
- 14. ШІСТЬ КЛАСІВ ФЕРМЕНТІВ 1. Оксидоредуктази Каталізують окислювально-відновні реакції Оксидази Пероксидзи Дегідрогенази
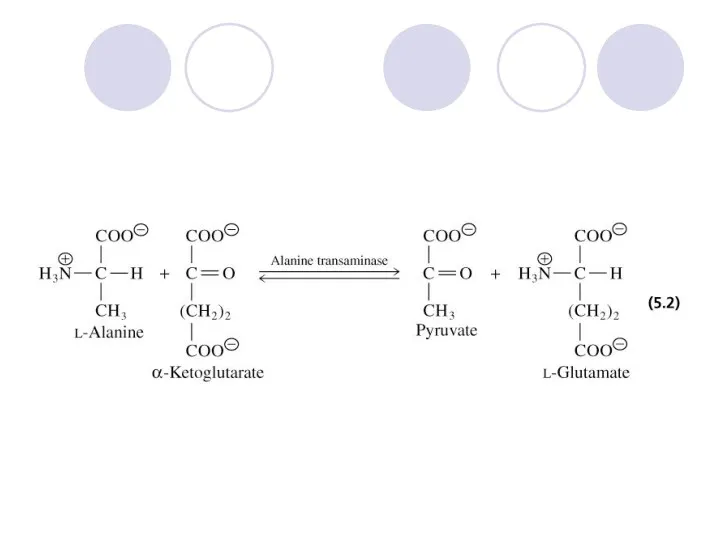
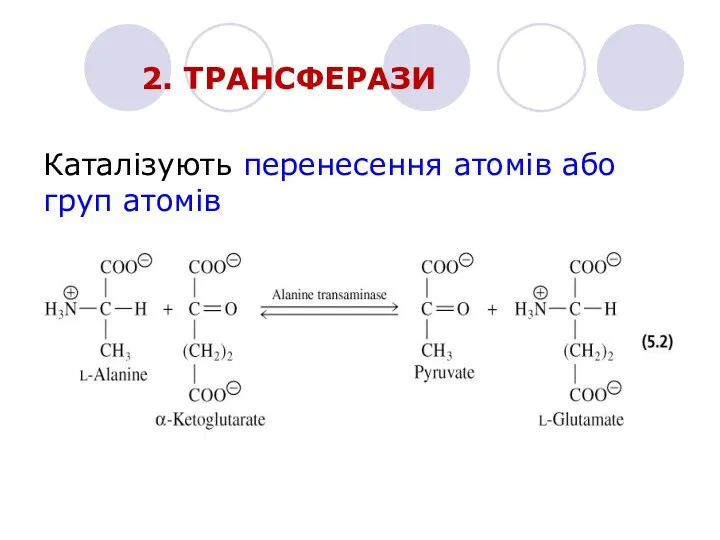
- 16. 2. ТРАНСФЕРАЗИ Каталізують перенесення атомів або груп атомів
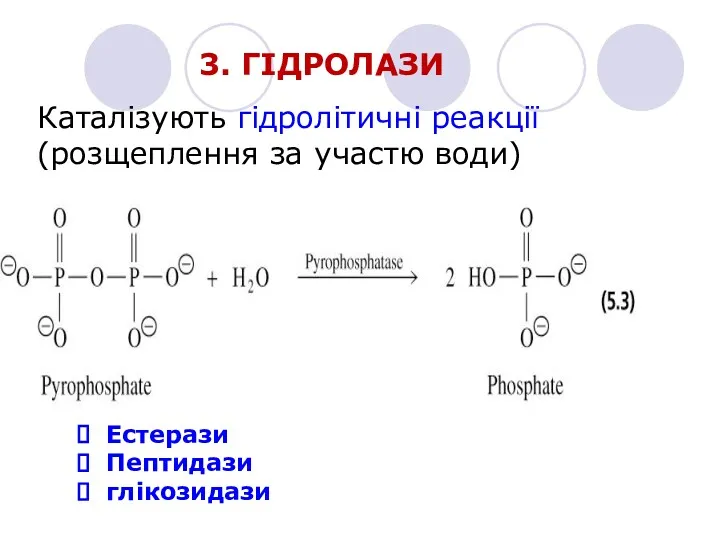
- 17. 3. ГІДРОЛАЗИ Каталізують гідролітичні реакції (розщеплення за участю води) Естерази Пептидази глікозидази
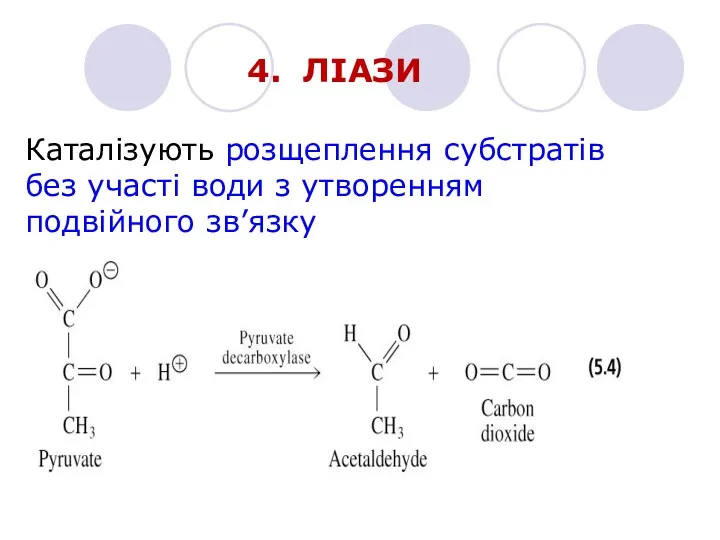
- 18. 4. ЛІАЗИ Каталізують розщеплення субстратів без участі води з утворенням подвійного зв’язку
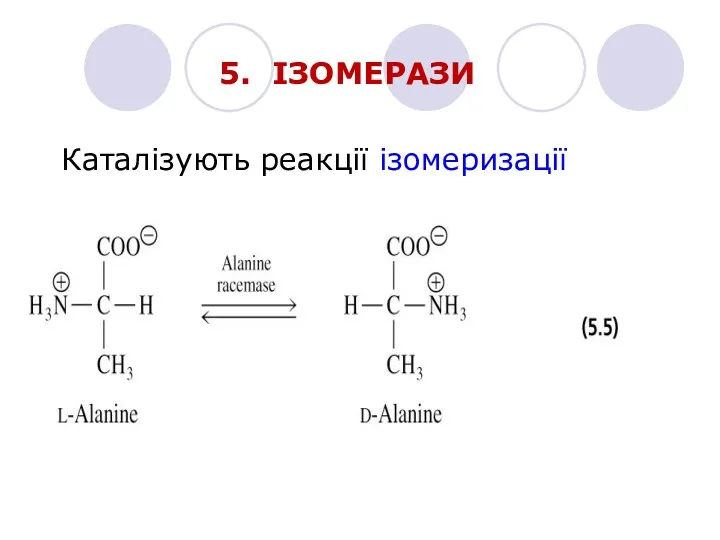
- 19. 5. ІЗОМЕРАЗИ Каталізують реакції ізомеризації
- 21. Скачать презентацию







 Животные рекордсмены
Животные рекордсмены Разнообразие грибов
Разнообразие грибов Помощь бездомным животным. Проект
Помощь бездомным животным. Проект Отряд Стрекозы
Отряд Стрекозы Биологическое разнообразие
Биологическое разнообразие Презентация Важность охраны животного мира
Презентация Важность охраны животного мира Размножение. Клеточная основа размножения
Размножение. Клеточная основа размножения Сердечнососудистая система
Сердечнососудистая система Игра Угадай, кто спрятался. Насекомые
Игра Угадай, кто спрятался. Насекомые Китоподібні - виключно водні ссавці
Китоподібні - виключно водні ссавці Анализаторы. Рецепторы. Виды чувствительности
Анализаторы. Рецепторы. Виды чувствительности Biochimia. Enzimele
Biochimia. Enzimele Лягушка. Чудесное превращение
Лягушка. Чудесное превращение Необычный сахар
Необычный сахар Голоса птиц
Голоса птиц день подснежника
день подснежника Белки, их свойства
Белки, их свойства Растительные сообщества. Природные сообщества
Растительные сообщества. Природные сообщества Животные кабан и свинья
Животные кабан и свинья Клеточный цикл. Апоптоз. Раковая трансформация клеток. Хромосомы
Клеточный цикл. Апоптоз. Раковая трансформация клеток. Хромосомы Презентация по биологии для 9 класса по теме:Метаболизм. Энергетический обмен.
Презентация по биологии для 9 класса по теме:Метаболизм. Энергетический обмен. Мікрофлора ґрунту, води, повітря, тваринного організму та молока. Роль цих субстратів, як факторів передачі інфекції
Мікрофлора ґрунту, води, повітря, тваринного організму та молока. Роль цих субстратів, як факторів передачі інфекції Тип Членистоногие
Тип Членистоногие Животные Красной Книги. Белый медведь
Животные Красной Книги. Белый медведь Різноманітність рослин
Різноманітність рослин Coleoptera
Coleoptera Изменения в модели основного государственного экзамена по биологии в 2020 году
Изменения в модели основного государственного экзамена по биологии в 2020 году Инжир. Вы многого не знали …
Инжир. Вы многого не знали …