Содержание
- 2. Оптические спектры и строение атомов Излучение атомарного водорода Спектральные серии Формула Бальмера Постулаты Н. Бора. Теория
- 3. Радиоактивность. Альфа-частицы Открытие радиоактивности: в 1896г. (Франция А.Беккерель). Некоторые радиоактивные элементы (уран, радий, и др.) обладают
- 4. Опыты Резерфорда . Чтобы узнать, как устроен атом, надо прозондировать его быстрыми заряженными альфа-частицам и по
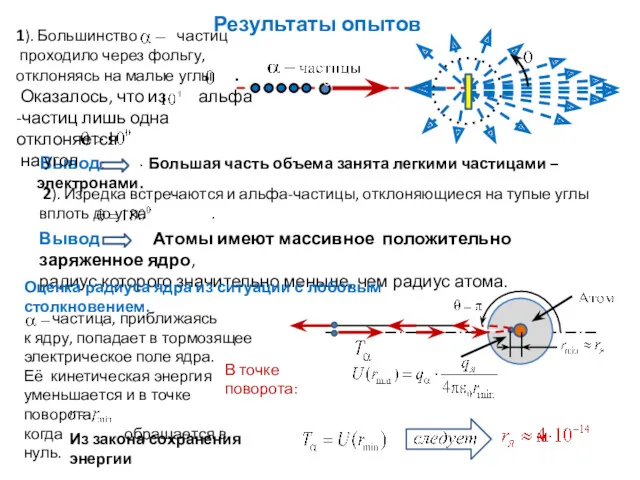
- 5. Результаты опытов Оценка радиуса ядра из ситуации с лобовым столкновением.
- 6. Ядерная (планетарная) модель атома по Резерфорду
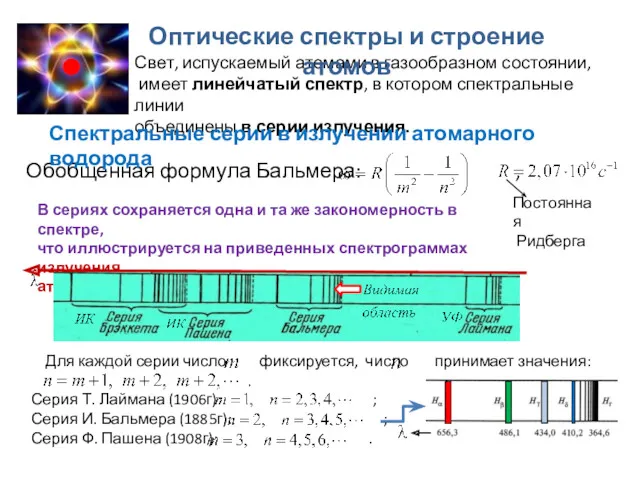
- 7. Свет, испускаемый атомами в газообразном состоянии, имеет линейчатый спектр, в котором спектральные линии объединены в серии
- 8. Атом Нильса Бора Самым простым атомом является атом водорода , имеющий единственный электрон. Масса протона в
- 9. Постулаты Н.Бора 2). О поглощении и испускании квантов излучения. Излучение или поглощение кванта излучения (фотона) происходит
- 10. . Потенциальная энергия принимает отрицательные значения, равные произведению заряда электрона ( - е ) на потенциал
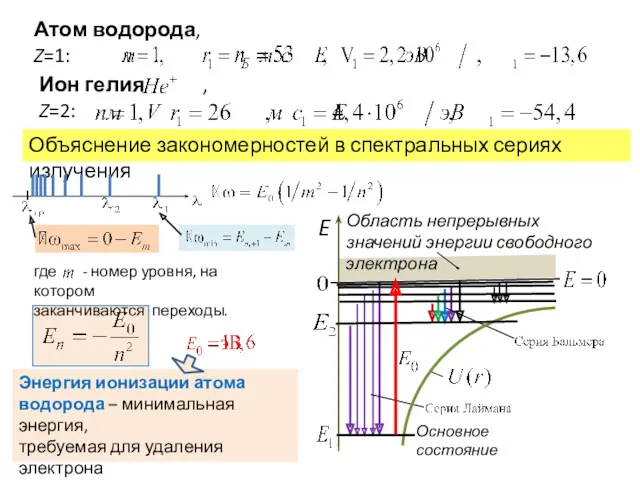
- 11. Атом водорода, Z=1: Объяснение закономерностей в спектральных сериях излучения
- 13. Скачать презентацию







 Презентация Виды излучения и спектры
Презентация Виды излучения и спектры Энтропия
Энтропия Emission spectrum of H
Emission spectrum of H Презентация к уроку Отражение света. Законы отражения
Презентация к уроку Отражение света. Законы отражения Центр тяжести
Центр тяжести Презентация Источники света
Презентация Источники света Газды разряд түрлері
Газды разряд түрлері Динамика вращательного движения
Динамика вращательного движения Изнашивание неметаллических материалов
Изнашивание неметаллических материалов 10 кл - Подготовка к контрольной работе по теме Основы термодинамики
10 кл - Подготовка к контрольной работе по теме Основы термодинамики Радиационный фон, виды. Радиоактивное загрязнение среды обитания человека, источники
Радиационный фон, виды. Радиоактивное загрязнение среды обитания человека, источники Конвективный теплообмен. (Лекция 10)
Конвективный теплообмен. (Лекция 10) Поляризация диэлектриков
Поляризация диэлектриков Электрическая емкость. Конденсаторы. Энергия заряженного конденсатора. Энергия электрического поля
Электрическая емкость. Конденсаторы. Энергия заряженного конденсатора. Энергия электрического поля Презентация к уроку по теме Архимедова сила
Презентация к уроку по теме Архимедова сила Конструкції кип’ятильників і водонагрівальних пристроїв
Конструкції кип’ятильників і водонагрівальних пристроїв Иллюзия
Иллюзия Кинематические характеристики движения точки
Кинематические характеристики движения точки Імітаційна модель виміру параметрів сигналів частотної маніпуляції
Імітаційна модель виміру параметрів сигналів частотної маніпуляції Стандартные настройки САР и их применение
Стандартные настройки САР и их применение Разработка урока физики: Электризация тел
Разработка урока физики: Электризация тел Електричні двигуни
Електричні двигуни Бернулли теңдеуі
Бернулли теңдеуі Цепная передача (зацеплением)
Цепная передача (зацеплением) Строение вещества
Строение вещества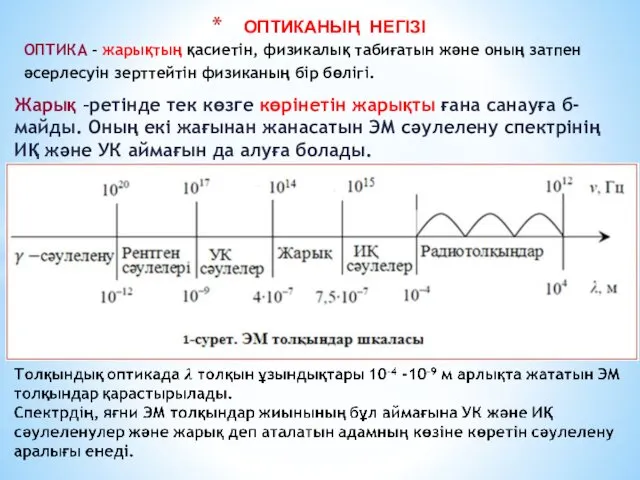 Оптиканың негізі
Оптиканың негізі Тест по теме Магнитное поле 9 класс
Тест по теме Магнитное поле 9 класс Атмосферное давление 7
Атмосферное давление 7