Содержание
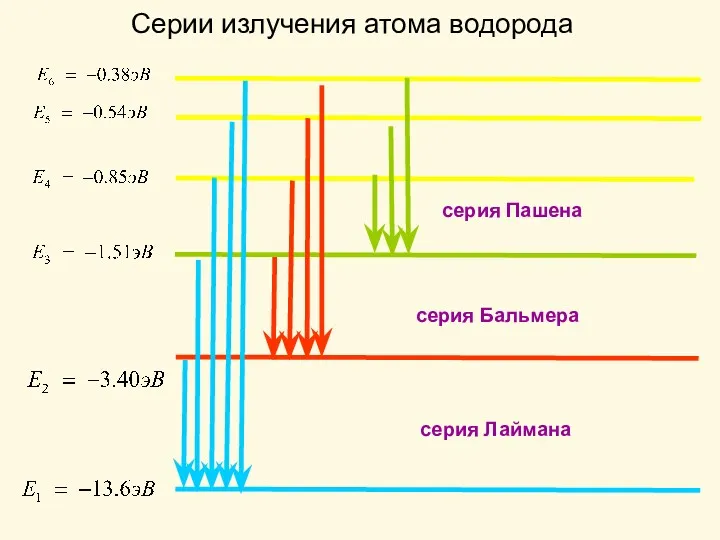
- 2. Серии излучения атома водорода серия Пашена серия Лаймана серия Бальмера
- 3. Спектр водорода
- 4. Экспериментальные данные И. Бальмер (1885г.) п = 3, 4, 5 и т.д., R= 3,21015ּ Гц R
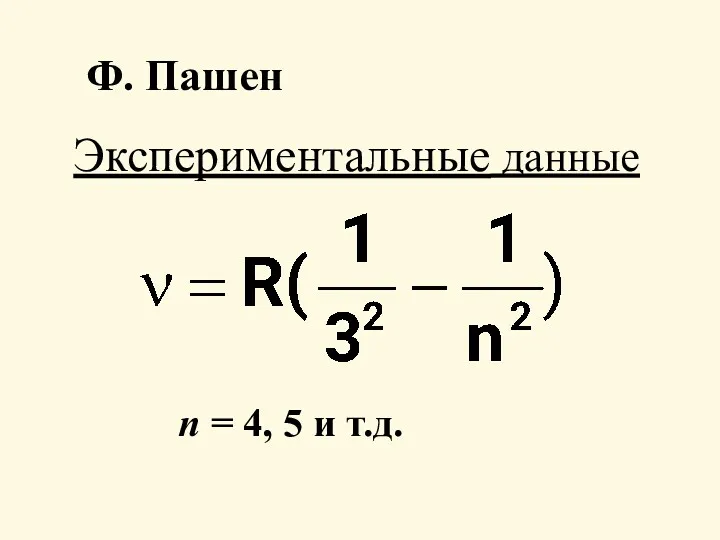
- 5. Экспериментальные данные Ф. Пашен п = 4, 5 и т.д.
- 6. Экспериментальные данные Т. Лайман п= 2, 3, 4, 5 и т.д.
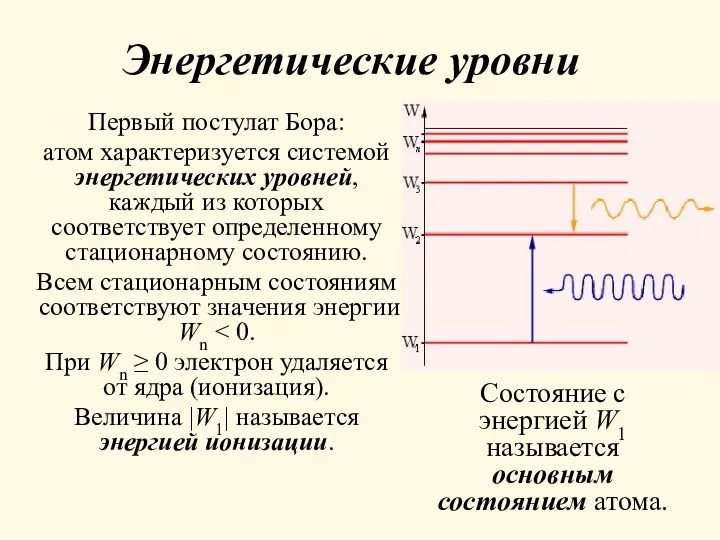
- 7. Энергетические уровни Первый постулат Бора: атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному
- 8. Правило квантования (отбора орбит) Момент импульса электрона, вращающегося вокруг ядра, может принимать только дискретные значения, кратные
- 9. Атом водорода по Н.Бору По правилу квантования: Из коллекции www.eduspb.com
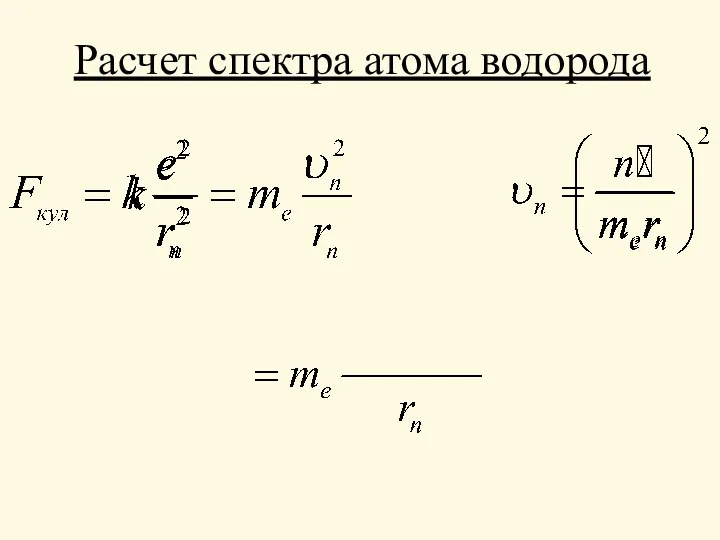
- 10. Расчет спектра атома водорода
- 11. Расчет атома водорода rn ~ n2
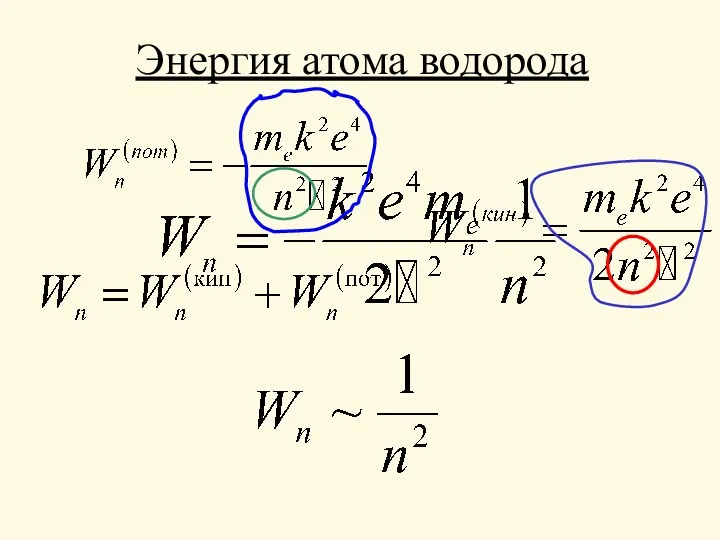
- 12. Кинетическая энергия атома водорода
- 13. Потенциальная энергия атома водорода
- 14. Энергия атома водорода
- 15. Формула И.Ридберга (1890) Для серии Бальмера m = 2, n = 3, 4, 5, ... .
- 16. Постоянная Ридберга
- 18. Скачать презентацию










 Дизель 10 Д 100
Дизель 10 Д 100 Теория многофазной фильтрации. (Лекция 3)
Теория многофазной фильтрации. (Лекция 3) Делаем мензурки и отливной сосуд
Делаем мензурки и отливной сосуд Курс общей физики. Лекция 2
Курс общей физики. Лекция 2 Расчет статически неопределимых систем по допускаемым нагрузкам
Расчет статически неопределимых систем по допускаемым нагрузкам Определение частоты вращения и крутящих моментов на всех валах привода и подбор электродвигателя
Определение частоты вращения и крутящих моментов на всех валах привода и подбор электродвигателя Модель атома Резерфорда-Бора
Модель атома Резерфорда-Бора Опытные данные по теплоотдаче
Опытные данные по теплоотдаче Линии передачи электромагнитных волн. Линейные цепи с распределенными параметрами. (Тема 1.1)
Линии передачи электромагнитных волн. Линейные цепи с распределенными параметрами. (Тема 1.1) Термоядерная реакция (9 класс)
Термоядерная реакция (9 класс) Методическое сообщение по теме Повышение познавательных интересов обучающихся на основе использования информационных технологий
Методическое сообщение по теме Повышение познавательных интересов обучающихся на основе использования информационных технологий Восстановление корпусных деталей
Восстановление корпусных деталей Теорія великого вибуху
Теорія великого вибуху Методическая разработка по методике В.Ф. Шаталова для организации учебной деятельности учащихся по физике. На примере темы Электрический ток. 8 класс
Методическая разработка по методике В.Ф. Шаталова для организации учебной деятельности учащихся по физике. На примере темы Электрический ток. 8 класс Восстанавливающие моменты
Восстанавливающие моменты Повышение стойкости червячных фрез за счет нанесения фоп-покрытия нового поколения
Повышение стойкости червячных фрез за счет нанесения фоп-покрытия нового поколения Молекулярно-лучевая эпитаксия
Молекулярно-лучевая эпитаксия Техническая термодинамика
Техническая термодинамика Агрегатные состояния вещества. Плавление и отвердевание. (1 и 2 часть)
Агрегатные состояния вещества. Плавление и отвердевание. (1 и 2 часть) Смешанное соединение элементов в цепи постоянного тока
Смешанное соединение элементов в цепи постоянного тока Электр тогы. Ток көздері. Ресми
Электр тогы. Ток көздері. Ресми Геометрические параметры оптического волокна
Геометрические параметры оптического волокна Теплообменные аппараты
Теплообменные аппараты Жарықты мәжбүрлі сәулелену арқылы күшейту
Жарықты мәжбүрлі сәулелену арқылы күшейту Презентация к уроку решения задач по физике Построение изображений в линзах 8 класс
Презентация к уроку решения задач по физике Построение изображений в линзах 8 класс Требования к видимости на дорогах. Торможение автомобиля
Требования к видимости на дорогах. Торможение автомобиля Интеллектуальный Конкурс Знатоки
Интеллектуальный Конкурс Знатоки ИК - спектроскопия. 3 курс
ИК - спектроскопия. 3 курс