Содержание
- 2. Тема: «Электрический ток в металлах и электролитах. Законы Фарадея»
- 3. План Электрический ток в металлах Электролитическая диссоциация. Электролиз Законы Фарадея Применение электролиза в технике
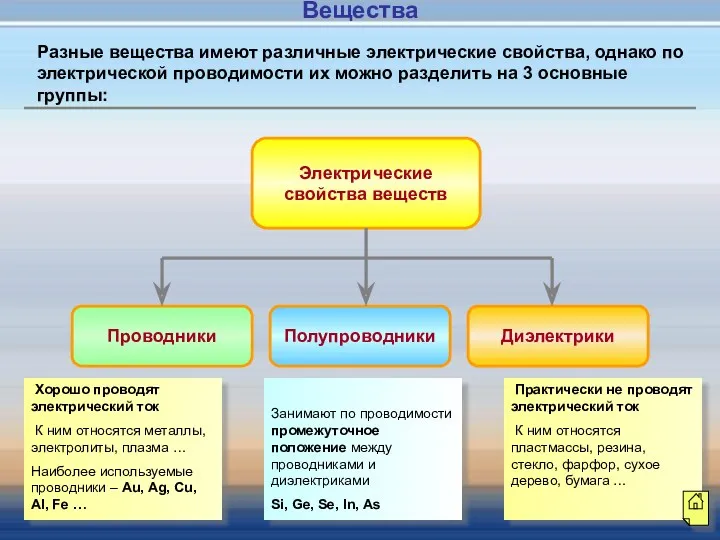
- 4. Электрические свойства веществ Проводники Полупроводники Диэлектрики Хорошо проводят электрический ток К ним относятся металлы, электролиты, плазма
- 5. Электрический ток в металлах
- 6. Электрический ток в металлах Природа электрического тока в металлах Электрический ток в металлических проводниках никаких изменений
- 7. Наиболее убедительное доказательство электронной природы тока в металлах было получено в опытах с инерцией электронов. Идея
- 8. Опыт Папалекси-Мандельштама Описание опыта : Цель: выяснить какова проводимость металлов. Установка: катушка на стержне со скользящими
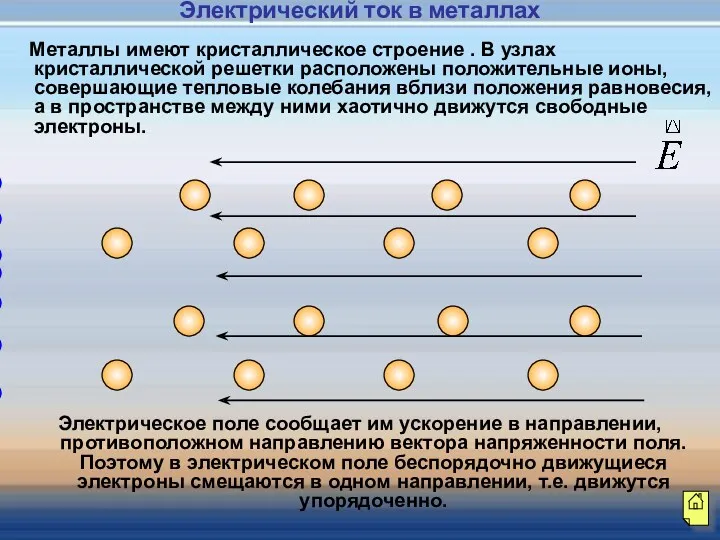
- 9. - - - - - - - - - - Металлы имеют кристаллическое строение . В
- 10. 1). Носителями тока в металлах являются электроны, движение которых подчиняется законом классической механики. 2). Поведение электронов
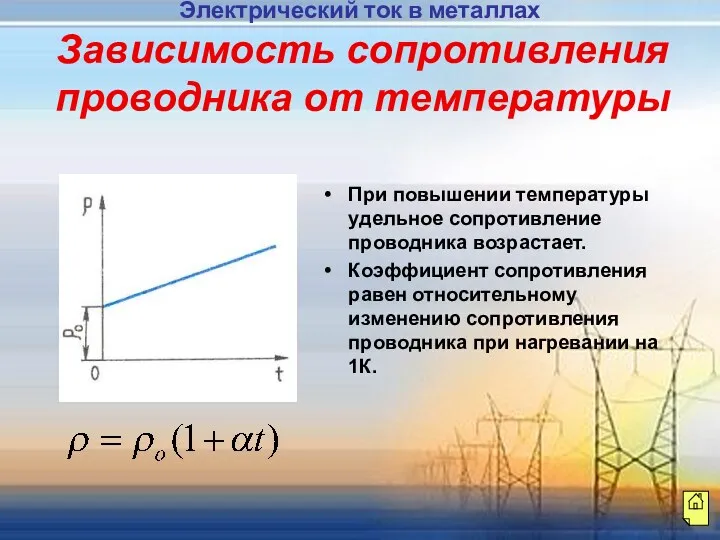
- 11. Зависимость сопротивления проводника от температуры При повышении температуры удельное сопротивление проводника возрастает. Коэффициент сопротивления равен относительному
- 12. Сверхпроводимость — физическое явление, заключающееся в скачкообразном падении до нуля сопротивления вещества. В то время, как
- 13. В 1911 г. голландский физик Камерлинг-Оннес обнаружил, что при охлаждении ртути в жидком гелии её сопротивление
- 14. Мультиэлектрон Мультиэлектрон (me) – это новая, ранее неизвестная, квантовая частица,которая образуется из двух и более электронов
- 15. Движение электронов в обычном проводнике Электроны сталкиваются с кристаллической решеткой и теряют свою кинетическую энергию, которая
- 16. Движение мультиэлектрона в сверхпроводнике Кинетическая энергия электронов, составляющих мультиэлектрон переходит во вращательную энергию частицы. Поэтому мультиэлектрон
- 17. Использование сверхпроводимости Электрический ток в металлах
- 18. Электрический ток в электролитах
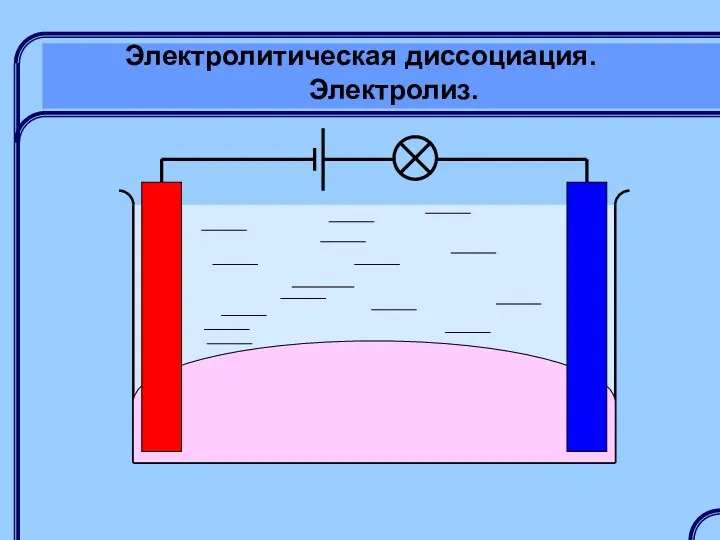
- 19. Электролитическая диссоциация. Электролиз
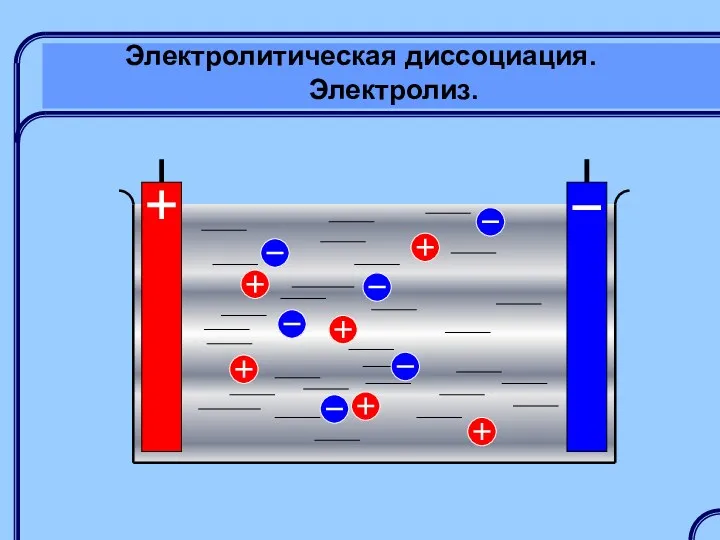
- 20. Электролитическая диссоциация. Электролиз. Электролиты – это вещества, растворы или расплавы которых проводят электрический ток: растворы кислот,
- 21. Электролитическая диссоциация. Электролиз.
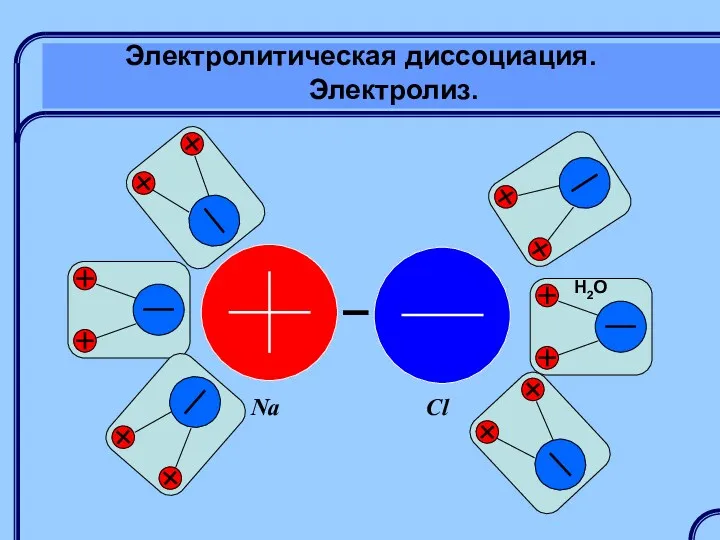
- 22. Электролитическая диссоциация. Электролиз. Электролитическая диссоциация – это распад молекул растворенного вещества (электролита) на заряженные ионы.
- 23. Электролитическая диссоциация. Электролиз. Na Cl H2O
- 24. Электролитическая диссоциация. Электролиз.
- 25. Электролитическая диссоциация. Электролиз. Электролиз – это изменение химического состава раствора или расплава при прохождении через него
- 26. Майкл Фарадей (1791-1867) – английский физик, автор законов электролиза Электролитическая диссоциация. Электролиз.
- 27. Законы Фарадея
- 28. Законы Фарадея Первый закон Фарадея Масса вещества, выделившегося на электроде, пропорциональна электрическому заряду, прошедшему через электролит.
- 29. Законы Фарадея m = k ∙ q q = I ∙ Δt m = k ∙
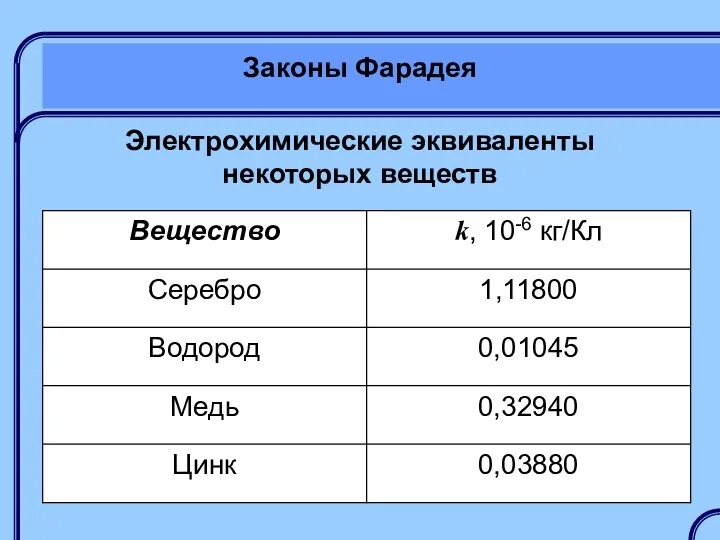
- 30. Законы Фарадея Электрохимические эквиваленты некоторых веществ
- 31. Законы Фарадея Второй закон Фарадея (закон электролиза) Электрохимический эквивалент вещества прямо пропорционален отношению молекулярной массы к
- 32. Законы Фарадея F - постоянная Фарадея F = 96,5∙103 Кл/моль
- 33. Законы Фарадея m = m0i ∙ Ni m = k ∙ I ∙ Δt
- 34. Законы Фарадея Заряд электрона e = 1,6∙10-19 Кл
- 35. Пример и разбор решения задач: 1.Источник тока присоединили к двум пластинам, опущенным в раствор поваренной соли.
- 36. Применение электролиза в технике
- 37. Применение электролиза в технике Гальваностегия Гальванопластика Получение и очистка металлов
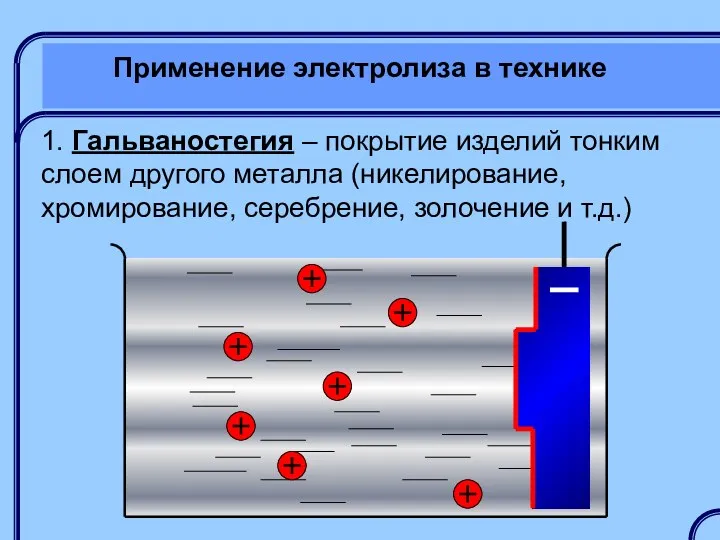
- 38. Применение электролиза в технике 1. Гальваностегия – покрытие изделий тонким слоем другого металла (никелирование, хромирование, серебрение,
- 39. Применение электролиза в технике 1. Гальваностегия – покрытие изделий тонким слоем другого металла (никелирование, хромирование, серебрение,
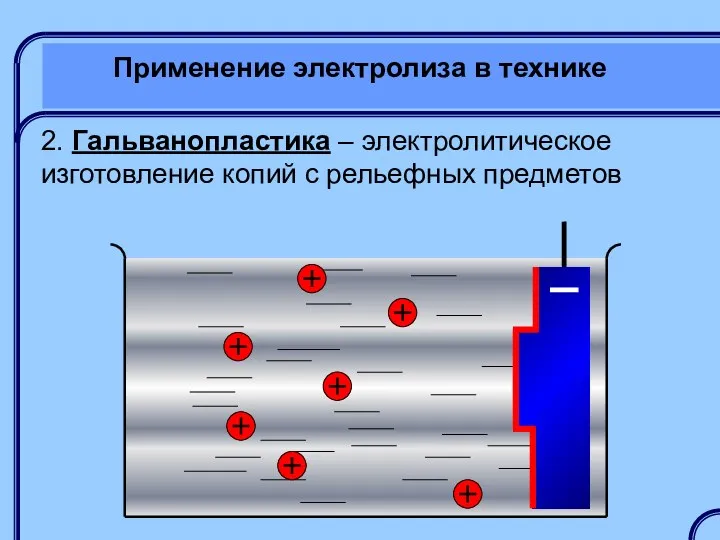
- 40. Применение электролиза в технике 2. Гальванопластика – электролитическое изготовление копий с рельефных предметов
- 41. Применение электролиза в технике 2. Гальванопластика – электролитическое изготовление копий с рельефных предметов Якоби Борис Семенович
- 42. Применение электролиза в технике 2. Гальванопластика – электролитическое изготовление копий с рельефных предметов Исаакиевский собор, Санкт-Петербург
- 43. Применение электролиза в технике 2. Гальванопластика – электролитическое изготовление копий с рельефных предметов
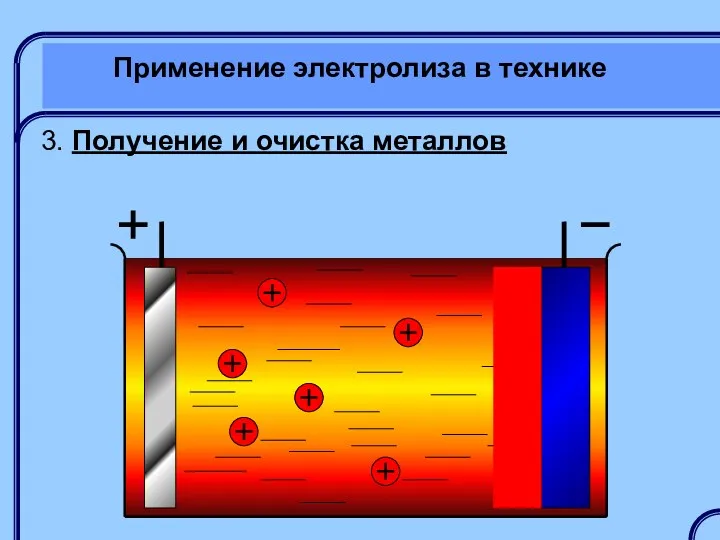
- 44. Применение электролиза в технике 3. Получение и очистка металлов Получение металлов обычно осуществляется электролизом расплавов с
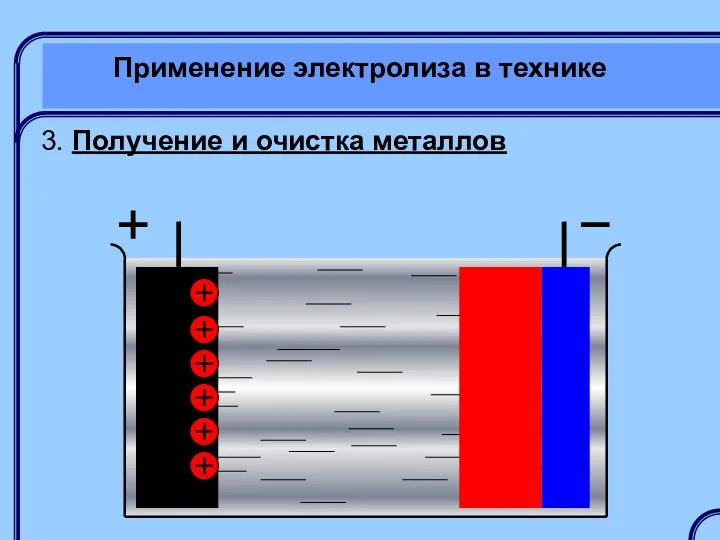
- 45. Применение электролиза в технике 3. Получение и очистка металлов
- 46. Применение электролиза в технике 3. Получение и очистка металлов
- 48. Скачать презентацию


































 Истечение жидкости из отверстий и насадков. Насосы. Гидродинамика
Истечение жидкости из отверстий и насадков. Насосы. Гидродинамика Основы молекулярно-кинетической теории. Масса молекул. Количество вещества
Основы молекулярно-кинетической теории. Масса молекул. Количество вещества Солнечный парус
Солнечный парус Система параллельных сил и пар
Система параллельных сил и пар Потенциометрия. Электродты потенциал
Потенциометрия. Электродты потенциал Беріліс механизмдерді графикалық әдіспен кинематикалық талдау
Беріліс механизмдерді графикалық әдіспен кинематикалық талдау Ремонт компьютеров и бытовой техники в Киеве
Ремонт компьютеров и бытовой техники в Киеве Урок Атмосферное давление
Урок Атмосферное давление Інерціальні системи відліку. Перший закон Ньютона
Інерціальні системи відліку. Перший закон Ньютона Двигатель Cummins ISF 2.8
Двигатель Cummins ISF 2.8 Практическая работа. Изучение машин и оборудования для расчистки озеленяемых территорий
Практическая работа. Изучение машин и оборудования для расчистки озеленяемых территорий Механізація приготування кормових сумішей
Механізація приготування кормових сумішей Радиационный контроль
Радиационный контроль Давление. Единицы давления (7 класс)
Давление. Единицы давления (7 класс) Напряженность магнитного поля
Напряженность магнитного поля Давление твердых тел, жидкостей и газов. Своя игра
Давление твердых тел, жидкостей и газов. Своя игра Движение под действием силы тяжести. Решение задач
Движение под действием силы тяжести. Решение задач Неравномерное движение. Скорость
Неравномерное движение. Скорость How to use 5 service ports
How to use 5 service ports Обертальний рух в нашому житті
Обертальний рух в нашому житті Приборы для измерения давления
Приборы для измерения давления Электрооборудование источников энергии, электрических сетей и промышленных предприятий
Электрооборудование источников энергии, электрических сетей и промышленных предприятий Строительная механика. Теория определения перемещений деформируемых систем. (Часть 1. Лекция 1)
Строительная механика. Теория определения перемещений деформируемых систем. (Часть 1. Лекция 1) Методи дослідження наносистем: спектроскопічні та дифракційні методи
Методи дослідження наносистем: спектроскопічні та дифракційні методи Строительная механика. Методы определения силовых факторов в деформируемых системах
Строительная механика. Методы определения силовых факторов в деформируемых системах Турбулентность. Введение
Турбулентность. Введение Теплообменные аппараты
Теплообменные аппараты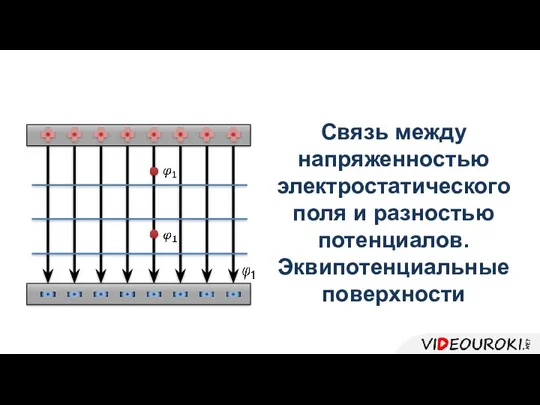 Связь между напряженностью электростатического поля и разностью потенциалов. Эквипотенциальные поверхности
Связь между напряженностью электростатического поля и разностью потенциалов. Эквипотенциальные поверхности