Содержание
- 2. Электролитическая диссоциация По электрическим свойствам все жидкости можно разделить на 2 группы: ЖИДКОСТИ Проводники Диэлектрики Содержащие
- 3. Электролиты – это вещества, водные растворы которых проводят электрический ток. Сам электролит в твердом состоянии не
- 4. При растворении электролита в воде его молекулы распадаются на положительные и отрицательные ионы под действием ЭП
- 5. Степень диссоциации зависит от концентрации раствора, температуры, диэлектрической проницаемости раствора Рекомбинация – процесс объединения ионов разных
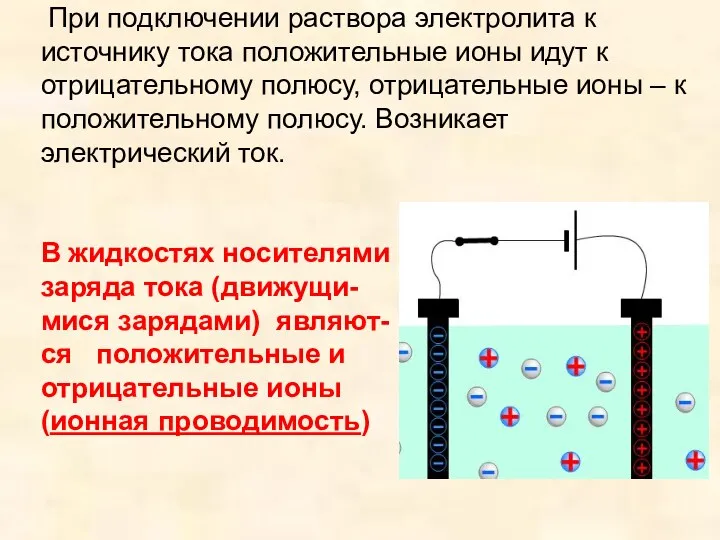
- 6. При подключении раствора электролита к источнику тока положительные ионы идут к отрицательному полюсу, отрицательные ионы –
- 7. Электролиз – это процесс выделения вещества на электродах, связанный с окислительно-восстановительной реакцией. Закон электролиза был открыт
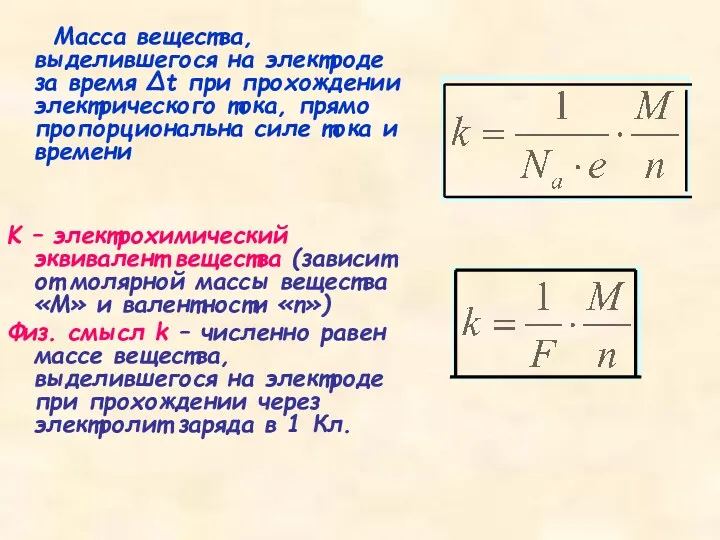
- 9. Масса вещества, выделившегося на электроде за время Δt при прохождении электрического тока, прямо пропорциональна силе тока
- 10. - постоянная Фарадея F= 96500Кл/моль Физ.смысл F- численно равна заряду, который надо пропустить через раствор электролита,
- 11. Обозначение букв m- масса тела [кг] I – сила тока [А[ ∆t – время [с] ∆q
- 12. С увеличением температуры сопротивление электролита уменьшается Температурная зависимость сопротивления электролита объясняется в основном изменением удельного сопротивления.
- 13. Применение электролиза в технике: 1.Покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение, золочение) (гальваностегия)
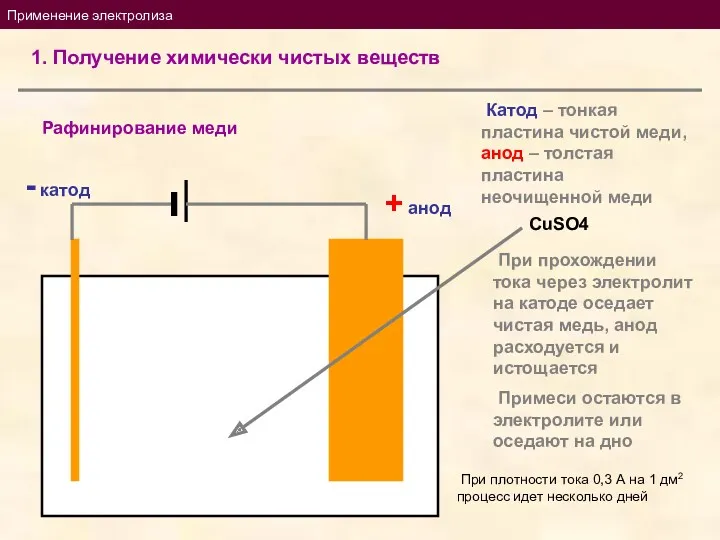
- 14. Применение электролиза 1. Получение химически чистых веществ Рафинирование меди + анод - катод Катод – тонкая
- 15. Применение электролиза 2. Гальваностегия Гальваностегия – покрытие предметов неокисляющимся металлами для защиты от коррозии (Ni, Zn,
- 16. Применение электролиза 3. Гальванопластика Копия барельефа, полученная методом гальванопластики Гальванопластика – получение отслаиваемых копий предмета, полученных
- 17. Применение электролиза Кроме указанных выше, электролиз нашел применение и в других областях: получение оксидных защитных пленок
- 18. гальваническое наращивания тонкого слоя Алмазный инструмент, изготовленный методом гальваностегии
- 20. Скачать презентацию





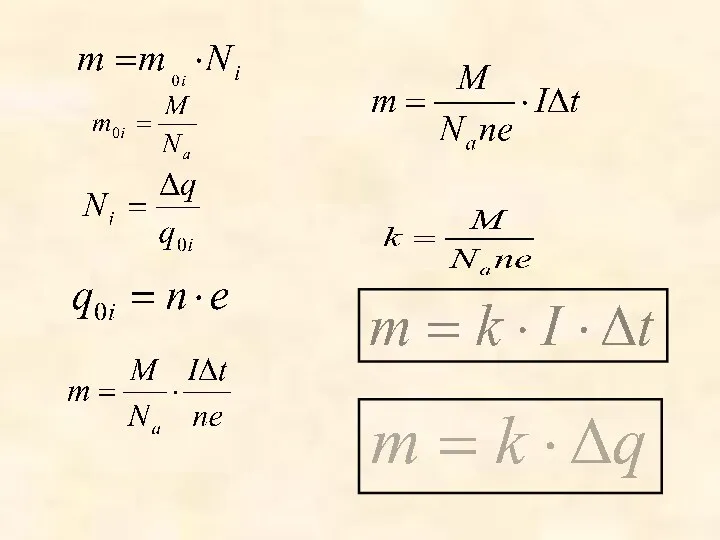

![Обозначение букв m- масса тела [кг] I – сила тока](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/586591/slide-10.jpg)






 Мощностной баланс автомобиля
Мощностной баланс автомобиля Конденсаторы
Конденсаторы Визуальная, квантовая физика
Визуальная, квантовая физика Техническое обслуживание, диагностирование и ремонт газораспределительного механизма автомобиля
Техническое обслуживание, диагностирование и ремонт газораспределительного механизма автомобиля Электрооборудование автомобилей. Системы автоматического управления оборудованием автомобиля. (Урок 12)
Электрооборудование автомобилей. Системы автоматического управления оборудованием автомобиля. (Урок 12) Влияние предварительной деформации на эффект памяти формы в интерметаллиде TiNi
Влияние предварительной деформации на эффект памяти формы в интерметаллиде TiNi Отличия квантовой статистики от классической
Отличия квантовой статистики от классической Люмінесценція і її застосування. (Тема 1)
Люмінесценція і її застосування. (Тема 1) Конвекция. Ламинарный тепловой погранслой при вынужденном движении жидкости вдоль плоской поверхности. (Тема 2. Лекции 8,9)
Конвекция. Ламинарный тепловой погранслой при вынужденном движении жидкости вдоль плоской поверхности. (Тема 2. Лекции 8,9) Теплообмен излучением
Теплообмен излучением Основы молекулярно-кинетической теории
Основы молекулярно-кинетической теории Применение первого закона термодинамики к различным процессам
Применение первого закона термодинамики к различным процессам Проектная деятельность на уроках физики в 7 классе
Проектная деятельность на уроках физики в 7 классе Защита от ионизирующих излучений
Защита от ионизирующих излучений Ходовая автомобиля
Ходовая автомобиля Плотность вещества
Плотность вещества Подшипники качения
Подшипники качения Электронагревательные приборы. Из истории изобретения электрической лампы накаливания
Электронагревательные приборы. Из истории изобретения электрической лампы накаливания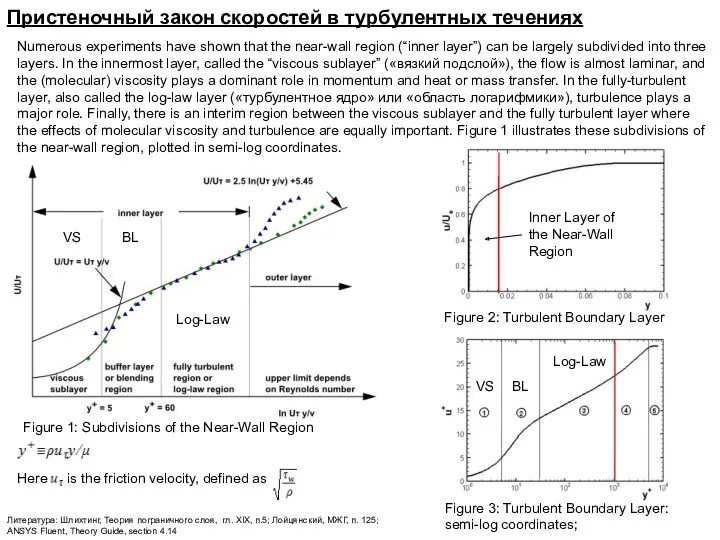 Пристеночный закон скоростей в турбулентных течениях
Пристеночный закон скоростей в турбулентных течениях Аэрогазодинамика. Плоские изоэнтропические течения газа (лекции 8, 9)
Аэрогазодинамика. Плоские изоэнтропические течения газа (лекции 8, 9) Опыт Резерфорда
Опыт Резерфорда Токарно-винторезный станок мод. 16К20
Токарно-винторезный станок мод. 16К20 Рулевое управление. Устройство автомобиля
Рулевое управление. Устройство автомобиля Прості механізми
Прості механізми Хроматография. (Лекция 4)
Хроматография. (Лекция 4) Реактивное движение
Реактивное движение Презентация к уроку в 7 классе по теме Масса тела.Измерение массы тела с помощью весов
Презентация к уроку в 7 классе по теме Масса тела.Измерение массы тела с помощью весов Реактивное движение. Ракеты
Реактивное движение. Ракеты