Содержание
- 2. Цель урока: Ввести определение понятий: - электролиты; - электрическая диссоциация; - степень диссоциации. 2. Рассмотреть явление
- 3. Жидкости диэлектрики- дистиллированная вода проводники- растворы и расплавы электролитов: кислот, щелочей и солей полупроводники –расплавленный селен,
- 4. Электролиты – это вещества, растворы и расплавы которых обладают ионной проводимостью.
- 5. Почему при растворении в воде твердый полярный диэлектрик становится проводником электрического тока? Рассмотрим процесс растворения в
- 6. Электрическая диссоциация – распад молекул электролита на положительные и отрицательные ионы под действием эл.поля полярных молекул
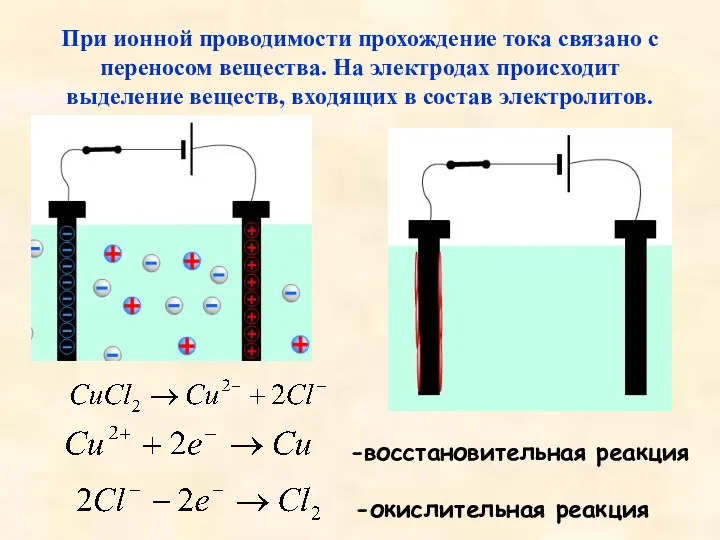
- 7. При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение веществ, входящих в
- 8. Процесс выделения на электродах вещества, связанный с окислительно-востановительной реакцией – называется электролизом. Явление электролиза было открыто
- 9. От чего зависит масса вещества, выделившегося на электродах за определённое время? Закон электролиза (Закон Фарадея). Открыт
- 11. Масса вещества, выделившегося на электроде за время Δt при прохождении электрического тока, прямопропорциональна силе тока и
- 12. - постоянная Фарадея F= 9,65 *10-4 Кл/моль Физ.смысл F- численно равна заряду, который надо пропустить через
- 13. Применение электролиза в технике: ГальваностегияГальваностегия- декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование,
- 14. гальваническое наращивания тонкого слоя Алмазный инструмент, изготовленный методом гальваностегии
- 15. Венцы, чеканка, камни, золочение
- 16. Итог урока. Д/з §113, стр.388 № 8,9 Проверочная работа https://quizizz.com/join?gc=481839
- 17. Задача №12 стр.388
- 21. Скачать презентацию







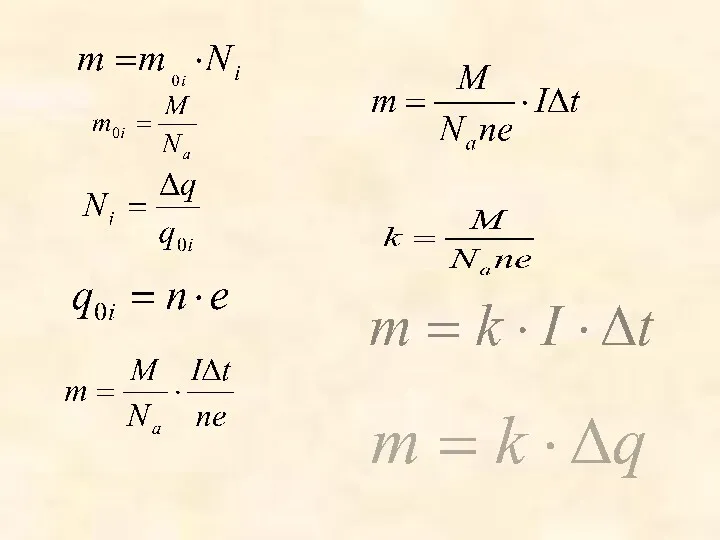









 Low-momentum K/π identification for τ/c factories
Low-momentum K/π identification for τ/c factories Звуковые волны. 9 класс
Звуковые волны. 9 класс Линзы. Урок 62. Изображения, даваемые линзой
Линзы. Урок 62. Изображения, даваемые линзой Детали цилиндро-поршневой группы
Детали цилиндро-поршневой группы Расчет давления жидкости на дно и стенки сосуда
Расчет давления жидкости на дно и стенки сосуда Турбомашиналардың желіде бірге жұмыс істеуі. Турбомашиналардың паралель жұмыс істеуі бір
Турбомашиналардың желіде бірге жұмыс істеуі. Турбомашиналардың паралель жұмыс істеуі бір Общие сведения о колебаниях. Тема 1
Общие сведения о колебаниях. Тема 1 Элементы специальной теории относительности. Релятивистская динамика
Элементы специальной теории относительности. Релятивистская динамика Материалық нүктенің динамикасы
Материалық нүктенің динамикасы Пневмотранспорт, виды и применение. Достоинства и недостатки. Тема 14
Пневмотранспорт, виды и применение. Достоинства и недостатки. Тема 14 Интерференция.
Интерференция. Техническое обслуживание и ремонт автотранспорта. Устройство автомобилей
Техническое обслуживание и ремонт автотранспорта. Устройство автомобилей Введение в тепловое моделирование
Введение в тепловое моделирование Фотоэффект
Фотоэффект Техническое обслуживание и ремонт ходовой части автомобилей
Техническое обслуживание и ремонт ходовой части автомобилей Моделі активних компонентів. Джерело напруги та джерело струму
Моделі активних компонентів. Джерело напруги та джерело струму Ремонт автомобилей. Дефектация и сортировка деталей. (Тема 2.3)
Ремонт автомобилей. Дефектация и сортировка деталей. (Тема 2.3) Явление электромагнитной индукции. (лекция 3б)
Явление электромагнитной индукции. (лекция 3б) Как громкость звука зависит от расстояния
Как громкость звука зависит от расстояния ВКР: Проект поста по ремонту кузовов легковых автомобилей
ВКР: Проект поста по ремонту кузовов легковых автомобилей Равновесие тел
Равновесие тел Молекулярная физика и основы термодинамики
Молекулярная физика и основы термодинамики Урок по теме: Функциональная зависимость
Урок по теме: Функциональная зависимость Барабанные сепараторы
Барабанные сепараторы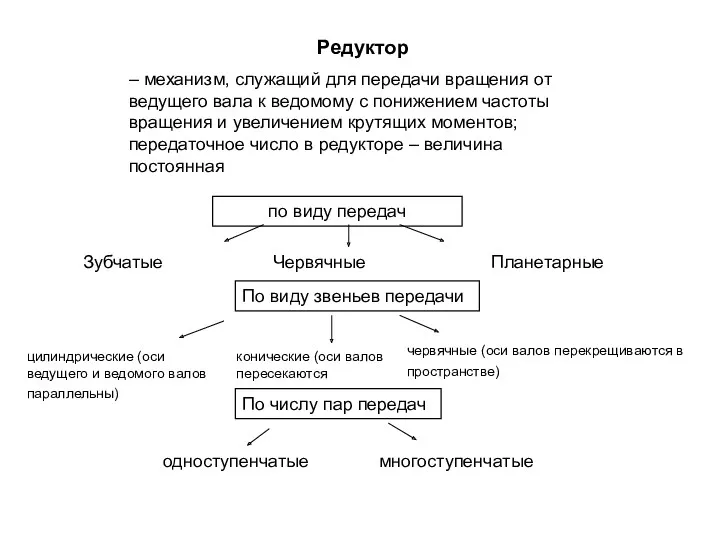 Редукторы по виду передач, по виду звеньев передачи, по числу пар передач
Редукторы по виду передач, по виду звеньев передачи, по числу пар передач Инерция. Какое движение называется механическим?
Инерция. Какое движение называется механическим? Основы теории четырёхполюсников. Теория электрических цепей. Лекция №10
Основы теории четырёхполюсников. Теория электрических цепей. Лекция №10 Описание технологического процесса изготовления и контроля детали Штуцер
Описание технологического процесса изготовления и контроля детали Штуцер