Содержание
- 2. План лекции Основные понятия электрохимии. 2. Гальванический элемент, его ЭДС. 3. Коррозия. 4. Электролиз, законы электролиза.
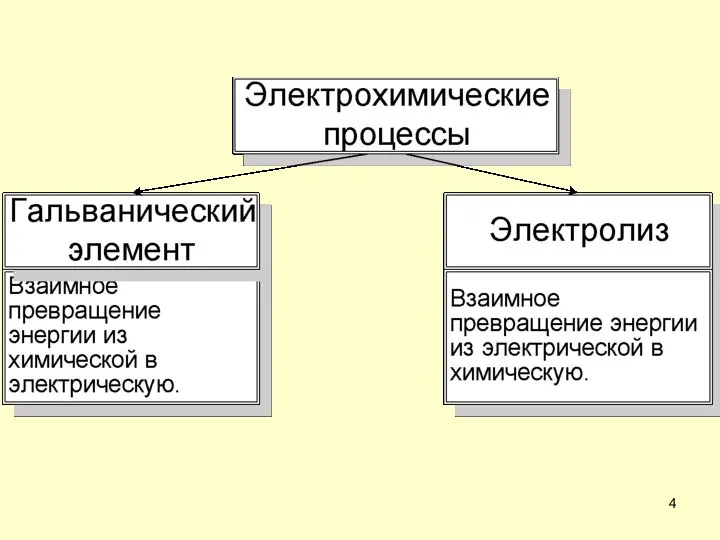
- 3. 1.Основные понятия электрохимии Электрохимические процессы – процессы взаимного превращения электрической формы энергии в химическую.
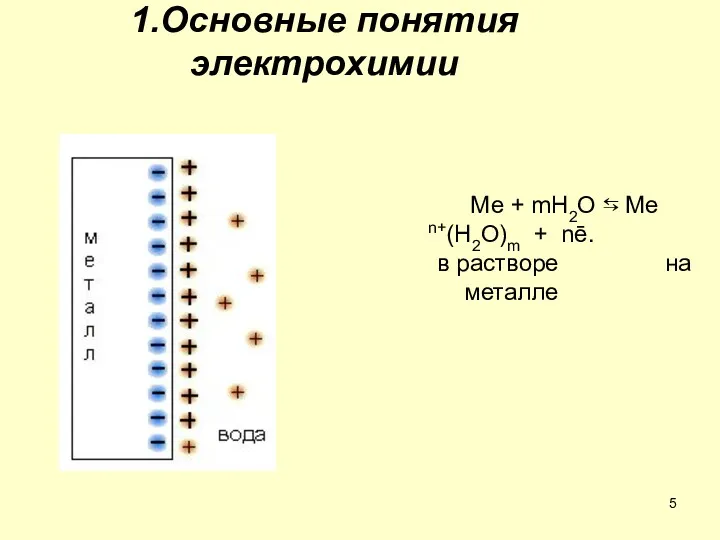
- 5. 1.Основные понятия электрохимии Ме + mH2O ⇆ Me n+(H2O)m + nē. в растворе на металле
- 6. 1.Основные понятия электрохимии Электродный потенциал – φ – cкачок потенциалов, возникающий на границе раздела металл −
- 7. Электродный потенциал зависит: От природы металла; 2) От концентрации раствора; 3) От температуры.
- 8. Стандартный электродный потенциал – φ°(Men+/Me) – потенциал, измеренный при стандарт-ных условиях T=298 и [Mеn+] =1 моль/л,
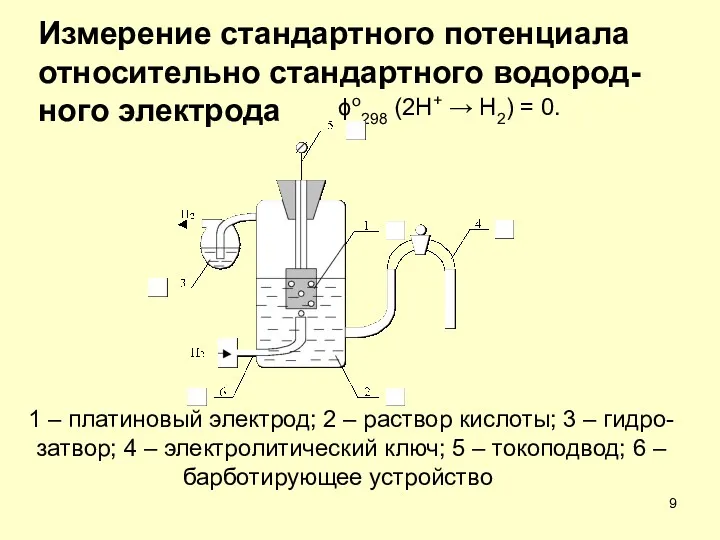
- 9. ϕо298 (2Н+ → Н2) = 0. Измерение стандартного потенциала относительно стандартного водород-ного электрода 1 – платиновый
- 10. Н.Н.Бекетов Электрохимический ряд напряжения металлов Li, K, Ba, Na, Mg, Al, Ti, Mn, Zn, Cr, Fe,Cd,
- 11. Уравнение Нернста φ (Men+/Me) = φ0(Men+/Me)+RT/nF ln [Men+] (1) где ϕ 0(Men+/Me) − стандартный электродный потенциал
- 12. Уравнение Нернста (2)
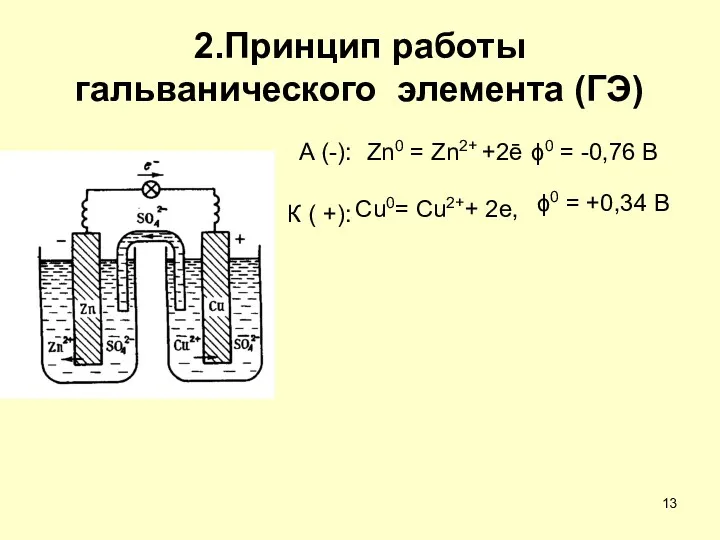
- 13. 2.Принцип работы гальванического элемента (ГЭ) Zn0 = Zn2+ +2ē ϕ0 = -0,76 В Cu0= Cu2++ 2e,
- 14. Схема ГЭ (−) Zn⏐ZnSO4║CuSO4⏐Cu (+) Zn0 + Cu2+ = Zn2+ + Cu А (-): Zn0 -2e
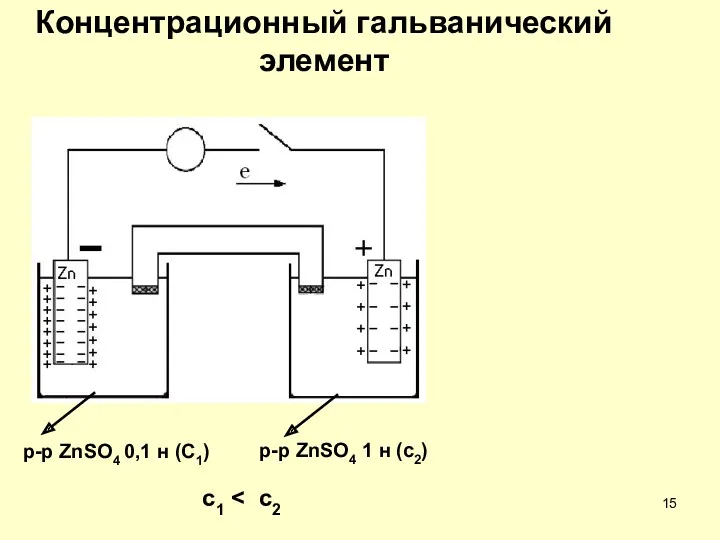
- 15. Концентрационный гальванический элемент p-p ZnSO4 0,1 н (C1) p-p ZnSO4 1 н (c2) c1
- 16. Электродвижущая сила – ЭДС – – максимальная разность потенциалов электродов данного ГЭ в условиях рав-новесия, определяется:
- 17. Если ЭДС > 0, то реакция возможна. Если ЭДС ΔG = −n⋅F⋅ЭДС (4) Связь энергии Гиббса
- 18. 1.Расчет ЭДС концентрационных элементов. 2.Принцип работы аккумуляторов Отчет на практическом занятии. Вопросы для самостоятельного изу- чения:
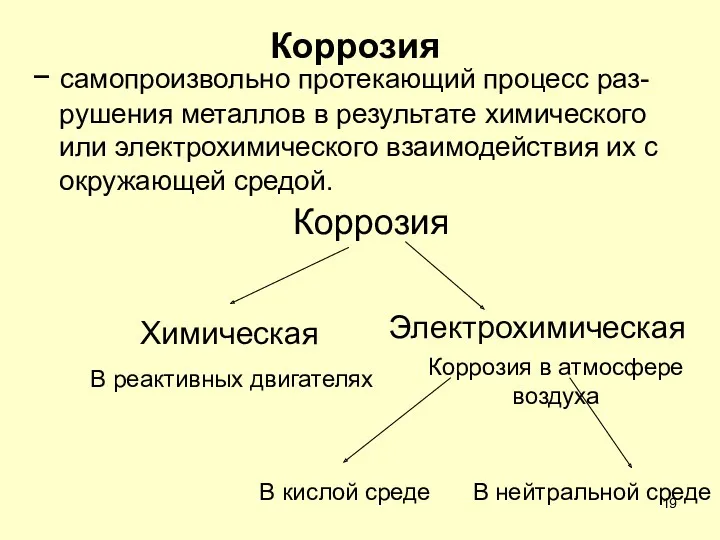
- 19. Коррозия − самопроизвольно протекающий процесс раз-рушения металлов в результате химического или электрохимического взаимодействия их с окружающей
- 20. 1.Коррозия с водородной деполяризацией (кислая среда) А(-): Zn0 − 2ē= Zn2+ К(+): 2H+ + 2ē =
- 21. 2. Коррозия с кислородной деполяризацией(нейтральная среда) А(-): Fe0 − 2ē= Fe2+ K(+): 2H2O + O2 +
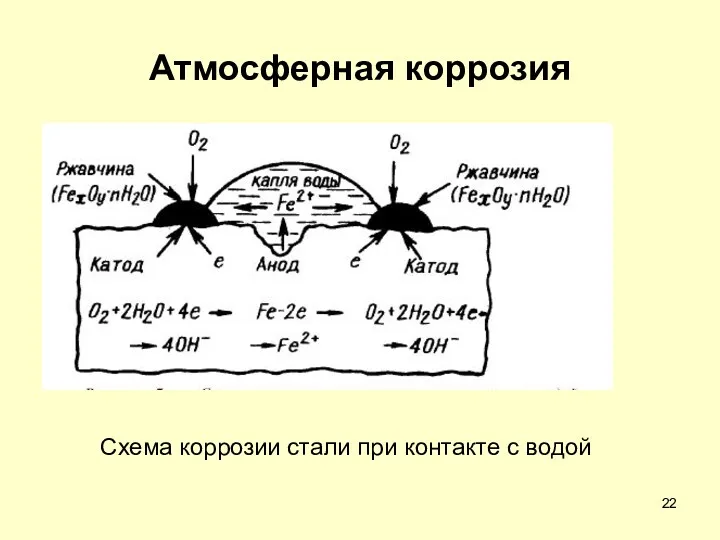
- 22. Атмосферная коррозия Схема коррозии стали при контакте с водой
- 23. Электролиз лиз – разложение – ОВР, протекающие на электродах при пропускании электрического тока через раствор или
- 25. Электролиз расплава хлорида кадмия CdCl2 → Cd2+ + 2Cl− Cd2++2Сl- → Cd0 + Cl20 Катод(-): Анод(+):
- 26. Последовательность электродных процессов при электролизе раствора Катодные процессы 1. Катионы металлов, стоящих в ряду напряжений до
- 27. Последовательность электродных процессов при электролизе раствора Анодные процессы 1. Простые анионы Cl−, Br−, S2− и др.
- 28. Электролиз раствора сульфата натрия Na2SO4 + H2O А(+): K(-): Na+ + ē = Na0 ; ϕ0
- 29. Законы электролиза Законы Фарадея (1833) 1. Масса электролита, подвергшаяся пре- вращению при электролизе, а также мас-сы
- 30. Законы электролиза где m − масса выделившегося или подвергшего- ся превращению вещества (г), МЭК − эквивалентая
- 33. Скачать презентацию






![Уравнение Нернста φ (Men+/Me) = φ0(Men+/Me)+RT/nF ln [Men+] (1) где](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/253813/slide-10.jpg)















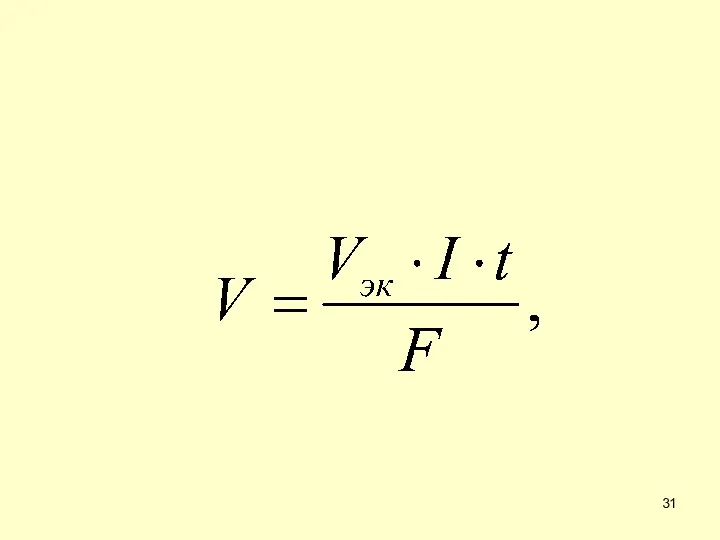
 Ультрафиолетовое излучение
Ультрафиолетовое излучение Методы определения скорости света
Методы определения скорости света Физико-химические методы анализа. Хроматография
Физико-химические методы анализа. Хроматография Саївський НВК Фізика-8
Саївський НВК Фізика-8 Ядерные силы. Энергия связи. Дефект масс
Ядерные силы. Энергия связи. Дефект масс Действие магнитного поля на заряженные частицы. Сила Лоренца
Действие магнитного поля на заряженные частицы. Сила Лоренца Холодильники
Холодильники Рычаг. Момент силы. Условие равновесия рычага
Рычаг. Момент силы. Условие равновесия рычага ГАЗель Next c двигателем Monoturbo VW EA189
ГАЗель Next c двигателем Monoturbo VW EA189 Invent yourself
Invent yourself Закон Ома для полной цепи
Закон Ома для полной цепи Флюксметр
Флюксметр Обработка экспериментальных данных. Часть 2
Обработка экспериментальных данных. Часть 2 плоское зеркало
плоское зеркало Интерференция света. (Лекция 11)
Интерференция света. (Лекция 11) Аберрации оптической системы глаза
Аберрации оптической системы глаза Автомеханік
Автомеханік Қатты дененің динамикасы
Қатты дененің динамикасы Люминесценция
Люминесценция Валы и оси
Валы и оси Презентация к уроку физики 7класс по теме Давление. Способы изменения давления
Презентация к уроку физики 7класс по теме Давление. Способы изменения давления Нейтронная активность
Нейтронная активность разработка урока 11 класс физика Волновые явления
разработка урока 11 класс физика Волновые явления Поверхностное натяжение жидкости
Поверхностное натяжение жидкости Тепловое излучение
Тепловое излучение Давление твёрдых тел. Урок-исследование. Закрепление знаний
Давление твёрдых тел. Урок-исследование. Закрепление знаний Электрический ток
Электрический ток М.В.Ломоносов
М.В.Ломоносов