Содержание
- 2. Аналитическая химия - 1 План лекций Основные понятия Классификация методов История Хроматографические параметры Теоретические основы Основные
- 3. Аналитическая химия - 1 Рекомендуемые учебники КАЗАНСКИЙ (ПРИВОЛЖСКИЙ) ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ ------------------------------------------------ Химический институт им.А.М.Бутлерова ОСНОВЫ ХРОМАТОГРАФИИ
- 4. Аналитическая химия - 1 УНИВЕРСАЛЬНОСТЬ, ЭКСПРЕССНОСТЬ, ЧУВСТВИТЕЛЬНОСТЬ
- 5. Аналитическая химия - 1 Основные понятия Хроматография (Х) – динамический метод разделения и анализа смесей веществ,
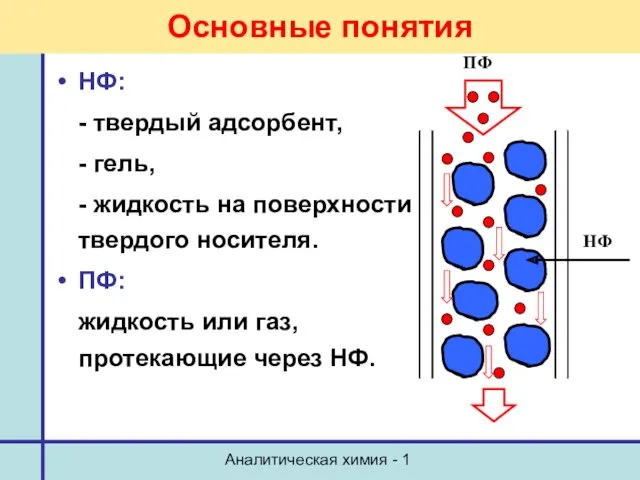
- 6. Аналитическая химия - 1 Основные понятия НФ: - твердый адсорбент, - гель, - жидкость на поверхности
- 7. Аналитическая химия - 1 Хроматограмма – внутренняя (полосы вдоль колонки) и внешняя (графическое изображение распределения веществ
- 8. Аналитическая химия - 1 Классификация По способу перемещения сорбатов вдоль слоя сорбента: элюентный (проявительный) вытеснительный методы
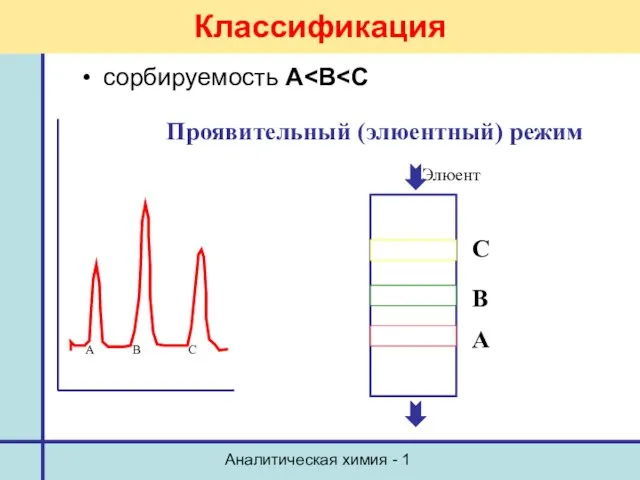
- 9. Аналитическая химия - 1 Классификация сорбируемость А Проявительный (элюентный) режим
- 10. Аналитическая химия - 1 Классификация сорбируемость А Вытеснительный режим
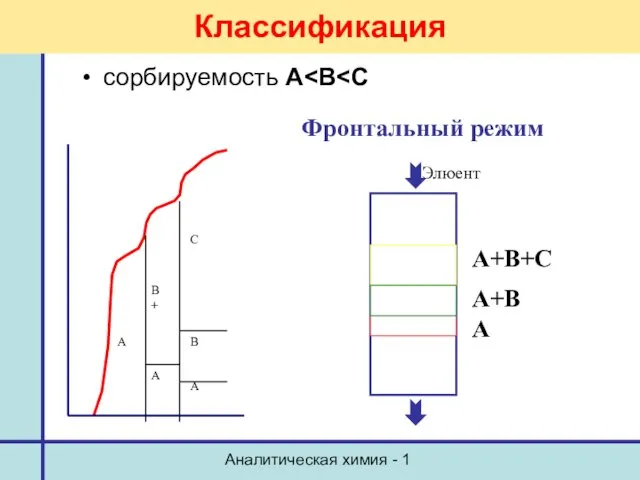
- 11. Аналитическая химия - 1 Классификация сорбируемость А Фронтальный режим
- 12. Аналитическая химия - 1 Классификация По природе процесса, обусловливающего распределение сорбатов между ПФ и НФ: Адсорбционная
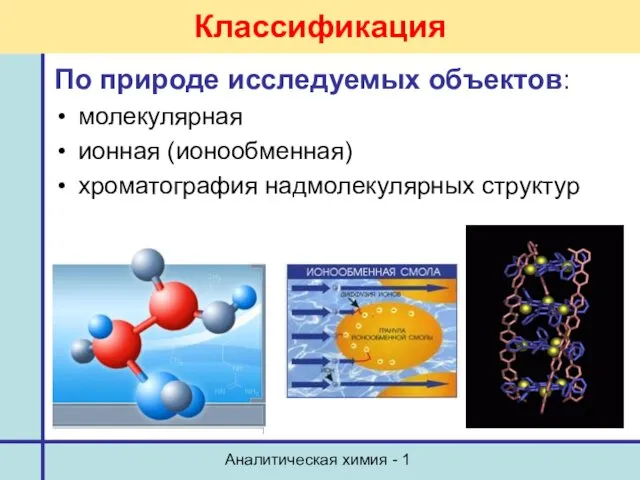
- 13. Аналитическая химия - 1 Классификация По природе исследуемых объектов: молекулярная ионная (ионообменная) хроматография надмолекулярных структур
- 14. Аналитическая химия - 1 Классификация По технике выполнения: колоночная препаративная насадочная капиллярная плоскостная бумажная тонкослойная
- 15. Аналитическая химия - 1 Классификация По цели хроматографирования: аналитическая - качественный и количественный анализ неаналитическая -
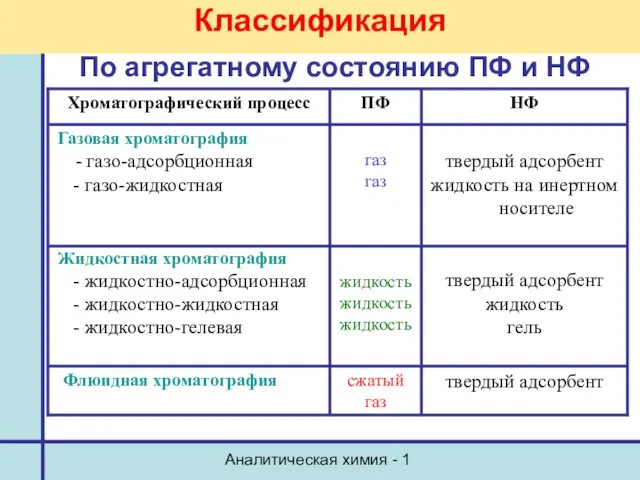
- 16. Аналитическая химия - 1 Классификация По агрегатному состоянию ПФ и НФ
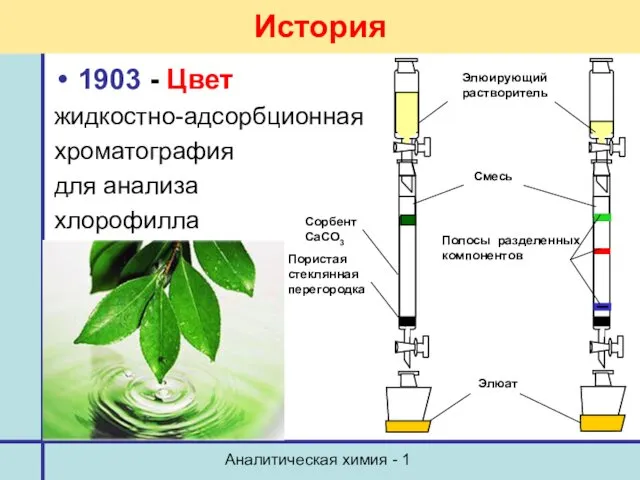
- 17. Аналитическая химия - 1 История 1903 - Цвет жидкостно-адсорбционная хроматография для анализа хлорофилла Элюирующий растворитель Полосы
- 18. Аналитическая химия - 1 Общие принципы хроматографического разделения Коэффициент распределения D соединения А зависит от его
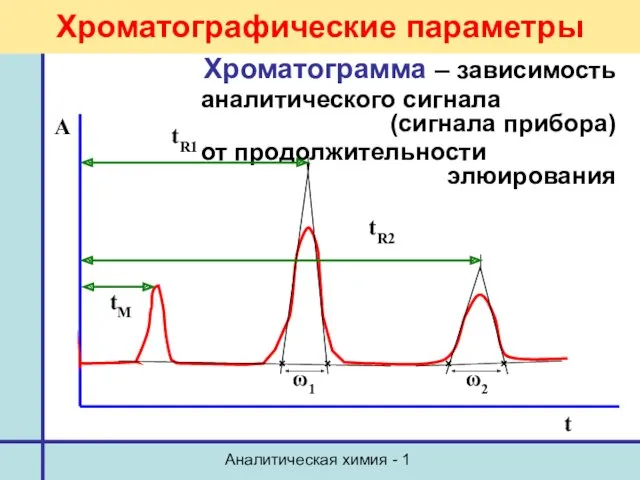
- 19. Аналитическая химия - 1 Хроматографические параметры Хроматограмма – зависимость аналитического сигнала (сигнала прибора) от продолжительности элюирования
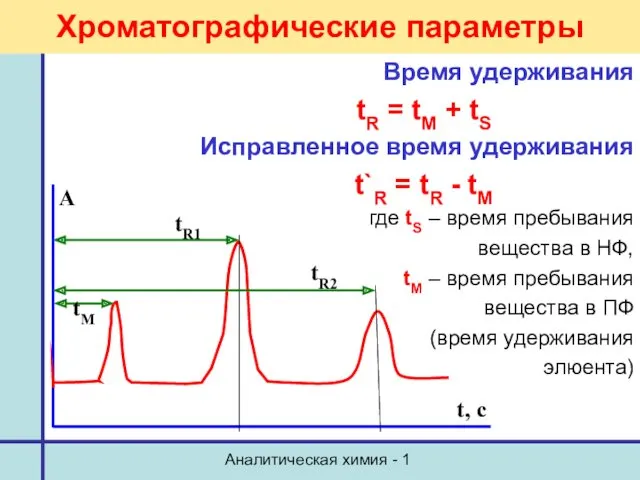
- 20. Аналитическая химия - 1 Хроматографические параметры Время удерживания tR = tM + tS Исправленное время удерживания
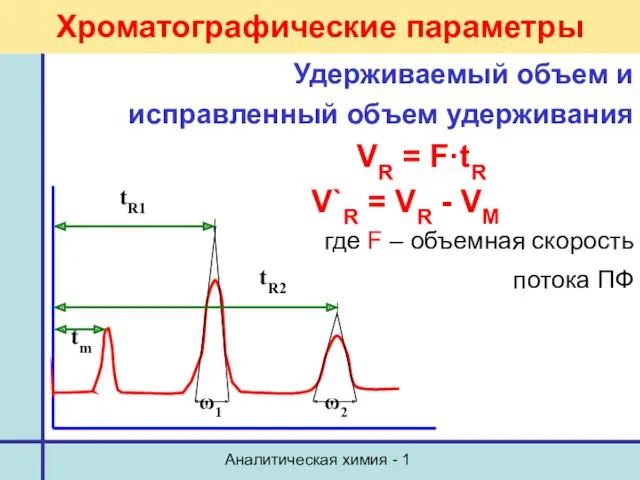
- 21. Аналитическая химия - 1 Хроматографические параметры Удерживаемый объем и исправленный объем удерживания VR = F·tR V`R
- 22. Аналитическая химия - 1 Хроматографические параметры Коэффициент удерживания (замедления) R = tM/tR = 1/(1+ tS/tM) =
- 23. Аналитическая химия - 1 Хроматографические параметры Коэффициент ёмкости k` = t`R/tM = DVS/VM 1.5
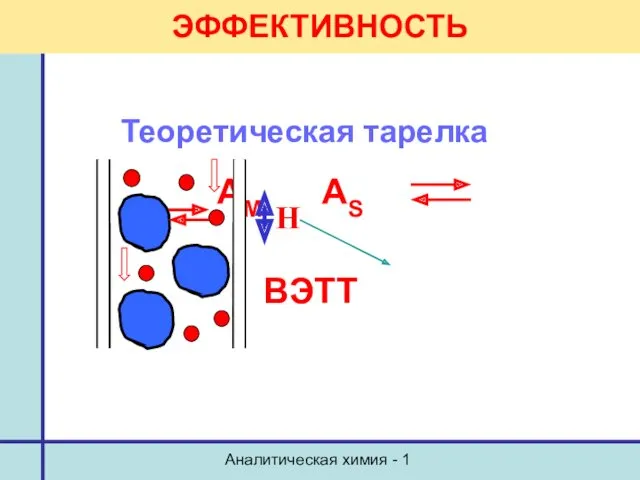
- 24. Аналитическая химия - 1 ЭФФЕКТИВНОСТЬ Теоретическая тарелка АM AS ВЭТТ
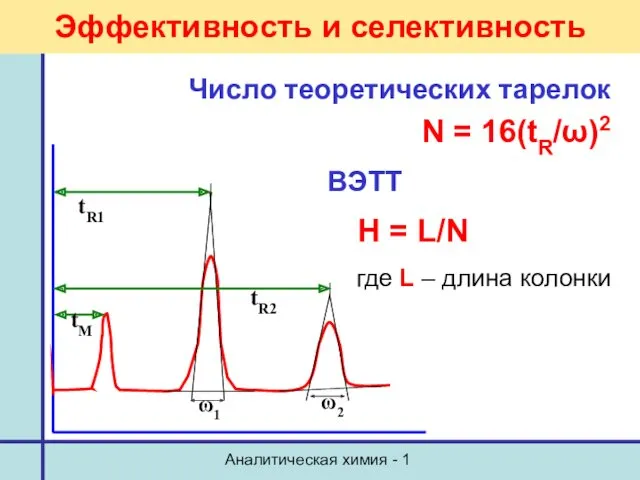
- 25. Аналитическая химия - 1 Эффективность и селективность Число теоретических тарелок N = 16(tR/ω)2 ВЭТТ Н =
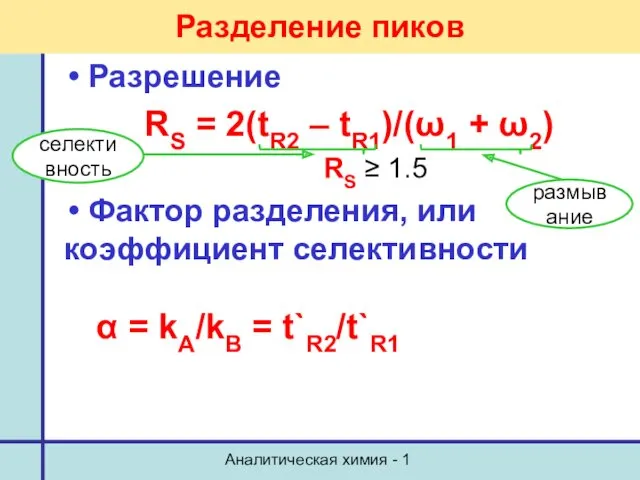
- 26. Аналитическая химия - 1 Разделение пиков Разрешение RS = 2(tR2 – tR1)/(ω1 + ω2) RS ≥
- 27. Аналитическая химия - 1 Эффективность и селективность Зависимость разрешения от коэффициента ёмкости, селективности и числа теоретических
- 28. Аналитическая химия - 1 Эффективность и селективность 1 2 3
- 29. Аналитическая химия - 1 Качественный анализ Времена удерживания Корреляционные зависимости параметров удерживания - зависимость времени удерживания
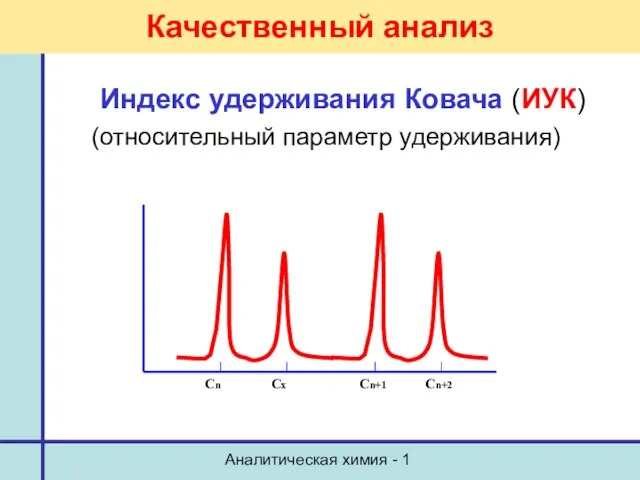
- 30. Аналитическая химия - 1 Качественный анализ Индекс удерживания Ковача (ИУК) (относительный параметр удерживания)
- 31. Аналитическая химия - 1 Качественный анализ Индекс удерживания Ковача (ИУК) In = 100n t`Rn (lgt`Rx –
- 32. Аналитическая химия - 1 Количественный анализ По площади или высоте хроматографического пика S = f (C)
- 33. Аналитическая химия - 1 Количественный анализ Методы количественного анализа Метод нормировки Метод абсолютной калибровки Метод внутреннего
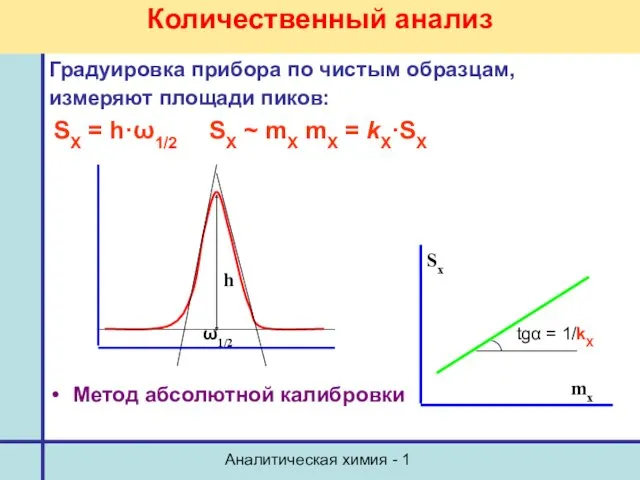
- 34. Аналитическая химия - 1 Количественный анализ Градуировка прибора по чистым образцам, измеряют площади пиков: SX =
- 35. Аналитическая химия - 1 Количественный анализ Метод внутренней нормализации (нормировки) Х% = 100·SX/ST Метод внутреннего стандарта.
- 36. Аналитическая химия - 1 Физическая адсорбция. Происходит за счет - сил Ван-дер-Ваальса, - водородных связей, -
- 37. Аналитическая химия - 1 Неполярный на неполярном – за счет дисперсионных сил притяжения и отталкивания Полярный
- 38. Аналитическая химия - 1 Сорбционные свойства сорбента зависят от: - удельной поверхности, - пористости, - структуры
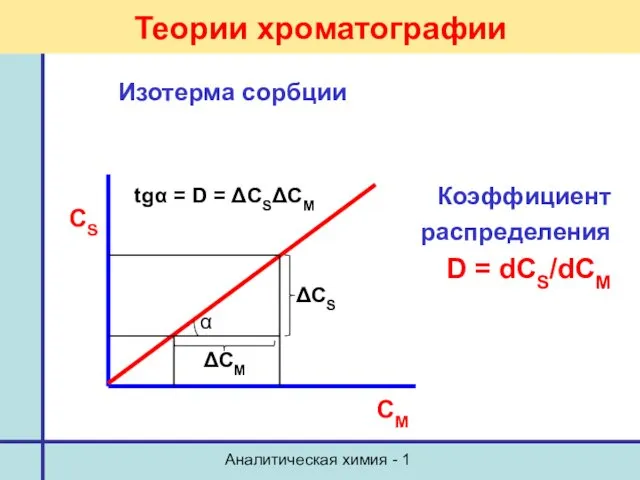
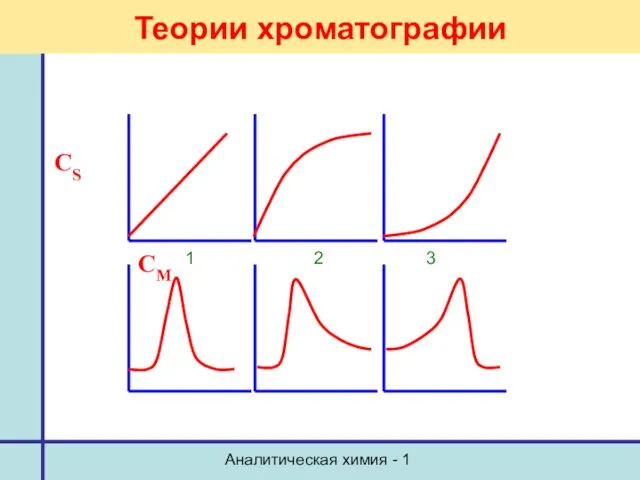
- 39. Аналитическая химия - 1 Теории хроматографии Изотерма сорбции Коэффициент распределения D = dCS/dCM tgα = D
- 40. Аналитическая химия - 1 Теории хроматографии CS CM
- 41. Аналитическая химия - 1 Теории хроматографии ТЕОРИЯ ТЕОРЕТИЧЕСКИХ ТАРЕЛОК - колонка состоит из определенного числа ТТ
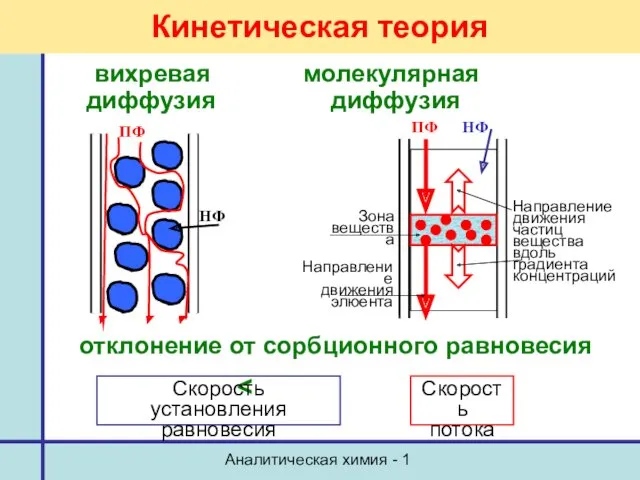
- 42. Аналитическая химия - 1 Кинетическая теория Кинетические параметры: - объемная скорость ПФ, - диаметр частиц сорбента,
- 43. Аналитическая химия - 1 Теории хроматографии. Кинетическая Уравнение Ван-Деемтера H = A + B/v + Cv
- 44. Аналитическая химия - 1 вихревая молекулярная диффузия диффузия отклонение от сорбционного равновесия Кинетическая теория Скорость установления
- 46. Скачать презентацию

























 Термодинамика. Теплота
Термодинамика. Теплота Еркін және еріксіз тербелістер. Резонанс
Еркін және еріксіз тербелістер. Резонанс Понятие о технической системе. 6 класс
Понятие о технической системе. 6 класс Урок по теме: Функциональная зависимость
Урок по теме: Функциональная зависимость Medbiophysics as a branch of applied physics. Mechanical vibrations in the medical applications
Medbiophysics as a branch of applied physics. Mechanical vibrations in the medical applications Построение и применение комплексов радиорелейной, тропосферной, спутниковой связи
Построение и применение комплексов радиорелейной, тропосферной, спутниковой связи Силы в природе, законы Ньютона
Силы в природе, законы Ньютона Электростатическое поле в вакууме
Электростатическое поле в вакууме Рулевое управление
Рулевое управление Катушки со сталью в цепи синусоидального тока
Катушки со сталью в цепи синусоидального тока Биологическое действие радиации. Закон радиоактивного распада
Биологическое действие радиации. Закон радиоактивного распада Заттың тығыздығы
Заттың тығыздығы Центр тяжести
Центр тяжести Устойчивость элементов конструкций
Устойчивость элементов конструкций Электрические однофазные цепи синусоидального тока
Электрические однофазные цепи синусоидального тока Курс лекций по сопротивлению материалов (11- 18)
Курс лекций по сопротивлению материалов (11- 18) Электрическое поле в диэлектрике
Электрическое поле в диэлектрике 1. Строение атома
1. Строение атома Газды разряд түрлері
Газды разряд түрлері Литография. Виды литографии
Литография. Виды литографии Эксперимент на уроках физики в основной школе как средство формирования УУД
Эксперимент на уроках физики в основной школе как средство формирования УУД Параметри електричних ланцюгів змінного струму
Параметри електричних ланцюгів змінного струму Законы сохранения в механике
Законы сохранения в механике Электрический ток в различных средах
Электрический ток в различных средах Незаметная бутылка. Эксперимент
Незаметная бутылка. Эксперимент Сдвиг и кручение. Закон Гука при сдвиге. Условие прочности при чистом сдвиге
Сдвиг и кручение. Закон Гука при сдвиге. Условие прочности при чистом сдвиге Кран вспомогательного тормоза №254
Кран вспомогательного тормоза №254 Строительство и эксплуатация зданий и сооружений. Техническая механика
Строительство и эксплуатация зданий и сооружений. Техническая механика