Из второго начала термодинамики вытекает невозможность создания вечного двигателя второго рода,
принцип действия которого основан на полном преобразовании теплоты в работу. Идея такого источника полезной работы или энергии заключается в использовании внутренней энергии, содержащейся в природных телах (воздухе, воде, почве и т.д.), для совершения механической работы. Далее, после совершения полезной работы и перехода ее в теплоту за счет тех или иных диссипативных процессов, внутренняя энергия природных тел восстанавливается, и термодинамический цикл замыкается. Возможность функционирования вечного двигателя второго рода не противоречит закону сохранения энергии (первому началу термодинамики), но запрещается вторым началом термодинамики.
Примером технического устройства, использующего для совершения полезной работы внутреннюю энергию природных тел, может служить гидроэлектростанция. Для получения полезной работы в данном случае используется естественный процесс испарения воды с поверхности Земли и последующей её конденсации в атмосфере. Хотя этот природный процесс кругооборота воды и происходит непрерывно, для его поддержания необходим постоянный приток энергии от Солнца. Поэтому, если в термодинамическую систему кроме гидроэлектростанции и атмосферы Земли включить ещё и Солнце, то для такой расширенной термодинамической системы второе начало термодинамики будет выполняться.
















 Електрика: промислова, статична і атмосферна
Електрика: промислова, статична і атмосферна Ремонт автомобилей. Техническое нормирование ремонтных (ручных) работ. (Тема 5.3)
Ремонт автомобилей. Техническое нормирование ремонтных (ручных) работ. (Тема 5.3) Сила. Явление тяготения. Сила тяжести. Что такое сила?
Сила. Явление тяготения. Сила тяжести. Что такое сила?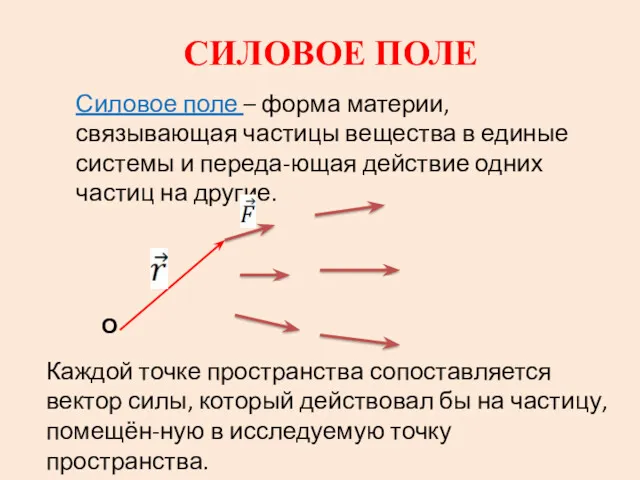 Силовое поле
Силовое поле Презентация Гелиоцентрическая система мира
Презентация Гелиоцентрическая система мира Механічні та електромагнітні хвилі
Механічні та електромагнітні хвилі Теориялық механика
Теориялық механика Аккумуляторы для крупномасштабного хранения энергии. Лекция 8
Аккумуляторы для крупномасштабного хранения энергии. Лекция 8 Тепловые двигатели и охрана окружающей среды
Тепловые двигатели и охрана окружающей среды Контактные явления. Контакт металл - полупроводник
Контактные явления. Контакт металл - полупроводник Влажность воздуха.
Влажность воздуха. Динамика материальной точки
Динамика материальной точки Тема урока: Влажность воздуха
Тема урока: Влажность воздуха Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Изобретение радио. Принцип радиосвязи.
Изобретение радио. Принцип радиосвязи. решение задач на давление в жидкости
решение задач на давление в жидкости Причіпні пожежні мотопомпи. Експлуатація мотопомп
Причіпні пожежні мотопомпи. Експлуатація мотопомп Магнітне поле. Сила Ампера
Магнітне поле. Сила Ампера Работа и мощность электрического тока. 8 класс
Работа и мощность электрического тока. 8 класс През.ЮА.МС11-21
През.ЮА.МС11-21 Электрические цепи переменного тока. Лекция 2
Электрические цепи переменного тока. Лекция 2 Анимации на уроках физики.
Анимации на уроках физики.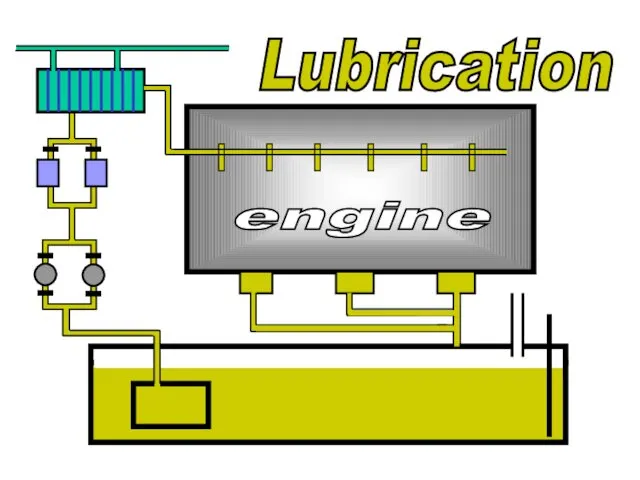 Lubrication
Lubrication Простые механизмы
Простые механизмы Урок-соревнование по физике в VIII классе по теме Тепловые явления +презентация
Урок-соревнование по физике в VIII классе по теме Тепловые явления +презентация Різновиди механізмів натиску листових друкарських машин
Різновиди механізмів натиску листових друкарських машин Моделирование процессов термомодифицирования древесины
Моделирование процессов термомодифицирования древесины Сборочные чертежи. Виды соединений деталей
Сборочные чертежи. Виды соединений деталей