Содержание
- 2. Общая теория относительности (гравитационная теория) была создана Эйнштейном в 1916 г. Она позволила рассматривать не только
- 3. Основные идеи ОТО Пространство и время зависят не только от движения тела по отношению к наблю-
- 4. Кривизна пространства измеряется отклонением от классических правил геометрии Евклида В геометрии Евклида сумма углов треугольника составляет
- 5. Движение тел в искривленном пространстве Движение тела по инерции в поле тяготе- ния массивных тел рассматривается
- 6. В рамках ОТО Эйнштейном была установлена эквивалентность между инертной и гравитационной массами, между массой и энергией
- 7. Методологические последствия зарождения релятивистской картины мира Главным концептуальным изменением естествознания XX в. был отказ от ньютоновской
- 8. КВАНТОВО-ПОЛЕВАЯ КАРТИНА МИРА В 1900 г. немецкий физик Макс Планк экспериментально показал, что электромагнитное излучение происходит
- 9. Опираясь на идеи Планка, Эйнштейн предложил теорию света, согласно которой свет есть поток движущихся квантов -
- 10. Противоречия планетарной теории строения атома водорода (1913 г. датский физик Нильс Бор). 1. Любая заряженная частица,
- 11. Постулаты Бора 1. Каждый электрон в атоме может совершать устойчивое орбитальное движение по определенной орбите, не
- 12. Сочетание волновых и корпускулярных свойств является фундаментальным свойством материи и присуще не только фотону, но и
- 13. В 1927 году Гейзенберг пришел к выводу о невозможности одновременного точного измерения координаты частицы и ее
- 14. В 1926 году немецкий физик В. Гейзенберг (1901-1976) впервые высказал основные положения квантовой механики. При их
- 15. Квантовая механика Шрёдингера Э. Шрёдингер (1887-1961), используя гипотезу де Бройля разработал в 1926 г. волновую (квантовую)
- 16. Уравнение Шредингера Уравнение Шредингера - квантово-механический эквивалент уравнения классической механики: Еполн.= Екин.+ Епот. = p2/2m +
- 17. Соответствие квантовомеханических величин механическим Импульсу частицы в квантовой механике соответствует: Оператор «набла» означает дифференцирование функции по
- 18. Соответствие квантовомеханических величин механическим Епот Λ Епот.∙Ψ (умножение волновой функции на «классическое» выражение для потенциальной энергии.
- 19. Квантовомеханический аналог уравнения для полной энергии Суммируем части соответствующие кинетической и потенциальной энергиям:
- 20. Оператор Гамильтониан (H)
- 21. Уравнение Шрёдингера для стационарных состояний
- 22. Квантовомеханическая модель атома Решение уравнения Шрёдингера для водорода позволило сделать выводы: Распределение электронов в атомах по
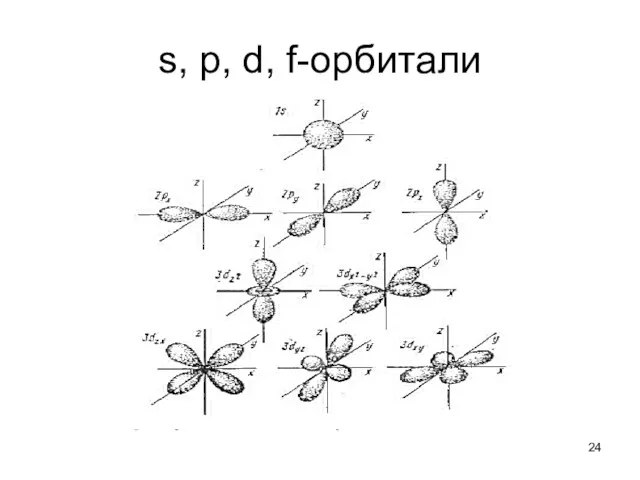
- 23. Атомная орбиталь Волновая функция, описывающая состояние электрона в атоме, и полностью характеризуемая конкретными значениями квантовых чисел
- 24. s, p, d, f-орбитали
- 25. Распределение электронов по орбиталям в многоэлектронном атоме Принцип минимума энергии. Правило Клечковского (заполнение орбиталей от меньших
- 26. Объяснение расположения элементов в таблице Д.И. Менделеева
- 27. Теория молекулярного строения вещества Состояние молекул также описывается уравнениями Шрёдингера – для электронов и ядер. Уравнение
- 28. Последствия развития квантовой механики Появление и совершенствование новой экспериментальной техники и новых теоретических методов исследования строения
- 30. Скачать презентацию


























 КОМПЬЮТЕРНАЯ ПРЕЗЕНТАЦИЯ МЕТОДИЧЕСКОЙ РАЗРАБОТКИ ТЕМЫ СВЕТОВЫЕ ЯВЛЕНИЯ РАЗДЕЛА ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫОСНОВНОЙ ШКОЛЫ
КОМПЬЮТЕРНАЯ ПРЕЗЕНТАЦИЯ МЕТОДИЧЕСКОЙ РАЗРАБОТКИ ТЕМЫ СВЕТОВЫЕ ЯВЛЕНИЯ РАЗДЕЛА ОБРАЗОВАТЕЛЬНОЙ ПРОГРАММЫОСНОВНОЙ ШКОЛЫ Бағытталған максимальді ток қорғанысы
Бағытталған максимальді ток қорғанысы Молекулярно-кинетическая теория
Молекулярно-кинетическая теория Рычаг. Момент силы. Условие равновесия рычага
Рычаг. Момент силы. Условие равновесия рычага Электрическая емкость. Конденсаторы. Соединение конденсаторов. Расчет емкостей различных конденсаторов
Электрическая емкость. Конденсаторы. Соединение конденсаторов. Расчет емкостей различных конденсаторов Виготовлення наглядового стенду з будови, технічного обслуговування та ремонту коробки змінних передач автомобіля ВАЗ-2101
Виготовлення наглядового стенду з будови, технічного обслуговування та ремонту коробки змінних передач автомобіля ВАЗ-2101 Электромагнитные волны. Электромагнитные колебания. Понятие об электромагнитном поле
Электромагнитные волны. Электромагнитные колебания. Понятие об электромагнитном поле Модель атома. Опыт Резерфорда
Модель атома. Опыт Резерфорда Взаимодействие заряженных частиц со средой
Взаимодействие заряженных частиц со средой Сравнительный анализ бензиновых и дизельных двигателей
Сравнительный анализ бензиновых и дизельных двигателей Строение атома и атомного ядра. Использование энергии атомных ядер
Строение атома и атомного ядра. Использование энергии атомных ядер Интеллектуальная игра по физике Физбой (8 класс)
Интеллектуальная игра по физике Физбой (8 класс) Электромагнитные явления. Магнитное поле и его свойства. (8 класс)
Электромагнитные явления. Магнитное поле и его свойства. (8 класс) Увеличение мощности автомобильного двигателя
Увеличение мощности автомобильного двигателя Введение в тепломассообмен
Введение в тепломассообмен Роль фізики в нашому житті
Роль фізики в нашому житті Классификация станков
Классификация станков Внутреннее строение звезд
Внутреннее строение звезд Физические основы магнитного метода контроля
Физические основы магнитного метода контроля Аморфные вещества и жидкие кристалы
Аморфные вещества и жидкие кристалы Растворы
Растворы Physics of Semiconductor Devices
Physics of Semiconductor Devices Фундаментальные взаимодействия
Фундаментальные взаимодействия Сұйықтық және газ механикасы пәні
Сұйықтық және газ механикасы пәні Основы управления денежными средствами компании
Основы управления денежными средствами компании Частицы и взаимодействия
Частицы и взаимодействия Робота і потужність електричного струму
Робота і потужність електричного струму источники света
источники света