Содержание
- 2. Любите физику, друзья, Без космоса никак нельзя, Без света не прожить ни дня, Как в древнем
- 3. Что является объектом изучения МКТ? Идеальный газ. Что в МКТ называется идеальным газом? Идеальный газ –
- 4. Что называется изопроцессами? Изопроцессы – процессы, протекающие при неизменном значении одного из параметров. «Изо» - «постоянство».
- 5. Уравнение, связывающее три макропараметра P, V и T, характеризующее состояние данной массы газа называют уравнением состояния
- 6. Менделеев Дмитрий Иванович (1834–1907) – русский ученый. Работы – преимущественно в области химии, а также физики,
- 7. Бенуа́ Поль Эми́ль Клапейро́н (26 февраля 1799, Париж — 28 января 1864, там же) — французский
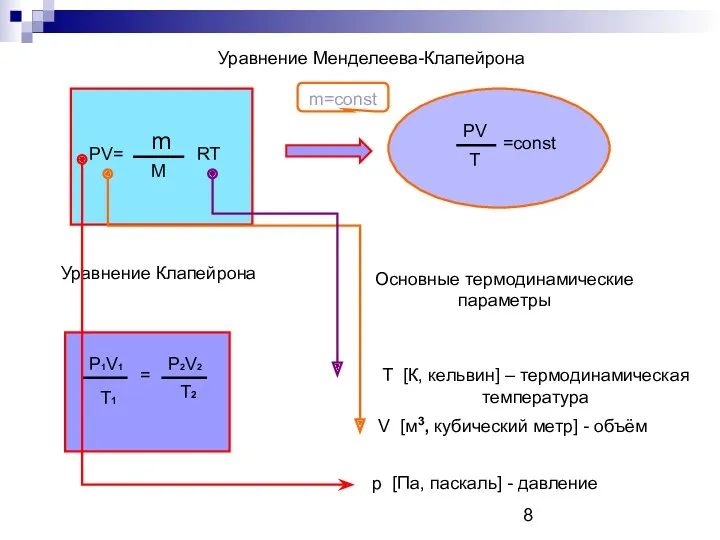
- 8. Уравнение Менделеева-Клапейрона PV= m M RT PV T =const Уравнение Клапейрона P1V1 T1 = P2V2 T2
- 9. Газовые законы Изотермический процесс Изобарный процесс Изохорный процесс
- 10. Изотермический процесс Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим. «термо» -
- 11. Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой – термостатом.
- 12. Роберт БОЙЛЬ (1627-1691), английский химик и физик, один из учредителей Лондонского королевского общества. Сформулировал (1661) первое
- 13. Эдм Мариотт (1620-1684) Французский физик, член Парижской академии наук со дня ее основания (1666). Был настоятелем
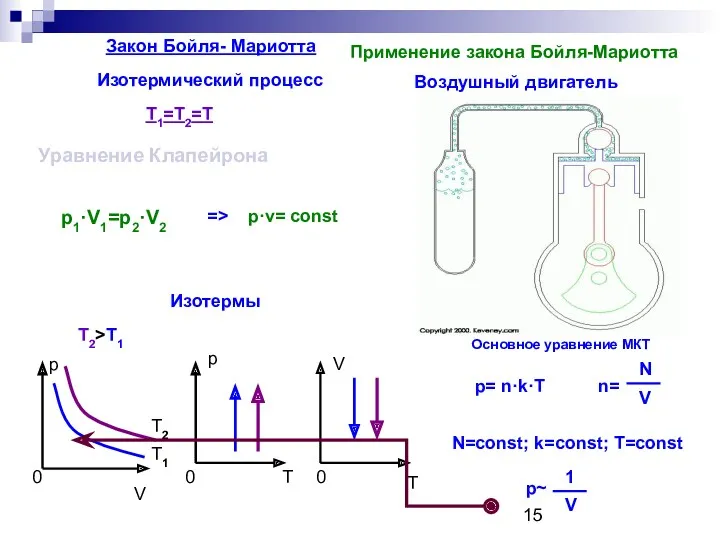
- 14. Закон Бойля-Мариотта Роберт Бойль (англ.) – 1662г Э. Мариотт (франц.) – 1676г Для газа данной массы
- 15. Закон Бойля- Мариотта Изотермический процесс T1=T2=T p·v= const p1·V1=p2·V2 p V 0 p 0 T V
- 16. Закон справедлив для любых газов и их смесей. Отклонения от этого закона становятся существенными при давлениях
- 17. Изохорный процесс. Процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме называют изохорным. “хорос”(греч.) -
- 18. Шарль, Жак Александр Сезар ШАРЛЬ Жак Александр Сезар (1746-1823), французский физик. Труды связаны с изучением расширения
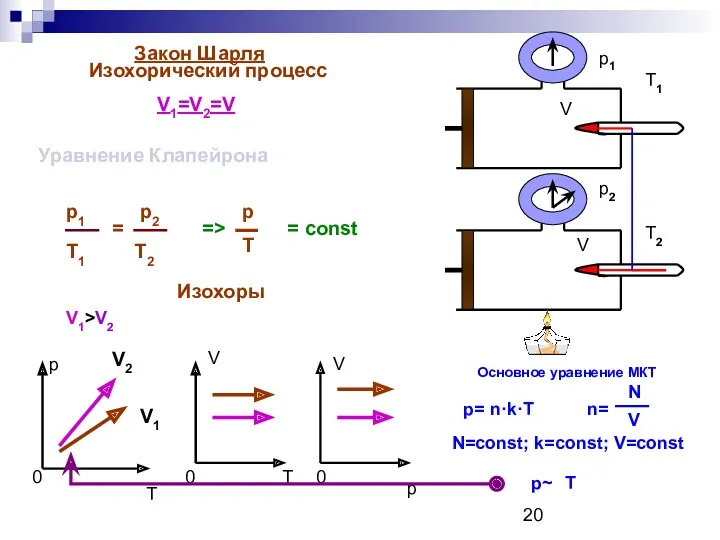
- 19. Закон Шарля Для данной массы газа отношение давления к температуре постоянно, если объем не меняется. при
- 20. Закон Шарля Изохорический процесс V1=V2=V = const p T 0 V 0 T V 0 p
- 21. Давление газа зависит от числа ударов молекул о стенки сосуда. При повышении температуры скорость движения молекул
- 22. Изобарный процесс Изобарный процесс – процесс изменения состояния определенной массы газа при постоянном давлении. “барос”(греч.) -
- 23. Гей –Люсак Жозеф Луи Французский химик и физик, член Парижской академии наук (с 1806), её президент
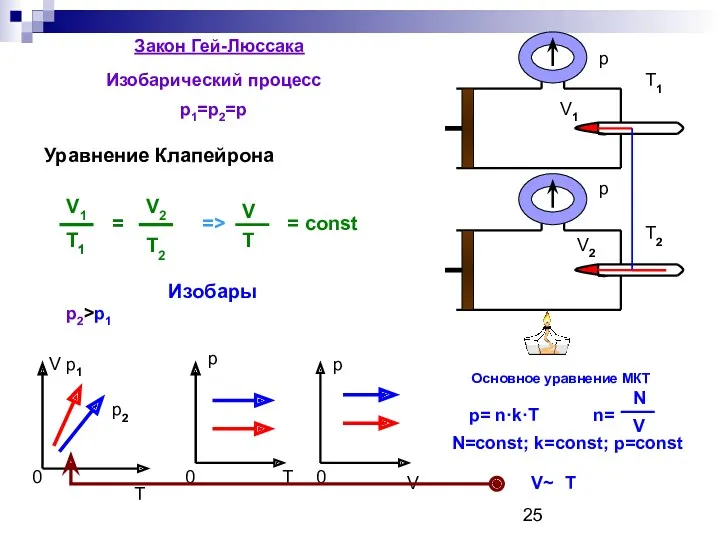
- 24. Закон Гей – Люссака Ж. Гей – Люссак (франц.) 1802 Для данной массы газа при постоянном
- 25. Закон Гей-Люссака Изобарический процесс p1=p2=p = const V T 0 p 0 T p 0 V
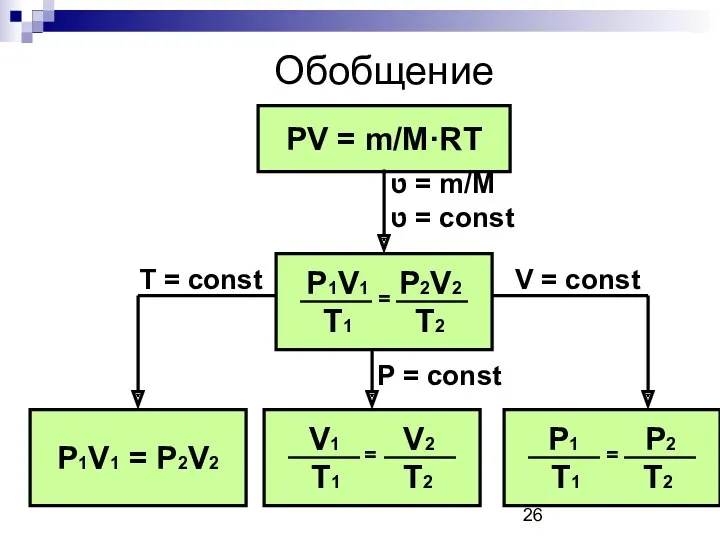
- 26. Обобщение PV = m/M·RT ט = m/M ט = const P1V1 = P2V2 V = const
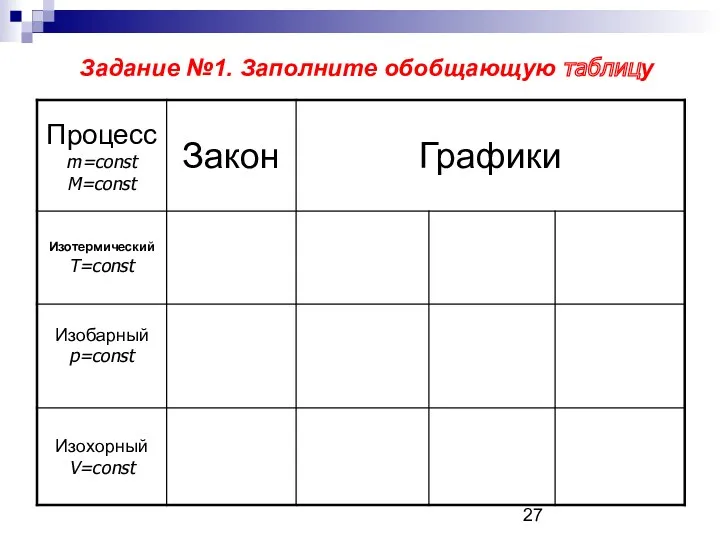
- 27. Задание №1. Заполните обобщающую таблицу
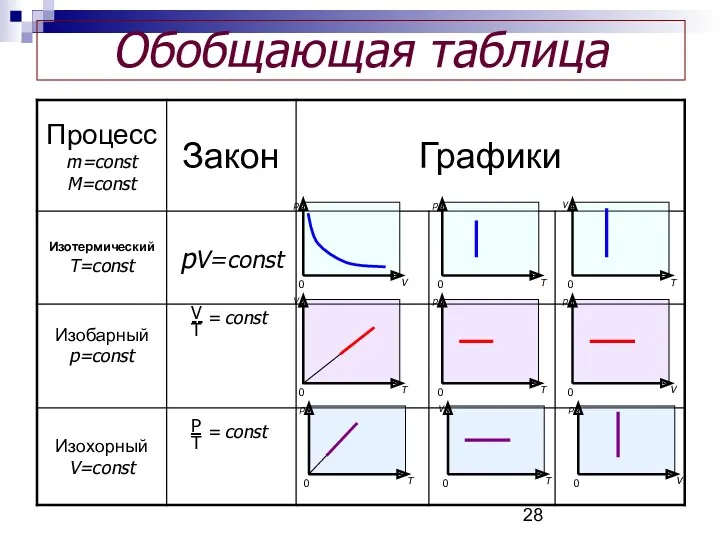
- 28. Обобщающая таблица V T -- = const P T const =
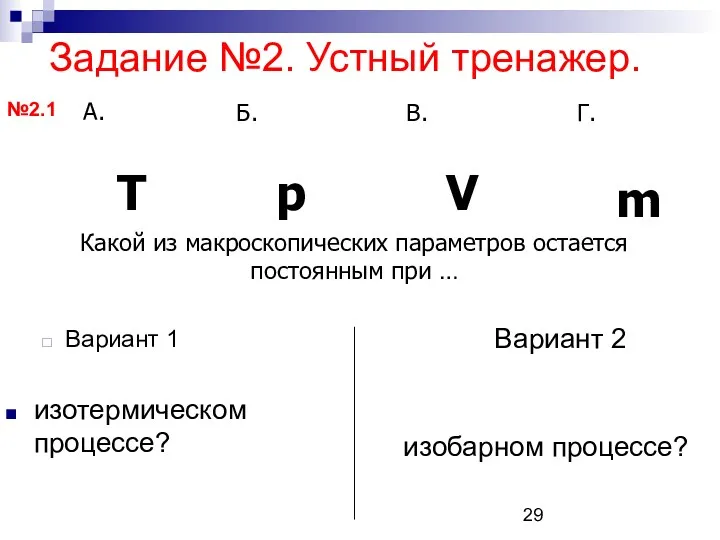
- 29. Задание №2. Устный тренажер. Вариант 1 изотермическом процессе? Вариант 2 изобарном процессе? Какой из макроскопических параметров
- 30. Вариант 1 Какая из формул описывает закон Вариант 2 Бойля-Мариотта? Гей-Люссака? №2.2
- 31. Вариант 1 Изобарный процесс? Вариант 2 изотермический процесс? А. Б. В. Г. Менделеев, Клапейрон Каким ученым
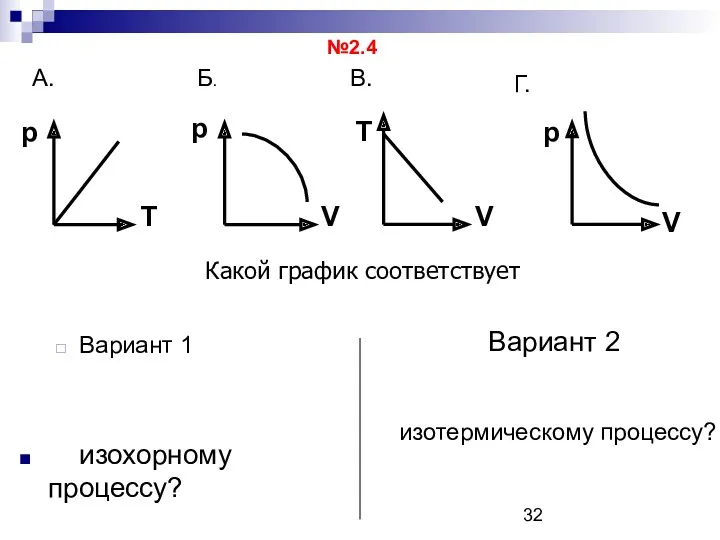
- 32. Вариант 1 изохорному процессу? Вариант 2 изотермическому процессу? Какой график соответствует №2.4
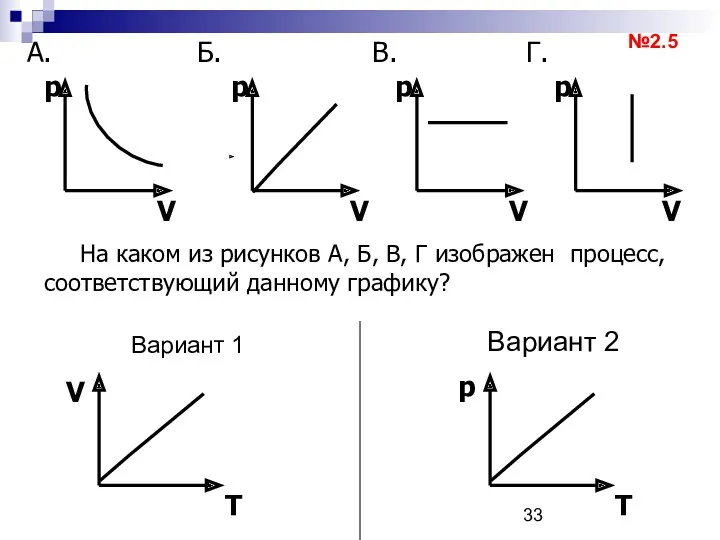
- 33. Вариант 1 Вариант 2 В. p На каком из рисунков А, Б, В, Г изображен процесс,
- 34. «Знать физику – означает уметь решать задачи» Энрико Ферми
- 36. Задание №3. Выполните тест. А1. Какова температура 8 г кислорода, занимающего объем 2,1 литра при давлении
- 37. Задание №3. Выполните тест. А1. Ответ №1 pV = mRT M pVM = mRT T =
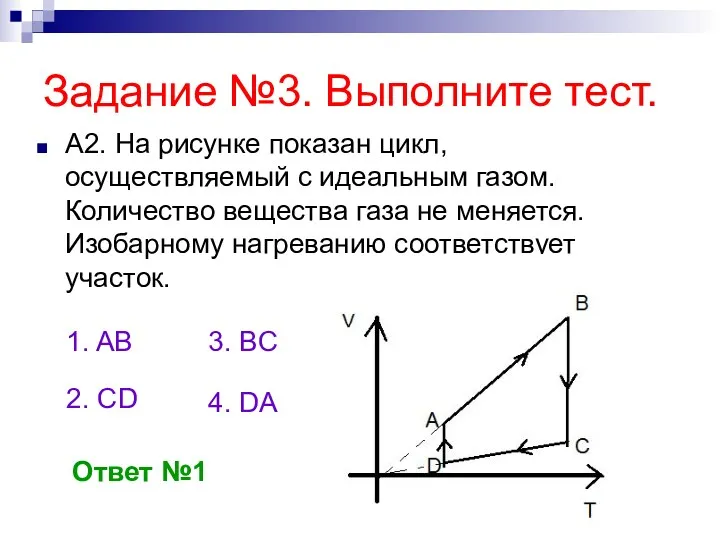
- 38. Задание №3. Выполните тест. А2. На рисунке показан цикл, осуществляемый с идеальным газом. Количество вещества газа
- 39. Задание №3. Выполните тест. А3. Давление неизменного количества идеального газа уменьшилось в 2 раза. Температура газа
- 40. Задание №3. Выполните тест. А3. Ответ №2 P1V1 T1 P2V2 T2 = P1V1 T1 = P1V24
- 41. Задание №3. Выполните тест. А4. На VT диаграмме представлена зависимость объема постоянной массы идеального газа от
- 42. Задание №3. Выполните тест. А4. Ответ 3. 1-2 V = const 2-3 p = const T↓
- 43. Задание №3. Выполните тест. А5. Постоянную массу идеального газа переводят из состояния 1 в состояние 3,
- 44. Задание №3. Выполните тест. А5. Ответ 1. 1-2 p = const V↑ в 3 => T
- 45. Задание №3. Выполните тест. B1. В закрытом сосуде постоянного объёма находится идеальный газ. Как изменяется при
- 46. Задание №3. Выполните тест. Таблица ответов B1 232
- 47. Рефлексия. Самооценка за работу на уроке: Тема освоена на: Отлично Хорошо Удовлетворительно. Трудности при выполнении задания:
- 49. Скачать презентацию



































 Презентация к уроку в 10 классе на тему: Физика и научный метод познания
Презентация к уроку в 10 классе на тему: Физика и научный метод познания Кран машиниста поезда, с дистанционным управлением №130
Кран машиниста поезда, с дистанционным управлением №130 Презентация по теме Разделы механики для 10 класса
Презентация по теме Разделы механики для 10 класса Люминесценция, ее виды
Люминесценция, ее виды Механизмы и приводы в станках
Механизмы и приводы в станках Úlohy merania mikroklímy
Úlohy merania mikroklímy Этапы развития ускорителей. Методы ускорения. Магнитная система ускорителей. Источники частиц. Синхротронное излучение
Этапы развития ускорителей. Методы ускорения. Магнитная система ускорителей. Источники частиц. Синхротронное излучение Численное моделирование инициирования и распространения волн детонации в горючих газовых смесях
Численное моделирование инициирования и распространения волн детонации в горючих газовых смесях Механические волны. 9 класс
Механические волны. 9 класс Перельман Яков Исидорович.
Перельман Яков Исидорович. Электромагнитное поле
Электромагнитное поле Принципиальная схема подключения магнитного пускателя
Принципиальная схема подключения магнитного пускателя X6000平台电子电气系统介绍. Внедрение электронной и электрической системы платформы X6000
X6000平台电子电气系统介绍. Внедрение электронной и электрической системы платформы X6000 Физические основы работы полупроводниковых приборов. Энергетические уровни и зоны
Физические основы работы полупроводниковых приборов. Энергетические уровни и зоны Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3
Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3 Основы гидравлики
Основы гидравлики Приводы подвагонных генераторов
Приводы подвагонных генераторов Организация работ по ТО и ТР автомобилей Lada Granta с детальной разработкой участка покраски
Организация работ по ТО и ТР автомобилей Lada Granta с детальной разработкой участка покраски Компенсация реактивной мощности. (БСК). Лекция 04
Компенсация реактивной мощности. (БСК). Лекция 04 Приложения химической термодинамики. Термодинамика фазовых равновесий
Приложения химической термодинамики. Термодинамика фазовых равновесий Намагниченность. Напряженность магнитного поля
Намагниченность. Напряженность магнитного поля Организация рабочего места слесаря. Тема 1.2
Организация рабочего места слесаря. Тема 1.2 Кулон заңы
Кулон заңы Баллистика и аэродинамика
Баллистика и аэродинамика Электризация тел. Два рода зарядов
Электризация тел. Два рода зарядов Где живет электричество?
Где живет электричество? Тепловое равновесие. Температура и ее измерение.
Тепловое равновесие. Температура и ее измерение. Трансформаторы. Устройство трансформатора
Трансформаторы. Устройство трансформатора