Содержание
- 2. ПОВТОРЕНИЕ 1.Какие макропараметры характеризуют состояние газа?
- 3. ПОВТОРЕНИЕ 2. Какой физический закон устанавливает зависимость между тремя макроскопическими параметрами — Р, V, T идеального
- 4. ПОВТОРЕНИЕ 3.Чем отличается уравнение состояния идеального газа от уравнения Менделеева - Клапейрона? Какое из них полнее
- 5. ПОВТОРЕНИЕ 4.Каким уравнением удобно воспользоваться для установления количественной зависимости между параметрами одного и того же состояния
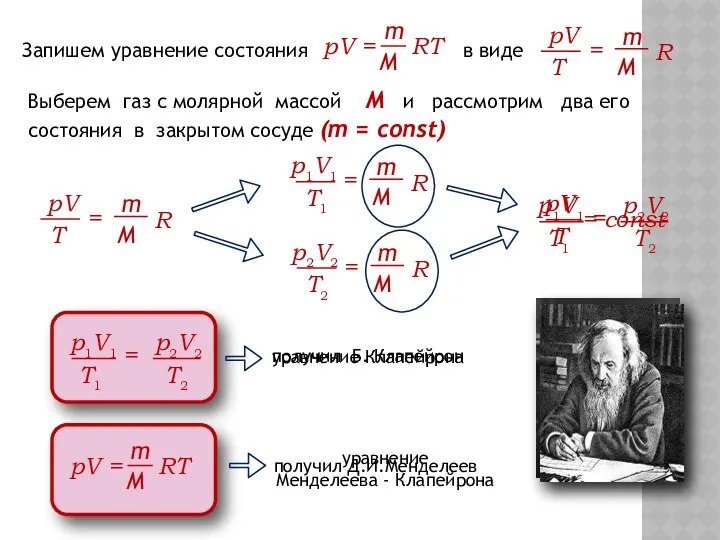
- 6. Запишем уравнение состояния в виде Выберем газ с молярной массой М и рассмотрим два его состояния
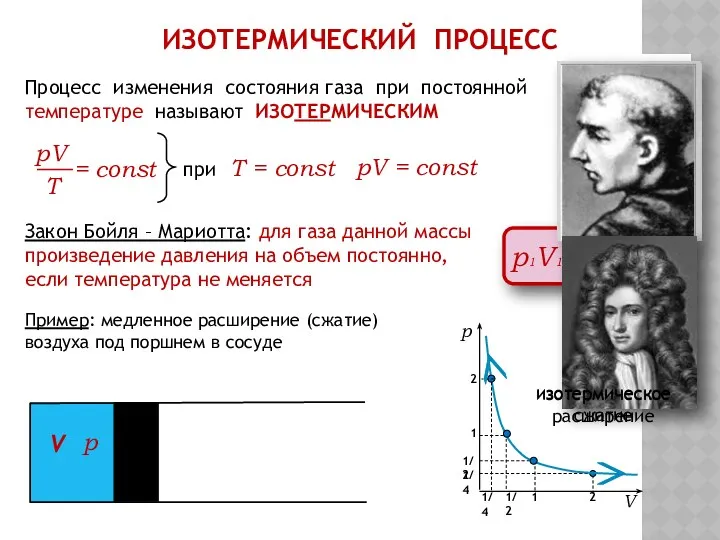
- 7. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс изменения состояния газа при постоянной температуре называют ИЗОТЕРМИЧЕСКИМ при Т = const pV
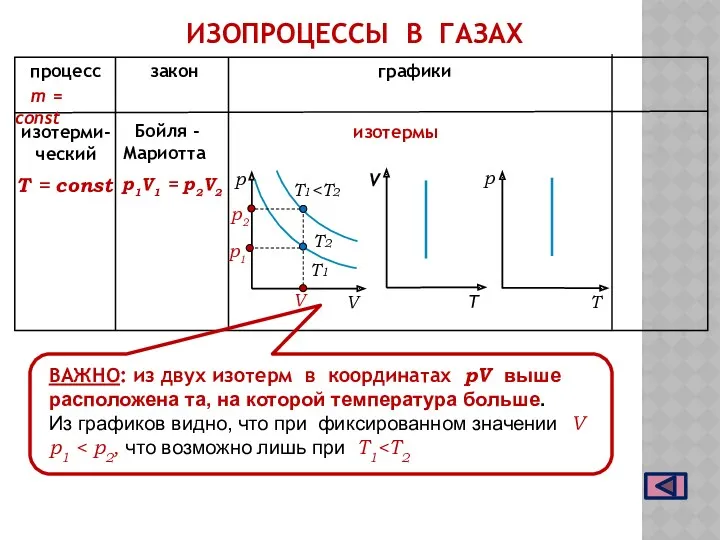
- 8. процесс закон графики Т = const m = const изотерми- ческий Бойля - Мариотта T1 р1V1
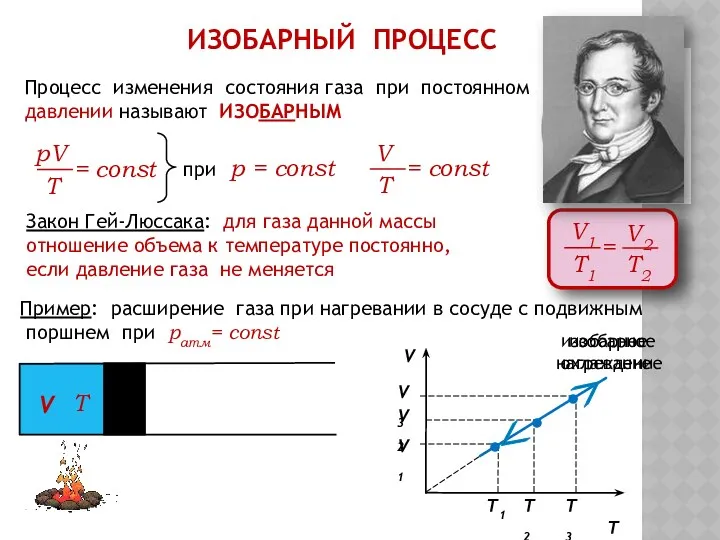
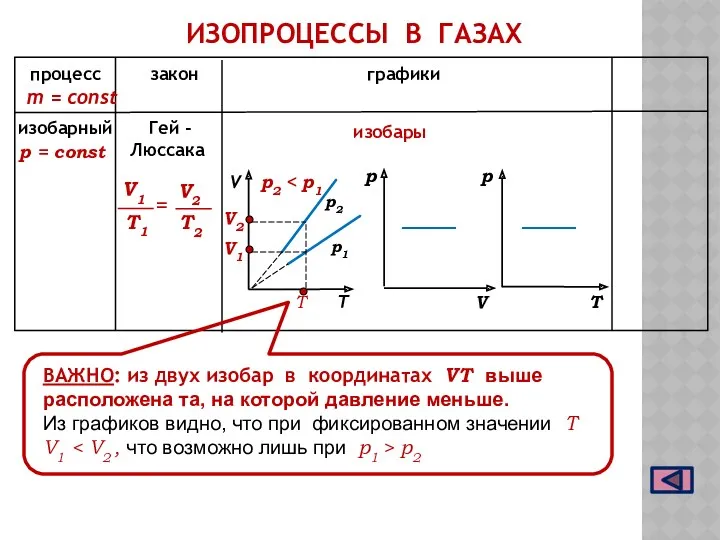
- 9. ИЗОБАРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном давлении называют ИЗОБАРНЫМ при р = const Закон
- 10. ИЗОПРОЦЕССЫ В ГАЗАХ процесс закон графики m = const р2 р1 изобары ВАЖНО: из двух изобар
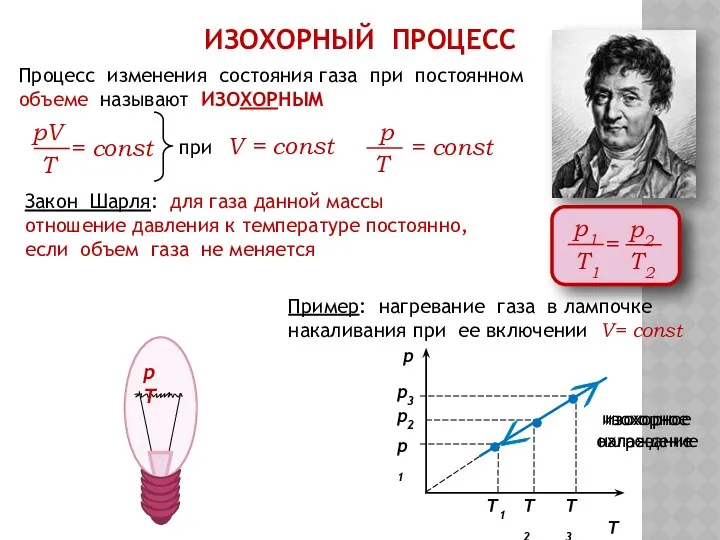
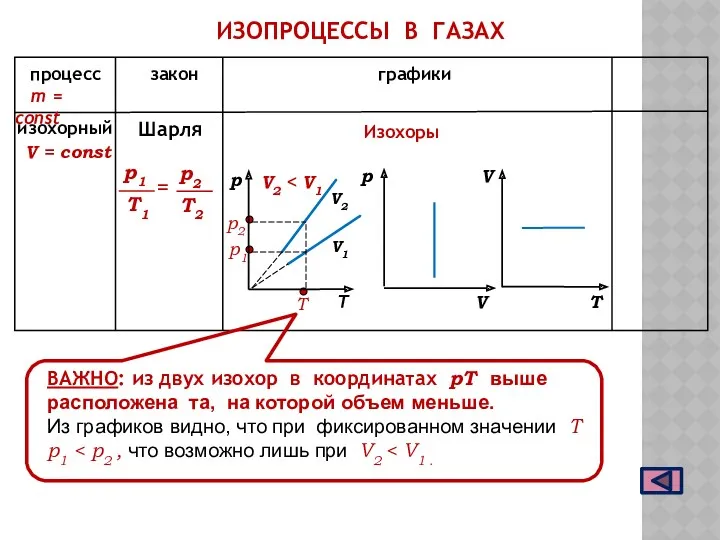
- 11. ИЗОХОРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном объеме называют ИЗОХОРНЫМ при V = const Закон
- 12. ИЗОПРОЦЕССЫ В ГАЗАХ m = const процесс закон графики V2 V1 Изохоры T V2 ВАЖНО: из
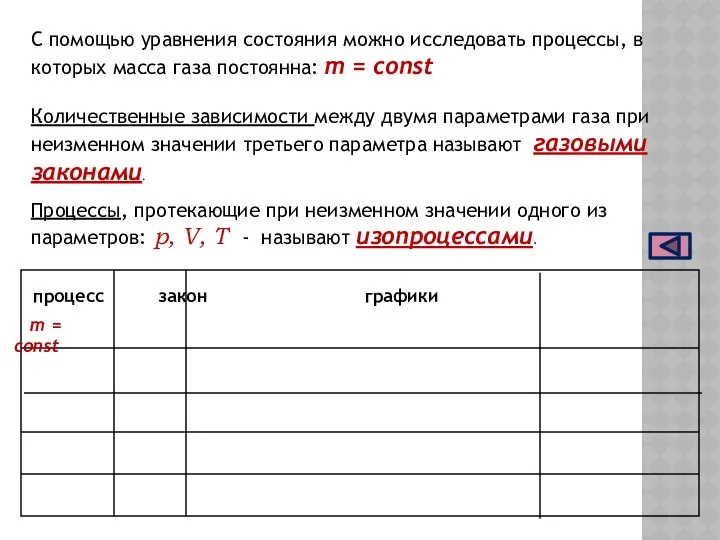
- 13. С помощью уравнения состояния можно исследовать процессы, в которых масса газа постоянна: m = const Количественные
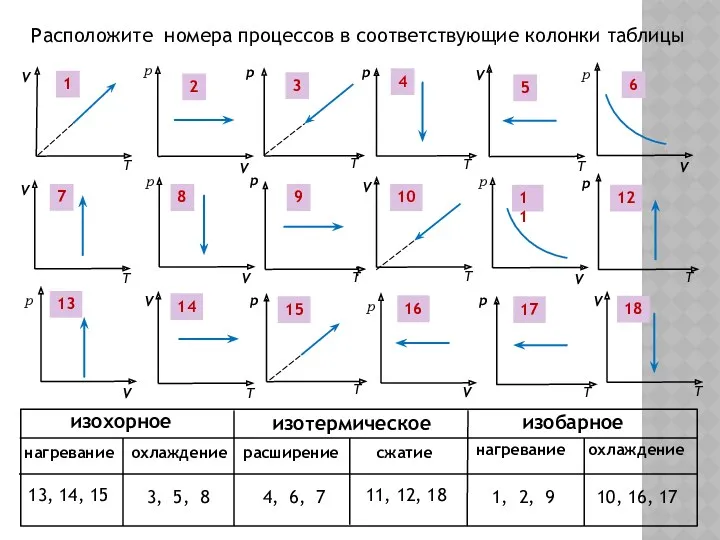
- 14. 1 3 2 4 5 6 7 8 9 10 11 12 13 14 15 16
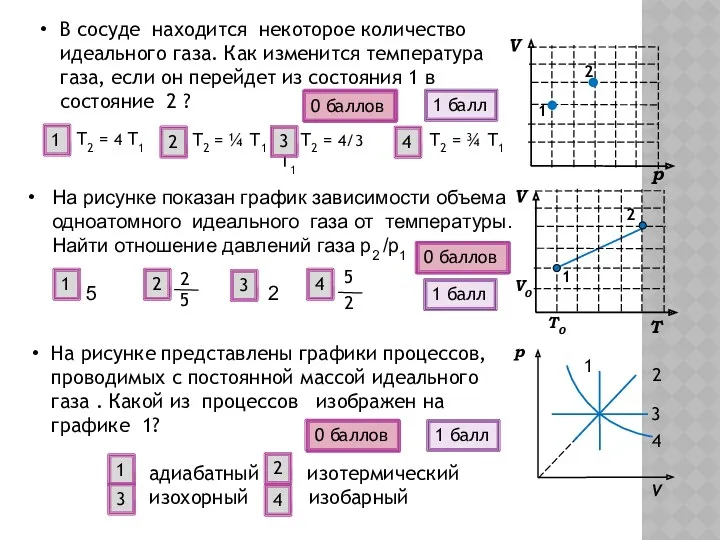
- 15. На рисунке показан график зависимости объема одноатомного идеального газа от температуры. Найти отношение давлений газа р2
- 17. Скачать презентацию




 Tasks
Tasks Валеологический аспект уроков физики
Валеологический аспект уроков физики Нестационарная теплопроводность. Задачи
Нестационарная теплопроводность. Задачи Радиоактивность как свидетельство сложного строения атомов
Радиоактивность как свидетельство сложного строения атомов Действие магнитного поля на проводник с током. Электродвигатель
Действие магнитного поля на проводник с током. Электродвигатель Элементы специальной теории относительности. Релятивистская динамика
Элементы специальной теории относительности. Релятивистская динамика Рентгеноспектральный анализ. Сущность рентгеноспектрального анализа
Рентгеноспектральный анализ. Сущность рентгеноспектрального анализа Давление. От чего зависит результат действия силы?
Давление. От чего зависит результат действия силы? Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас
Радиоактивность. Виды радиоактивных излучений. Изотопы. Закон радиоактивного распада. Радиоактивность вокруг нас Деятельностный подход в преподавании физики, как средство повышения качества знаний учащихся
Деятельностный подход в преподавании физики, как средство повышения качества знаний учащихся В мире электричества.
В мире электричества. Условия плавания тел. 7 класс
Условия плавания тел. 7 класс 9 кл.Закон сохранения энергии (1)
9 кл.Закон сохранения энергии (1) Второй закон Ньютона. Масса
Второй закон Ньютона. Масса Технология слесарных и слесарно-сборочных работ
Технология слесарных и слесарно-сборочных работ Лекция 8. Оптика. Квантовая природа излучения
Лекция 8. Оптика. Квантовая природа излучения Радиационная безопасность. Взаимодействие ионизирующих излучений с веществом
Радиационная безопасность. Взаимодействие ионизирующих излучений с веществом Телескоп
Телескоп Урок презентация Реактивное движение
Урок презентация Реактивное движение Электродинамика - раздел физики, в котором изучают электромагнитное взаимодействие между электрически заряженными телами
Электродинамика - раздел физики, в котором изучают электромагнитное взаимодействие между электрически заряженными телами Кинематика движения материальной точки
Кинематика движения материальной точки Isaac Newton's discoveries that changed the world
Isaac Newton's discoveries that changed the world Доклад на тему: Неньютоновская жидкость (3 класс)
Доклад на тему: Неньютоновская жидкость (3 класс) Методы утилизации ядерных отходов
Методы утилизации ядерных отходов Механическое движение. Виды движения. Скорость. Ускорение. Прямолинейное равномерное и неравномерное движения
Механическое движение. Виды движения. Скорость. Ускорение. Прямолинейное равномерное и неравномерное движения Тепловые двигатели
Тепловые двигатели Радиоактивность. Гипотеза об атомах
Радиоактивность. Гипотеза об атомах Контроль индивидуальных доз внешнего рентгеновского и гамма-излучения
Контроль индивидуальных доз внешнего рентгеновского и гамма-излучения