Содержание
- 2. В более узком понимании термодинамика изучает общие термические свойства веществ при равновесии и закономерности, характеризующие процесс
- 3. В более узком понимании термодинамика изучает общие термические свойства веществ при равновесии и закономерности, характеризующие процесс
- 4. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 1 Термодинамическая система – это тело или группа тел, находящихся во взаимодействии, мысленно
- 5. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 2 Гомогенная система – система, внутри которой нет поверхностей, разделяющих отличающиеся по свойствам
- 6. В общем случае, если в системе имеется N различных веществ (химических элементов), между которыми существуют n
- 7. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 4 Совокупность всех физических и химических свойств системы характеризует её термодинамическое состояние. Все
- 8. ОСНОВНЫЕ ПОНЯТИЯ ТЕРМОДИНАМИКИ 5 Всякое изменение термодинамического состояния системы (изменения хотя бы одного параметра состояния) есть
- 9. Энергия – мера способности системы совершать работу; общая качественная мера движения и взаимодействия материи. Энергия является
- 10. Внутренняя энергия – это функция состояния системы, т.е. её изменение не зависит от пути процесса, а
- 11. Теплота – переход энергии за счет хаотического столкновения молекул двух соприкасающихся тел. Работа – переход энергии
- 12. Законы термодинамики сформулированы на основе экспериментальных данных и поэтому могут быть приняты как постулаты. Они обобщают
- 13. 1-й закон термодинамики Представляет собой обобщённый закон сохранения энергии для термодинамических процессов. В наиболее простой форме
- 14. Формулировки 1 начала Согласно этому закону, во всех таких преобразованиях энергия не возникает и не исчезает,
- 15. Понятие Механический эквивалент теплоты возникло в связи с тем, что исторически механическую работу и количество теплоты
- 16. Герман Иванович Гесс Российский химик, академик Петербургской Академии наук. Родился 26 июля (7 августаРоссийский химик, академик
- 17. Закон Гесса открыт в 1840 г., Закон является частным случаем или математическим следствием первого начала термодинамики
- 18. Закон Гесса формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит
- 19. Иными словами, количество теплотыИными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и
- 20. Работы Гесса являются фундаментом термохимии Термохимические уравнения Уравнения химических реакций, в которых вместе с реагентами и
- 21. Здесь буквы в скобках обозначают агрегатные состояния веществ (газ или жидкость). Символом ΔH° обозначается изменение энтальпии
- 22. Следствия из закона Гесса Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому
- 23. Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая
- 24. Стандартная теплота образования Из закона сохранения энергии следует, что, когда вещество образуется из атомов и (или)
- 25. Пример расчета теплового эффекта реакции Реакция образования вторичного муллита при обжиге фарфора: 3Al2O3 + 2SiO2 =
- 26. Тепловой эффект реакции по прямому пути: ΔH1 = Σ ΔHf муллита - Σ (3 ΔHf Al2O3
- 27. Задание для самостоятельной работы Рассчитать теплоту образования следующих силикатных соединений, пользуясь табличными данными стандартных теплот образования
- 28. Задание для самостоятельной работы Рассчитать теплоту образования следующих силикатных соединений, пользуясь табличными данными стандартных теплот образования
- 30. Скачать презентацию



























 Презентация к уроку в 10 классе на тему: Физика и научный метод познания
Презентация к уроку в 10 классе на тему: Физика и научный метод познания Кран машиниста поезда, с дистанционным управлением №130
Кран машиниста поезда, с дистанционным управлением №130 Презентация по теме Разделы механики для 10 класса
Презентация по теме Разделы механики для 10 класса Люминесценция, ее виды
Люминесценция, ее виды Механизмы и приводы в станках
Механизмы и приводы в станках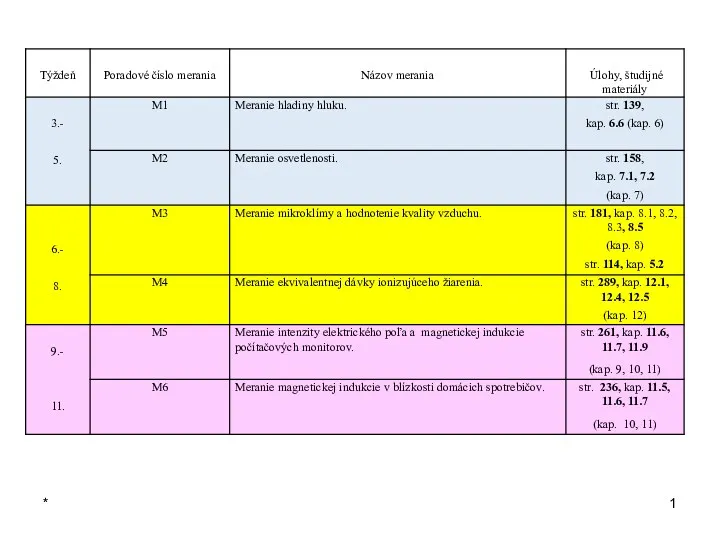 Úlohy merania mikroklímy
Úlohy merania mikroklímy Этапы развития ускорителей. Методы ускорения. Магнитная система ускорителей. Источники частиц. Синхротронное излучение
Этапы развития ускорителей. Методы ускорения. Магнитная система ускорителей. Источники частиц. Синхротронное излучение Численное моделирование инициирования и распространения волн детонации в горючих газовых смесях
Численное моделирование инициирования и распространения волн детонации в горючих газовых смесях Механические волны. 9 класс
Механические волны. 9 класс Перельман Яков Исидорович.
Перельман Яков Исидорович.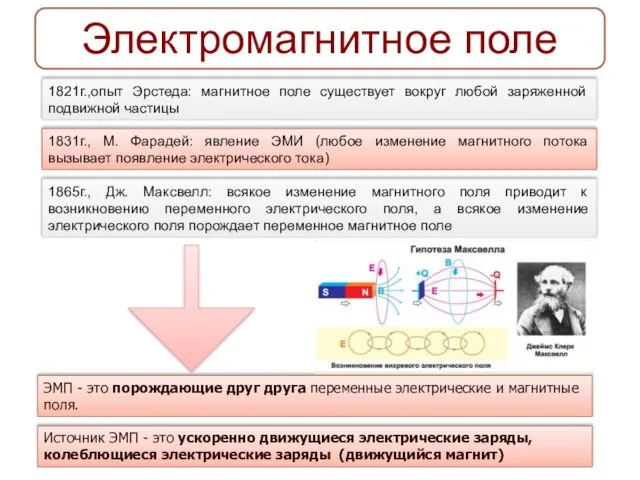 Электромагнитное поле
Электромагнитное поле Принципиальная схема подключения магнитного пускателя
Принципиальная схема подключения магнитного пускателя X6000平台电子电气系统介绍. Внедрение электронной и электрической системы платформы X6000
X6000平台电子电气系统介绍. Внедрение электронной и электрической системы платформы X6000 Физические основы работы полупроводниковых приборов. Энергетические уровни и зоны
Физические основы работы полупроводниковых приборов. Энергетические уровни и зоны Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3
Коллоидно-химические свойства и методы определения дисперсности НДС. Лекция 3 Основы гидравлики
Основы гидравлики Приводы подвагонных генераторов
Приводы подвагонных генераторов Организация работ по ТО и ТР автомобилей Lada Granta с детальной разработкой участка покраски
Организация работ по ТО и ТР автомобилей Lada Granta с детальной разработкой участка покраски Компенсация реактивной мощности. (БСК). Лекция 04
Компенсация реактивной мощности. (БСК). Лекция 04 Приложения химической термодинамики. Термодинамика фазовых равновесий
Приложения химической термодинамики. Термодинамика фазовых равновесий Намагниченность. Напряженность магнитного поля
Намагниченность. Напряженность магнитного поля Организация рабочего места слесаря. Тема 1.2
Организация рабочего места слесаря. Тема 1.2 Кулон заңы
Кулон заңы Баллистика и аэродинамика
Баллистика и аэродинамика Электризация тел. Два рода зарядов
Электризация тел. Два рода зарядов Где живет электричество?
Где живет электричество? Тепловое равновесие. Температура и ее измерение.
Тепловое равновесие. Температура и ее измерение. Трансформаторы. Устройство трансформатора
Трансформаторы. Устройство трансформатора