Содержание
- 2. Физические свойства металлов Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они
- 3. Все металлы имеют характерный металлический блеск.
- 4. Частицы металлов, находящихся в твердом и жидком состоянии, связаны особым типом химической связи — так называемой
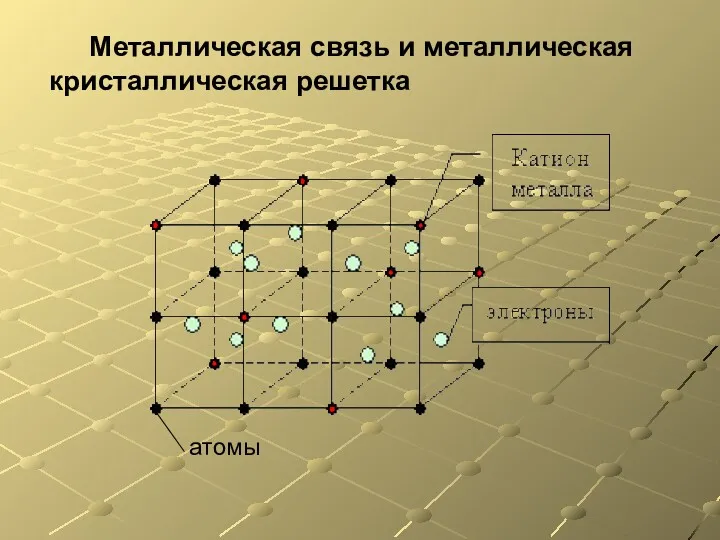
- 5. Металлическая связь и металлическая кристаллическая решетка атомы
- 7. Металлы черные цветные
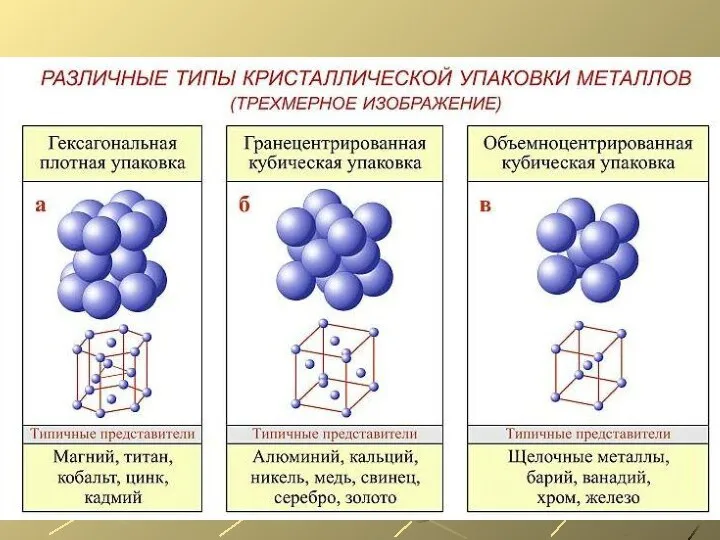
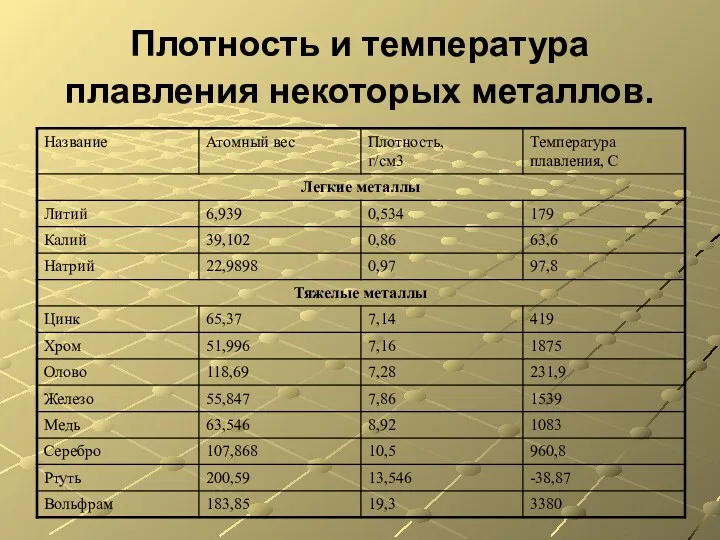
- 8. Плотность и температура плавления некоторых металлов.
- 9. Металлы легкие тяжелые ( плотность не более 5 г/см3 ) ( плотность больше 5 г/см3 )
- 10. Металлы мягкие твердые
- 11. Металлы легкоплавкие тугоплавкие ( t пл ( t пл > 1539 0С )
- 12. Химические свойства металлов Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны
- 13. 1. Взаимодействие с неметаллами. Закончите уравнения химических реакций. Дайте названия образующимся веществам: Mg + O2 Al
- 14. Взаимодействие железа с серой Разберите данную реакцию с т. з. окисления-восстановления.
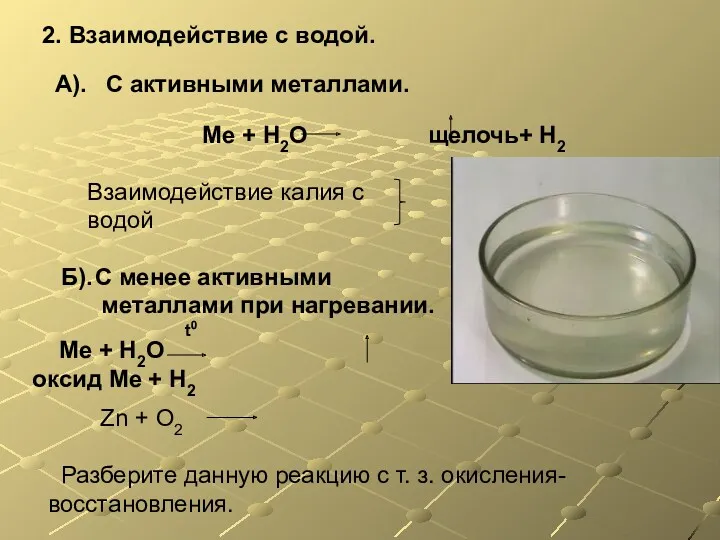
- 15. А). С активными металлами. Ме + Н2О щелочь+ Н2 Б). С менее активными металлами при нагревании.
- 16. 3. Взаимодействие с кислотами. Металлы, стоящие в ряду активности до водорода, вытесняют его из кислот (исключение
- 17. 4. Взаимодействие с солями. Взаимодействие железа с медным купоросом. Взаимодействие меди с нитратом ртути (II). Запишите
- 19. Скачать презентацию












 Психодидактика: новые технологии в преподавании физики
Психодидактика: новые технологии в преподавании физики Солнечные батареи в космосе
Солнечные батареи в космосе Трехфазные цепи
Трехфазные цепи Развитие творческих способностей обучающихся на уроках физики
Развитие творческих способностей обучающихся на уроках физики Пара сил и момент силы относительно точки
Пара сил и момент силы относительно точки Прозрачная-сенсорная-емкостная панель, на основе многослойной графеновой пленки
Прозрачная-сенсорная-емкостная панель, на основе многослойной графеновой пленки Подготовка к контрольной работе №1
Подготовка к контрольной работе №1 Тасымалдаушы машиналар жіктелімі
Тасымалдаушы машиналар жіктелімі Жартылай өткізгіштер
Жартылай өткізгіштер Система впрыска VAG
Система впрыска VAG Область применения кулачковых механизмов
Область применения кулачковых механизмов Alkaline Button Cell (Zinc/MnO2 in KOH)
Alkaline Button Cell (Zinc/MnO2 in KOH) 20230211_fizika_7_klass_plotnost_veshchestva._zadachi
20230211_fizika_7_klass_plotnost_veshchestva._zadachi Динамика материальной точки и поступательного движения твердого тела
Динамика материальной точки и поступательного движения твердого тела Создание анимации Кипение
Создание анимации Кипение Жидкое агрегатное состояние вещества
Жидкое агрегатное состояние вещества Релятивистская механика
Релятивистская механика Влияние предварительной деформации на эффект памяти формы в интерметаллиде TiNi
Влияние предварительной деформации на эффект памяти формы в интерметаллиде TiNi 20231111_rabota
20231111_rabota Внутренняя энергия. Работа. 1 начало термодинамики
Внутренняя энергия. Работа. 1 начало термодинамики Физический диктант
Физический диктант Магнитное поле. (Лекция 7)
Магнитное поле. (Лекция 7) Экспериментальное исследование и математическое моделирование конструкции из сплава. Термостат
Экспериментальное исследование и математическое моделирование конструкции из сплава. Термостат Презентация к уроку физики по теме: Явление электромагнитной индукции
Презентация к уроку физики по теме: Явление электромагнитной индукции Последовательности и их параметры
Последовательности и их параметры Волновая оптика
Волновая оптика Уравнения Максвелла
Уравнения Максвелла Импульс тела. Закон сохранения
Импульс тела. Закон сохранения