Содержание
- 2. Тема 6.2 Изотермический процесс в реакционном объеме Режимы идеального вытеснения и периодический идеального смешения Режим проточный
- 3. Изотермический процесс в реакционном объеме Отсутствуют тепловые изменения Происходящие явления отражаются только в состоянии материальных потоков
- 4. Математическая модель РИВ и РИС-п при τ = 0, С = С0 Переходя к конверсии, при
- 5. Характеристическое уравнение идеального режима (РИС-п или РИВ) РИВ и РИС-п
- 6. Кинетическое уравнение W(C) = kCn Модель процесса при τ = 0, С = С0 при τ
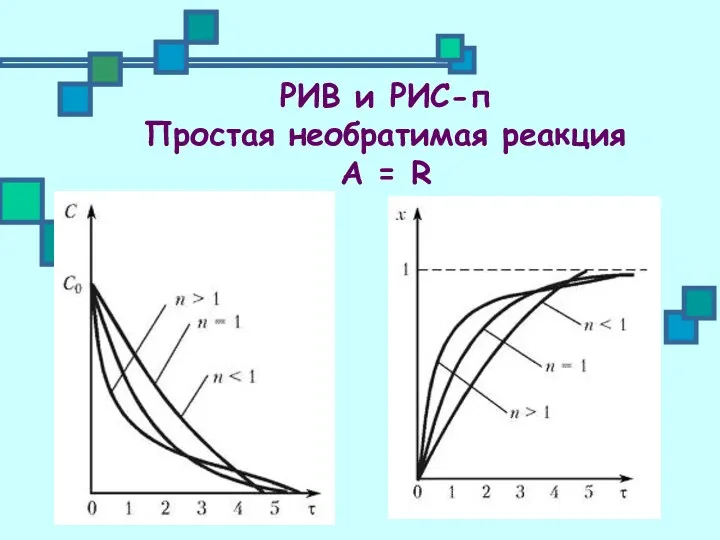
- 7. Интегрируем и получаем Получаем зависимость С(τ) и РИВ и РИС-п Простая необратимая реакция А = R
- 8. Вводим конверсию вместо концентрации Получаем зависимость х(τ) и РИВ и РИС-п Простая необратимая реакция А =
- 9. РИВ и РИС-п Простая необратимая реакция А = R
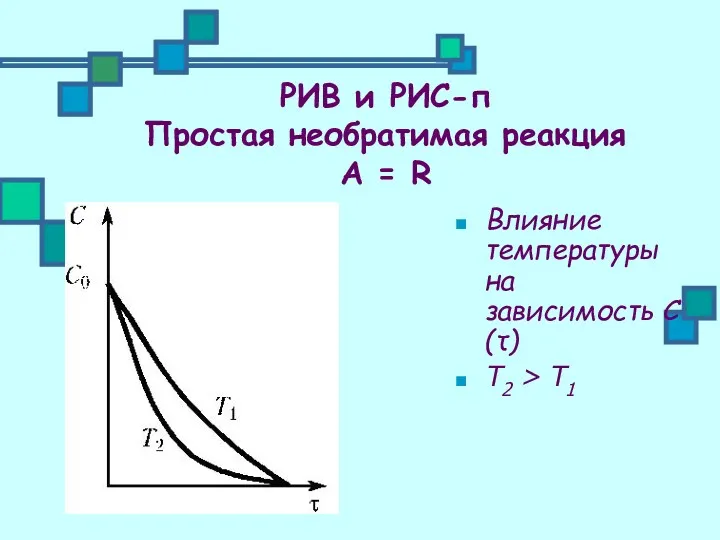
- 10. Влияние температуры на зависимость С(τ) Т2 > Т1 РИВ и РИС-п Простая необратимая реакция А =
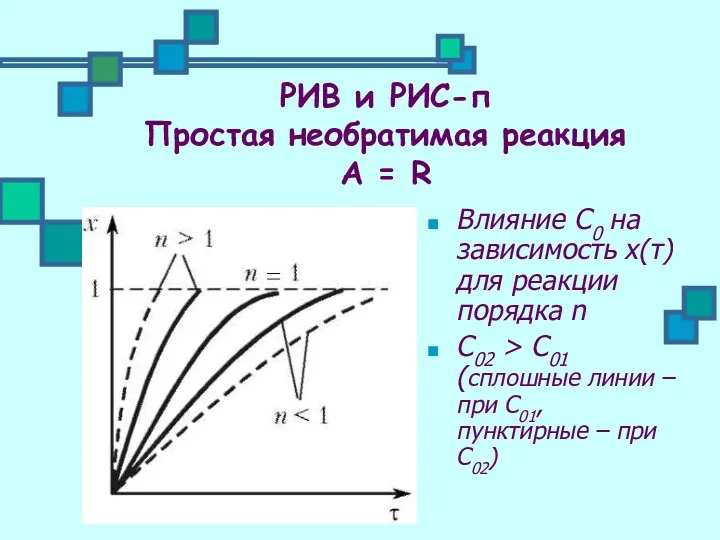
- 11. Влияние С0 на зависимость х(τ) для реакции порядка n С02 > С01 (сплошные линии – при
- 12. Анализ зависимости С(τ) и х(τ) показывает: - в РИС-п - влияние условий процесса на изменение С
- 13. Кинетическое уравнение (для реакций 1-го порядка в обоих направлениях) W(C) = k1CА – k2CR Модель процесса
- 14. РИС-н Простая обратимая реакция А ↔ R Интегрируем и получаем или При τ→∞ достигается равновесие и
- 15. РИВ и РИС-п Простая обратимая реакция А ↔ R Анализ С0: Начальная концентрация реагента не влияет
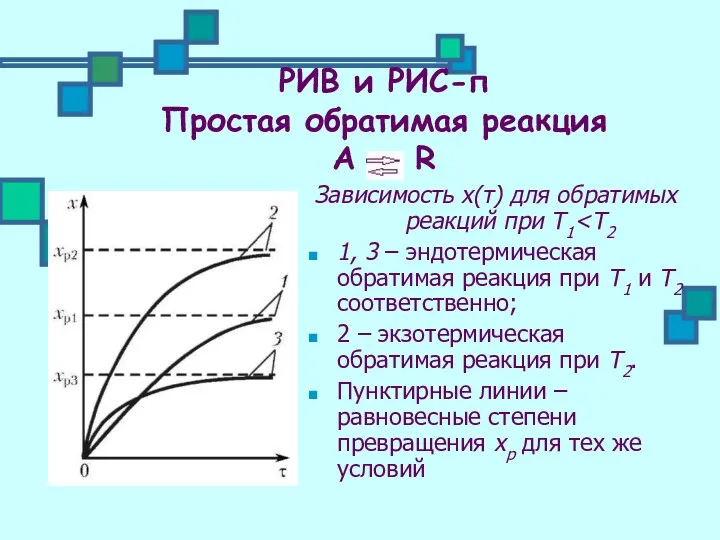
- 16. РИВ и РИС-п Простая обратимая реакция А ↔ R Зависимость х(τ) для обратимых реакций при Т1
- 17. Математическая модель РИС-н или РИС-н
- 18. Кинетическое уравнение (для реакции 1-го порядка) или Модель процесса или РИС-н Простая необратимая реакция А =
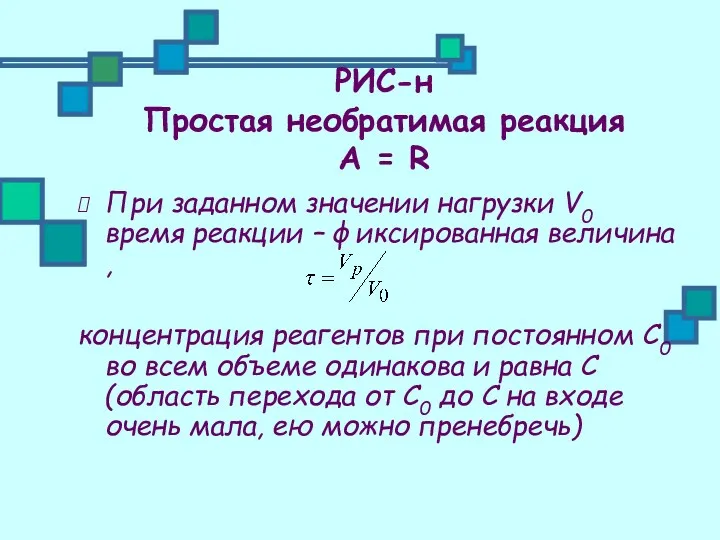
- 19. РИС-н Простая необратимая реакция А = R При заданном значении нагрузки V0 время реакции – фиксированная
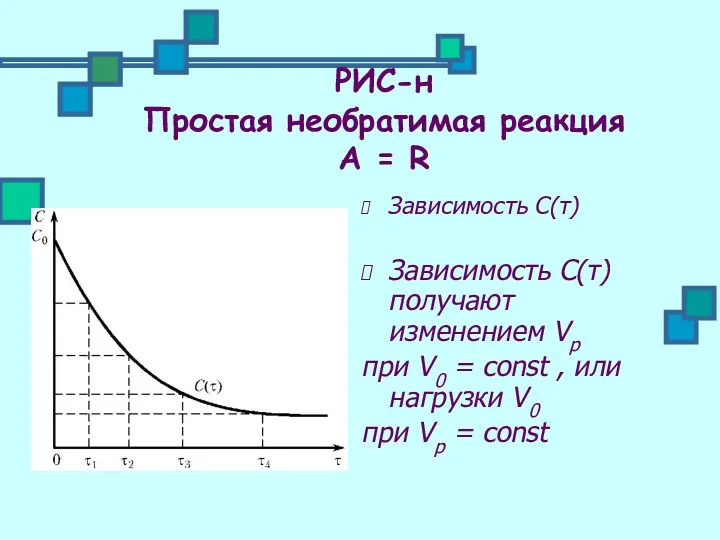
- 20. РИС-н Простая необратимая реакция А = R Зависимость С(τ) Зависимость С(τ) получают изменением Vр при V0
- 21. РИС-н Простая обратимая реакция А = R Кинетическое уравнение (для реакций 1-го порядка в обоих направлениях)
- 22. РИС-н Простая обратимая реакция А ↔ R При τ→∞ достигается равновесие и конверсия равна Равновесная конверсия
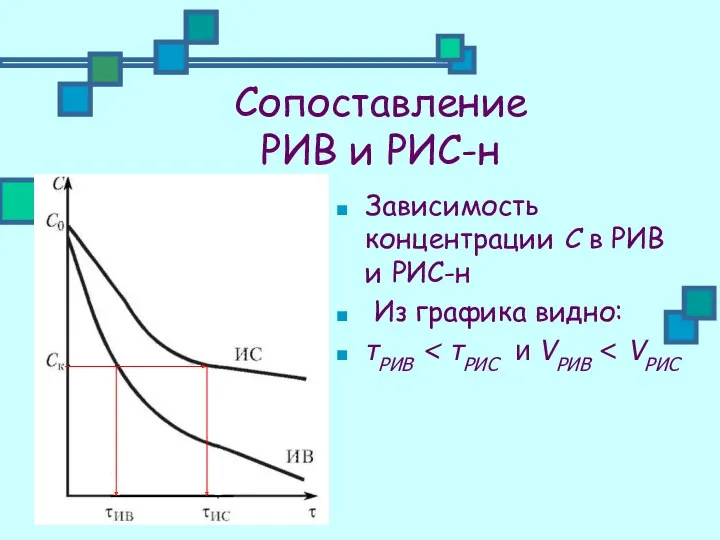
- 23. Сопоставление РИВ и РИС-н Зависимость концентрации С в РИВ и РИС-н Из графика видно: τРИВ
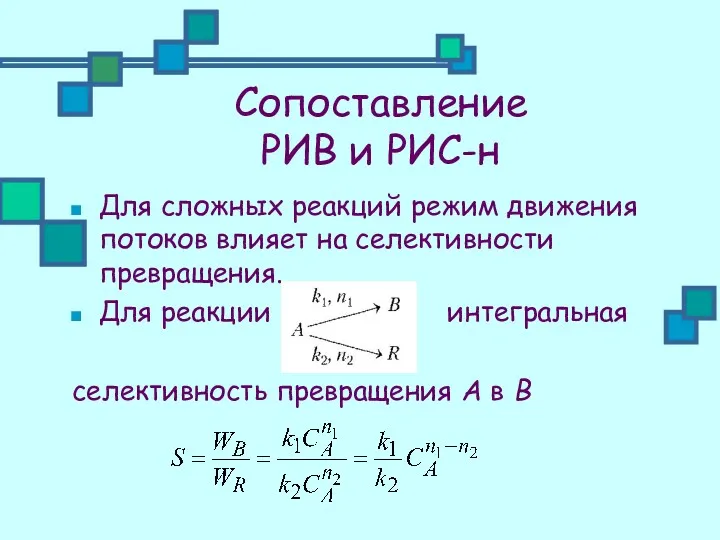
- 24. Сопоставление РИВ и РИС-н Для сложных реакций режим движения потоков влияет на селективности превращения. Для реакции
- 25. Сопоставление РИВ и РИС-н Следовательно, при проведении процесса в РИВ и РИС возможны три варианта: SРИВ
- 27. Скачать презентацию
















 Основы теории процесса сушки зерна
Основы теории процесса сушки зерна Распределение газовых молекул по скоростям и энергиям (Тема 2)
Распределение газовых молекул по скоростям и энергиям (Тема 2) Fundamentals of Electrical Engineering
Fundamentals of Electrical Engineering Второе начало термодинамики
Второе начало термодинамики Вітроенергетика. Джерело вітроенергетики
Вітроенергетика. Джерело вітроенергетики Электрическое сопротивление
Электрическое сопротивление Электрический ток в газах. Газовый разряд. 10 класс
Электрический ток в газах. Газовый разряд. 10 класс Электрический ток
Электрический ток Катушки индуктивности
Катушки индуктивности Механические, конструкционные и эксплуатационные свойства материалов и методы их определения. (2)
Механические, конструкционные и эксплуатационные свойства материалов и методы их определения. (2) Механические колебания
Механические колебания Точечные дефекты и их влияние на свойства кристаллов. Равновесные и неравновесные дефекты. Примеси в полупроводниках
Точечные дефекты и их влияние на свойства кристаллов. Равновесные и неравновесные дефекты. Примеси в полупроводниках Монтаж, ремонт и обслуживание комплектных распределительных устройств
Монтаж, ремонт и обслуживание комплектных распределительных устройств Валеологический аспект уроков физики
Валеологический аспект уроков физики Ядерно-магнитный резонанс. Лекция 4
Ядерно-магнитный резонанс. Лекция 4 Транспортная энергетика (часть II). Электрическое освещение
Транспортная энергетика (часть II). Электрическое освещение Солнечный коллектор
Солнечный коллектор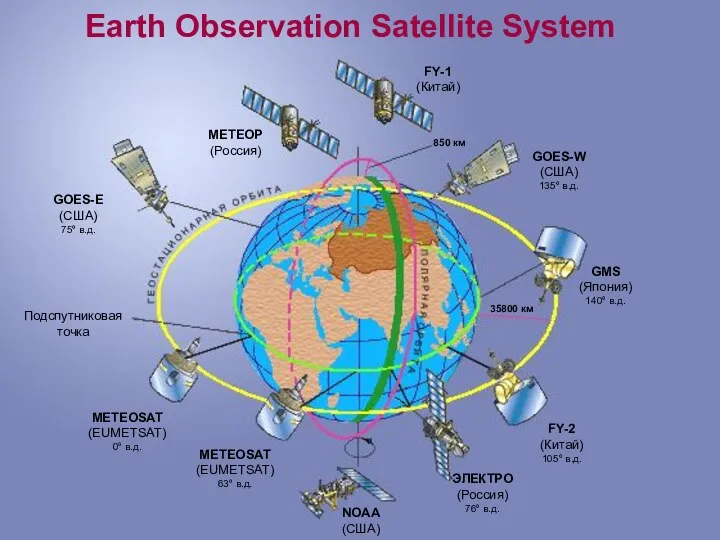 Earth observation satellite system
Earth observation satellite system Инструментальные методы исследования органических веществ. Спектроскопические методы – ЯМР (часть 2)
Инструментальные методы исследования органических веществ. Спектроскопические методы – ЯМР (часть 2) Водокольцевой вакуумный насос
Водокольцевой вакуумный насос Теорема Гаусса для диэлектриков
Теорема Гаусса для диэлектриков Презентация Параллельное соединение проводников
Презентация Параллельное соединение проводников Сложение сил, направленных по одной прямой. Равнодействующая сил
Сложение сил, направленных по одной прямой. Равнодействующая сил Механическое оборудование и система вентиляции
Механическое оборудование и система вентиляции Атом ядросының физикасы
Атом ядросының физикасы Расчет нелинейных цепей графическим методом
Расчет нелинейных цепей графическим методом Ядерный реактор
Ядерный реактор Шпоночные и шлицевые соединения
Шпоночные и шлицевые соединения