Кинетическая теория равновесного идеального газа. Термодинамика идеального газа. Лекция 2 презентация
Содержание
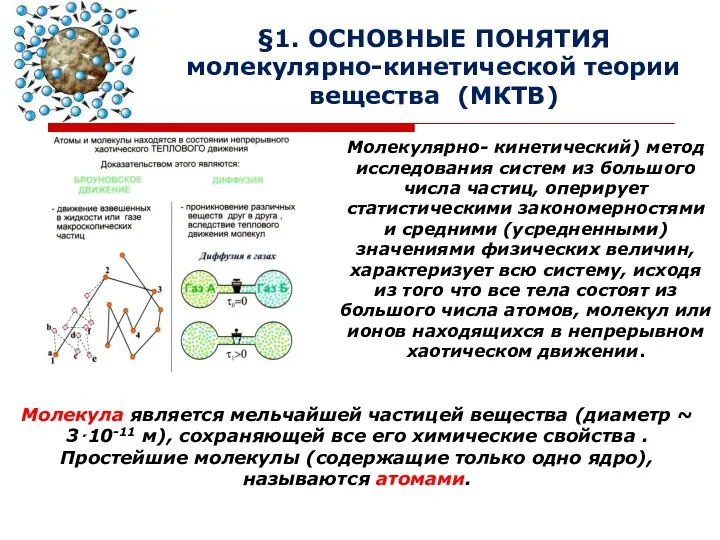
- 2. §1. ОСНОВНЫЕ ПОНЯТИЯ молекулярно-кинетической теории вещества (МКТВ) Молекулярно- кинетический) метод исследования систем из большого числа частиц,
- 3. Длина свободного пробега Средней длиной свободного пробега называется среднее расстояние, которое молекула проходит без столкновения –
- 4. Параметры состояния Термодинамические параметры (параметры состояния) – совокупностью физических величин, характеризующих свойства термодинамической системы: давление (p),
- 5. ИДЕАЛЬНЫЙ ГАЗ ИДЕАЛЬНЫЙ ГАЗ можно рассматривать как совокупность беспорядочно движущихся молекул-шариков, имеющих пренебрежимо малый собственный объем
- 6. Уравнение Клаузиуса СРЕДНЯЯ КИНЕТИЧЕСКАЯ ЭНЕРГИЯ поступательного движения одной молекулы идеального газа равна k≈1,38⋅10-23 Дж/К - Постоянная
- 7. УРАВНЕНИЕ МЕНДЕЛЕЕВА – КЛАПЕЙРОНА уравнение состояния идеального газа m – масса газа, μ –молярная масса газа
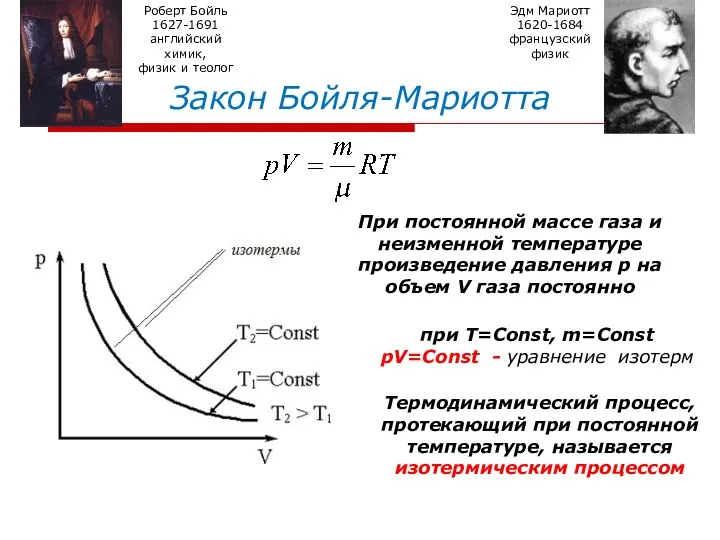
- 8. Закон Бойля-Мариотта Роберт Бойль 1627-1691 английский химик, физик и теолог Эдм Мариотт 1620-1684 французский физик При
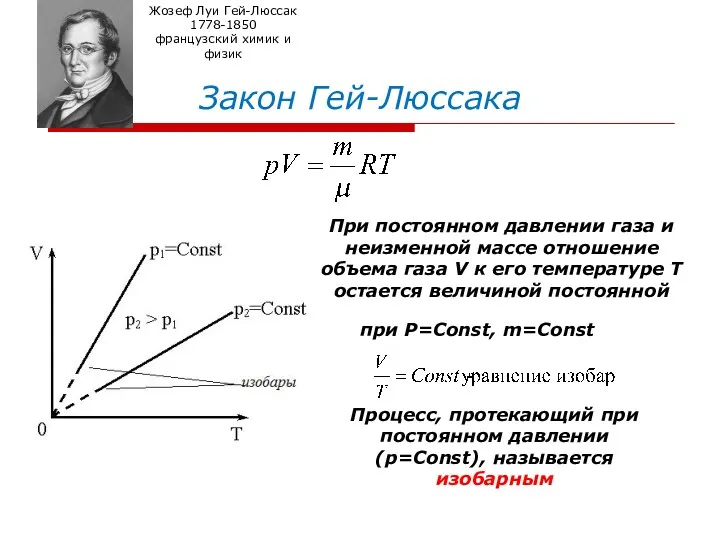
- 9. Закон Гей-Люссака Жозеф Луи Гей-Люссак 1778-1850 французский химик и физик При постоянном давлении газа и неизменной
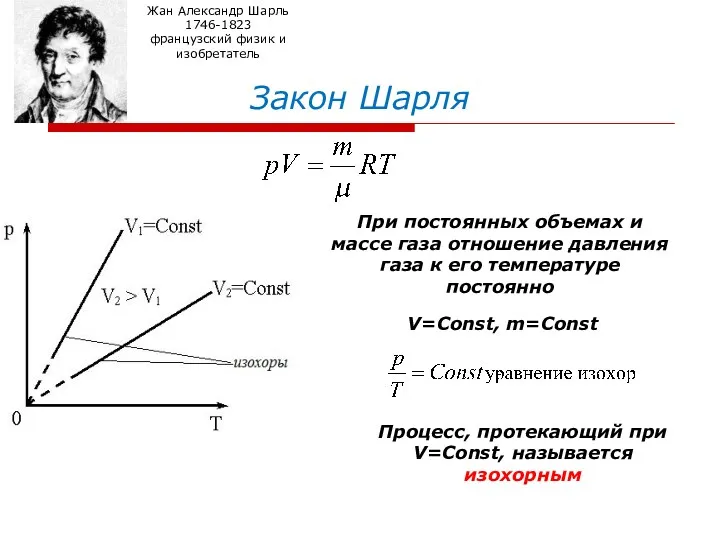
- 10. Закон Шарля Жан Александр Шарль 1746-1823 французский физик и изобретатель При постоянных объемах и массе газа
- 11. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1 , p2 ,…, pn входящих
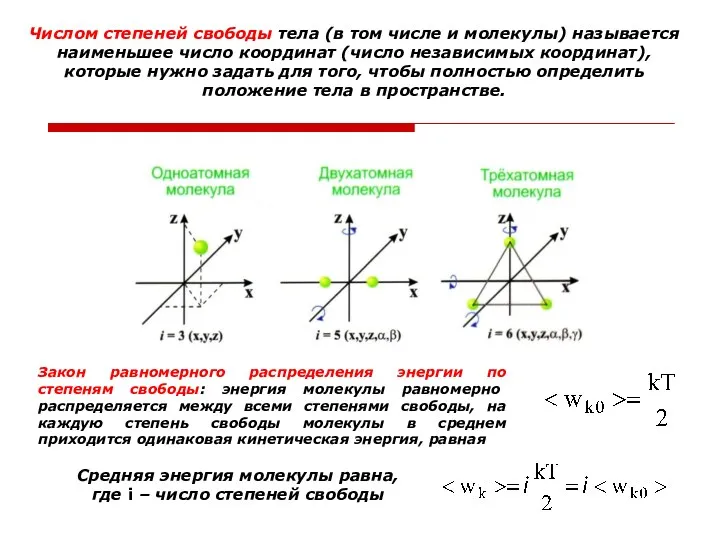
- 12. Числом степеней свободы тела (в том числе и молекулы) называется наименьшее число координат (число независимых координат),
- 13. Термодинамика ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Термодинамика – раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического
- 14. ВНУТРЕННЕЙ ЭНЕРГИЕЙ вещества называется энергия U, зависящая от термодинамического состояния системы (вещества) (т.е. является функцией состояния
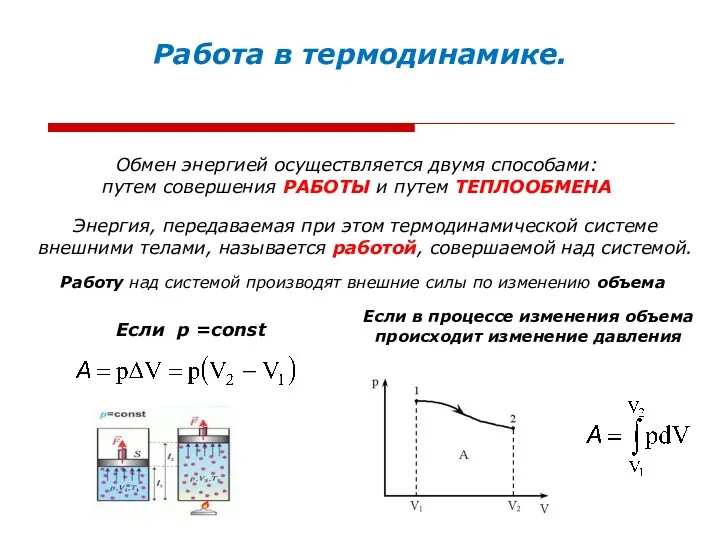
- 15. Работа в термодинамике. Обмен энергией осуществляется двумя способами: путем совершения РАБОТЫ и путем ТЕПЛООБМЕНА Энергия, передаваемая
- 16. Количество теплоты Теплообмен происходит между телами или частями одного и того же тела, нагретыми до различной
- 17. Первое начало термодинамики количество теплоты, сообщенное системе, расходуется на изменение внутренней энергии системы и на совершение
- 18. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ δQ=dU+ δA ПРИМЕНИТЕЛЬНО К ИЗОПРОЦЕССАМ В ИДЕАЛЬНЫХ ГАЗАХ Для изохорного процесса (V= Const)
- 19. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ δQ=dU+ δA ПРИМЕНИТЕЛЬНО К ИЗОПРОЦЕССАМ В ИДЕАЛЬНЫХ ГАЗАХ Для изобарного процесса (p=const) Физический
- 20. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ δQ=dU+ δA ПРИМЕНИТЕЛЬНО К ИЗОПРОЦЕССАМ В ИДЕАЛЬНЫХ ГАЗАХ АДИАБАТНЫМ называется, термодинамический процесс, при
- 21. II Начало термодинамики. Цикл Карно определения II закона термодинамики 1.Формулировка Клаузиуса: теплота самопроизвольно не может переходить
- 22. Круговые процессы Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд промежуточных состояний,
- 23. Цикл Карно - пример обратимого кругового процесса, описывающий работу идеального теплового двигателя Цикл Сади Карно состоит
- 24. Теорема Карно 3. Формулировка Карно (II закона термодинамики): Теорема Карно: КПД обратимых машин, работающих при одинаковых
- 26. Скачать презентацию

















 Припои и флюсы
Припои и флюсы Физика. Электростатика (продолжение)
Физика. Электростатика (продолжение) теоретические основы метрологического обеспечения
теоретические основы метрологического обеспечения Закон Кулона
Закон Кулона Решение неоднородного уравнения теплопроводности
Решение неоднородного уравнения теплопроводности Ременные передачи
Ременные передачи Использование системно-деятельностного подхода в преподавании физики
Использование системно-деятельностного подхода в преподавании физики Рупорные антенны. (Лекция 12)
Рупорные антенны. (Лекция 12) Основні положення теорії надійності. (Лекція 6)
Основні положення теорії надійності. (Лекція 6) Кинематический и силовой расчет привода винтового толкателя
Кинематический и силовой расчет привода винтового толкателя Элементы физики твердого тела. Статистика Бозе-Эйнштейна и Ферми-Дирака. Лекция 5
Элементы физики твердого тела. Статистика Бозе-Эйнштейна и Ферми-Дирака. Лекция 5 Дисперсия света
Дисперсия света Diesel and petrol power
Diesel and petrol power Строительная механика пластин. Изгиб пластин
Строительная механика пластин. Изгиб пластин Термодинамические системы и термодинамические параметры
Термодинамические системы и термодинамические параметры Оптика - раздел физики
Оптика - раздел физики РБМК (реактор большой мощности канальный). Лекция 8
РБМК (реактор большой мощности канальный). Лекция 8 Презентация по теме Внутренняя энергия и способы ее изменения8кл
Презентация по теме Внутренняя энергия и способы ее изменения8кл Обзор методов решения задач теплопроводности
Обзор методов решения задач теплопроводности Перемещение при прямолинейном движении
Перемещение при прямолинейном движении Нахождение удельной теплоты плавления льда в опытах по плавлению льда нагретыми металлическими цилиндрами
Нахождение удельной теплоты плавления льда в опытах по плавлению льда нагретыми металлическими цилиндрами Основы теории автоматического управления. Устойчивость САУ. Лекция 11
Основы теории автоматического управления. Устойчивость САУ. Лекция 11 КВН
КВН Структура и взаимодействие адронов
Структура и взаимодействие адронов Холодильные установки. Криогенные жидкости. Компрессоры
Холодильные установки. Криогенные жидкости. Компрессоры Кинематический расчет привода
Кинематический расчет привода Закон Паскаля. Сполучені посудини
Закон Паскаля. Сполучені посудини Сообщающиеся сосуды
Сообщающиеся сосуды