Содержание
- 2. Бор Нильс Хенрик Давид (7.10.1885—18.11.1962) Датский физик, один из создателей современной физики. Основатель (1920) и руководитель
- 3. Модель Резерфорда 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома
- 4. Электроны движутся вокруг ядра, подобно тому как планеты движутся вокруг солнца . Такой характер движения обусловлен
- 5. крупный шаг в развитии знаний о строении атома. наглядная и полезная для объяснения многих экспериментальных данных,
- 6. По классическим законам атом должен излучать электромагнитные волны, т.к. электроны движутся с ускорением. Это должно приводить
- 7. Никаких доказательств того, что атомы непрерывно исчезают, не было, следовательно, модель Резерфорда в чем-то ошибочна Модель
- 8. Бор предположил, что электрон в атоме не подчиняется законам классической физики. ПОСТУЛАТЫ БОРА
- 9. В 1913 году Бор показал, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических
- 10. Атомная система может находиться только в особых стационарных, или квантовых, состояниях, каждому из которых соответствует определенная
- 11. I. Электрон может вращаться вокруг ядра не по произвольным, а только по строго определенным (стационарным) круговым
- 12. 2. При движении по стационарным орбитам электрон не излучает и не поглощает энергии ПОСТУЛАТЫ БОРА II
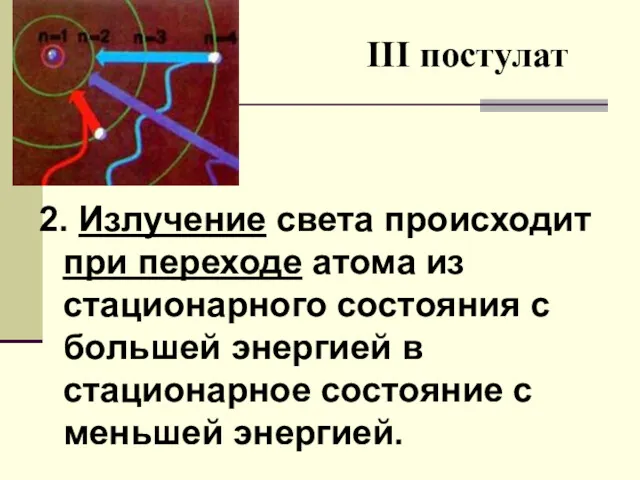
- 13. III постулат 2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией в
- 14. При этом энергия испущенного атомом фотона равна разности энергий стационарных состояний, а где Ek - энергия
- 15. Третий постулат позволяет вычислить по известным экспериментальным значениям энергий стационарных состояний частоты излучения атома водорода.
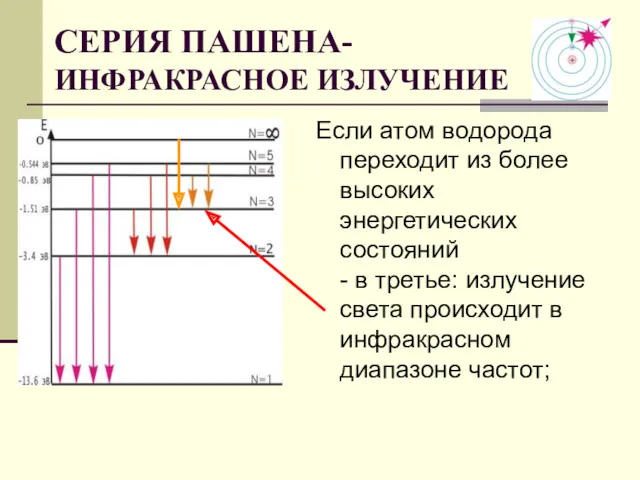
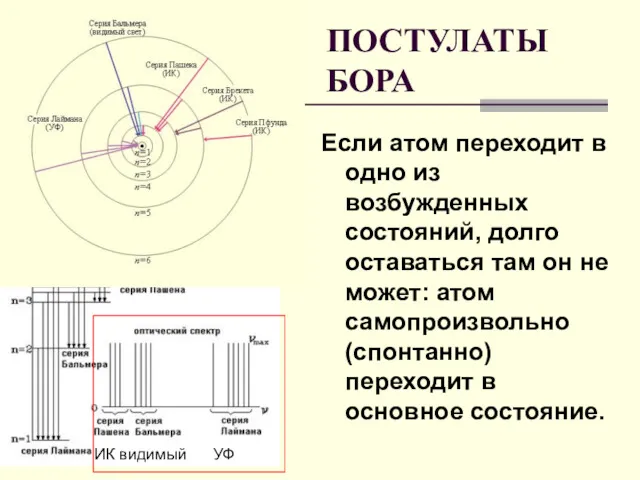
- 16. Если атом водорода переходит из более высоких энергетических состояний - в третье: излучение света происходит в
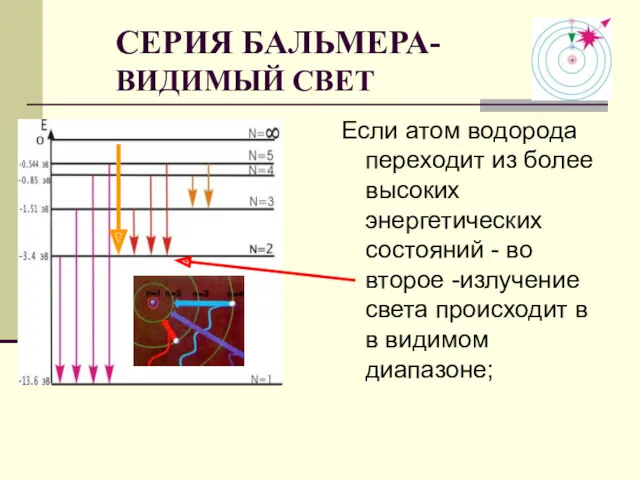
- 17. Если атом водорода переходит из более высоких энергетических состояний - во второе -излучение света происходит в
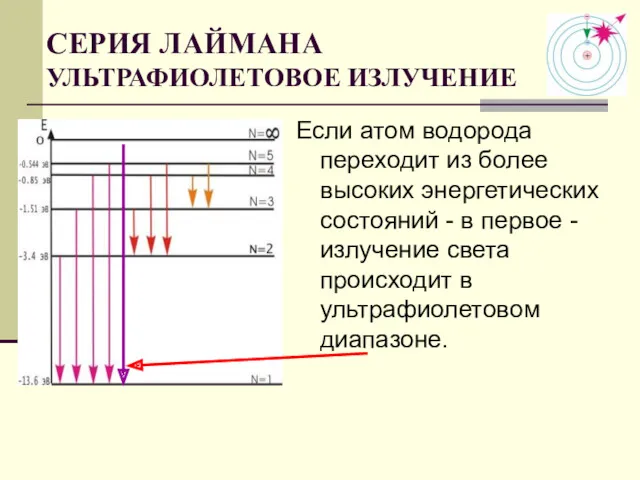
- 18. СЕРИЯ ЛАЙМАНА УЛЬТРАФИОЛЕТОВОЕ ИЗЛУЧЕНИЕ Если атом водорода переходит из более высоких энергетических состояний - в первое
- 19. Если атом переходит в одно из возбужденных состояний, долго оставаться там он не может: атом самопроизвольно
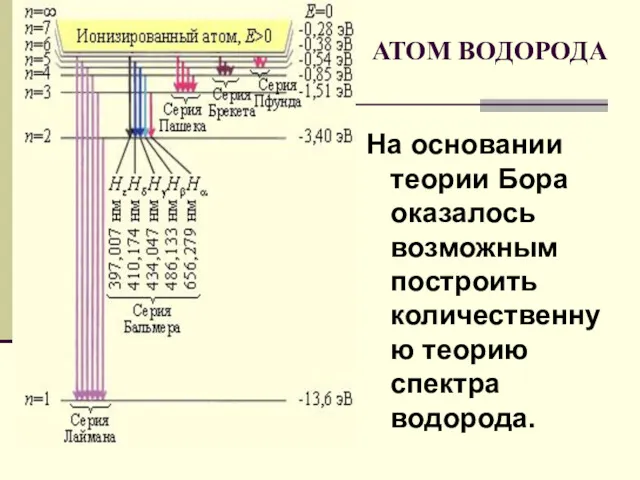
- 20. Свои постулаты Бор применил для объяснения излучения и поглощения света атомом водорода.
- 21. На основании теории Бора оказалось возможным построить количественную теорию спектра водорода. АТОМ ВОДОРОДА
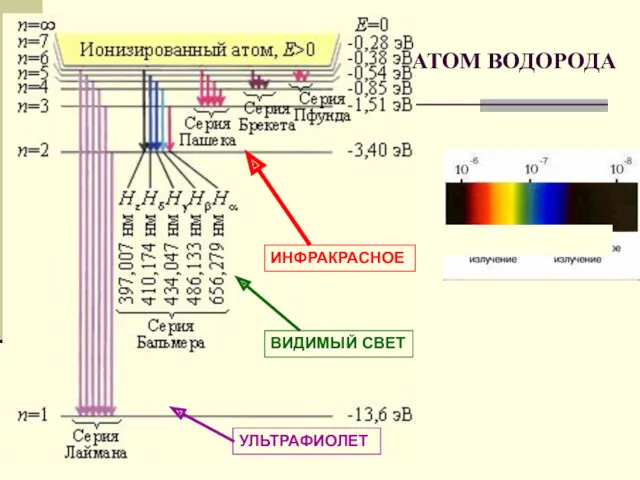
- 22. УЛЬТРАФИОЛЕТ ВИДИМЫЙ СВЕТ АТОМ ВОДОРОДА ИНФРАКРАСНОЕ
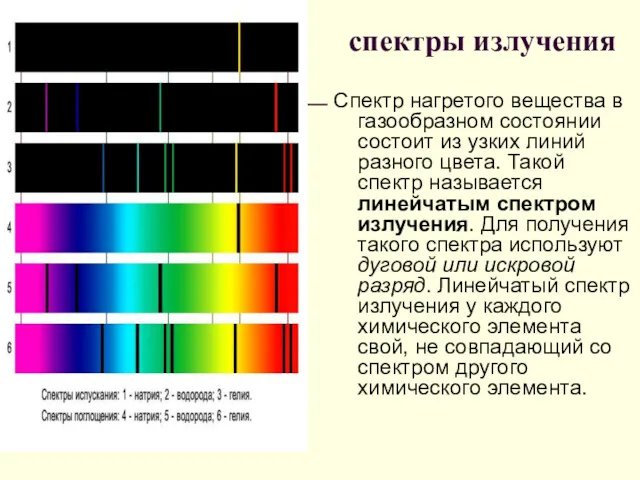
- 23. спектры излучения Спектр нагретого вещества в газообразном состоянии состоит из узких линий разного цвета. Такой спектр
- 24. СПЕКТРЫ ИСПУСКАНИЯ Расчеты Бора привели к согласию с экспериментально определенными частотами. Частоты излучений можно определить по
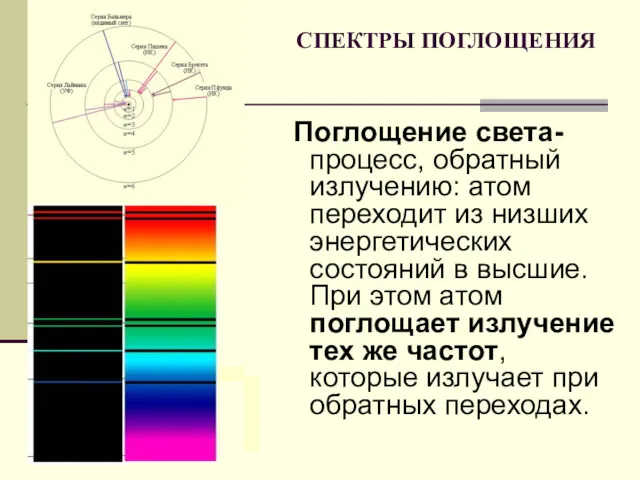
- 25. СПЕКТРЫ ПОГЛОЩЕНИЯ Поглощение света- процесс, обратный излучению: атом переходит из низших энергетических состояний в высшие. При
- 26. СПЕКТРЫ ИСПУСКАНИЯ СПЕКТРЫ ПОГЛОЩЕНИЯ 1-сплошной 2-натрия 3-водорода 4-гелия 5-солнечный 6-натрия 7-водорода 8-гелия
- 27. ТРУДНОСТИ ТЕОРИИ Построить количественную теорию уже для атома гелия на основе боровских представлений оказалось затруднительным
- 29. Скачать презентацию

















 Классификация электрических цепей
Классификация электрических цепей Лабораторная работа №19: Наблюдение сплошного и линейчатого спектров различных веществ
Лабораторная работа №19: Наблюдение сплошного и линейчатого спектров различных веществ Приливы и отливы
Приливы и отливы Виды излучений. Виды спектров
Виды излучений. Виды спектров БелАЗ. Горные машины
БелАЗ. Горные машины Плавание тел
Плавание тел 20230222_urok_1_sila_treniya_drug_ili_vrag
20230222_urok_1_sila_treniya_drug_ili_vrag Альтернативные источники энергии
Альтернативные источники энергии Волновая оптика
Волновая оптика Строение ядра
Строение ядра Свободное падение тел. Равноускоренное движение
Свободное падение тел. Равноускоренное движение Основы управления денежными средствами компании
Основы управления денежными средствами компании Допуски и посадки
Допуски и посадки Построение изображения в линзе
Построение изображения в линзе Электрическое поле, его характеристики, свойства. Поле диполя. (Лекция 4)
Электрическое поле, его характеристики, свойства. Поле диполя. (Лекция 4) Простые механизмы. Рычаг
Простые механизмы. Рычаг Görüntü boyutu (10)
Görüntü boyutu (10) Солнечные батареи в космосе
Солнечные батареи в космосе Своя игра 11 класс
Своя игра 11 класс Электрическое поле. Напряжённость электрического поля
Электрическое поле. Напряжённость электрического поля Волновые уравнения Максвелла
Волновые уравнения Максвелла Фонтан Герона
Фонтан Герона Физические величины и их измерение
Физические величины и их измерение Плавление и отвердевание кристаллических тел
Плавление и отвердевание кристаллических тел Презентация по темеЭнергия. Кинетическая и потенциальная энергия. Вывод закона сохранения механической энергии
Презентация по темеЭнергия. Кинетическая и потенциальная энергия. Вывод закона сохранения механической энергии Электромагнитные волны
Электромагнитные волны Полупроводниковые кристаллы
Полупроводниковые кристаллы Система отображения РЛ информации. Сведения об индикаторных устройствах. (Тема 6.1)
Система отображения РЛ информации. Сведения об индикаторных устройствах. (Тема 6.1)