Содержание
- 2. 1. Молекулярная физика Молекулярная физика рассматривает строение и свойства вещества на основе МКТ.
- 3. Молекулярно-кинетической теорией ( МКТ) называют учение о строении и свойствах вещества на основе представления о существовании
- 4. В основе молекулярно-кинетической теории лежат три основных положения: Все вещества – жидкие, твердые и газообразные –
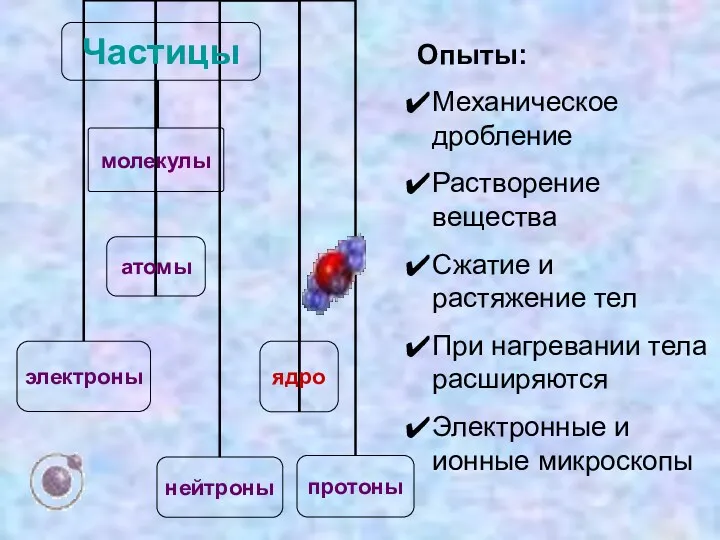
- 5. Опыты: Механическое дробление Растворение вещества Сжатие и растяжение тел При нагревании тела расширяются Электронные и ионные
- 6. Трудно не узнать это вещество…☺
- 7. 2. Атомы и молекулы находятся в непрерывном хаотическом движении. Скорость молекул зависит от температуры.
- 8. Причина: удары молекул жидкости о частицу не компенсируют друг друга. Характер движения зависит от рода жидкости,
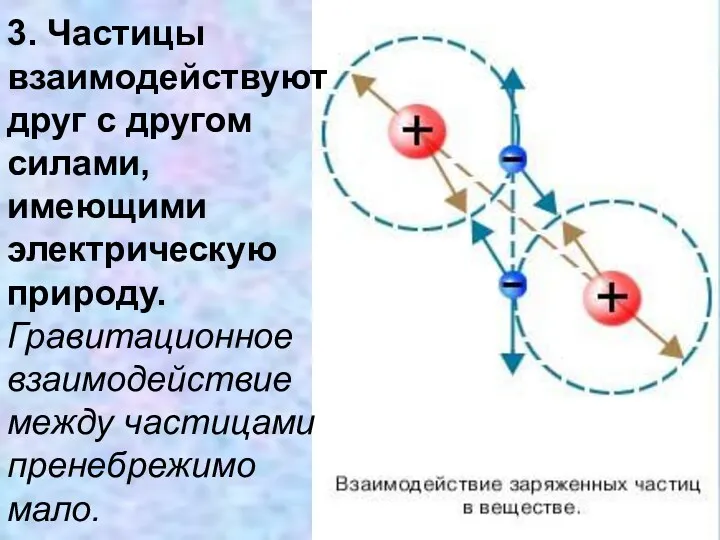
- 9. 3. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
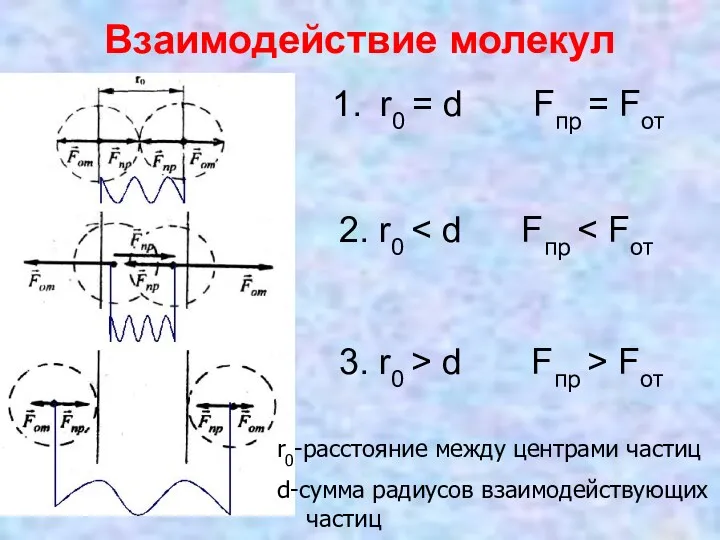
- 10. Взаимодействие молекул r0 = d Fпр = Fот 2. r0 3. r0 > d Fпр >
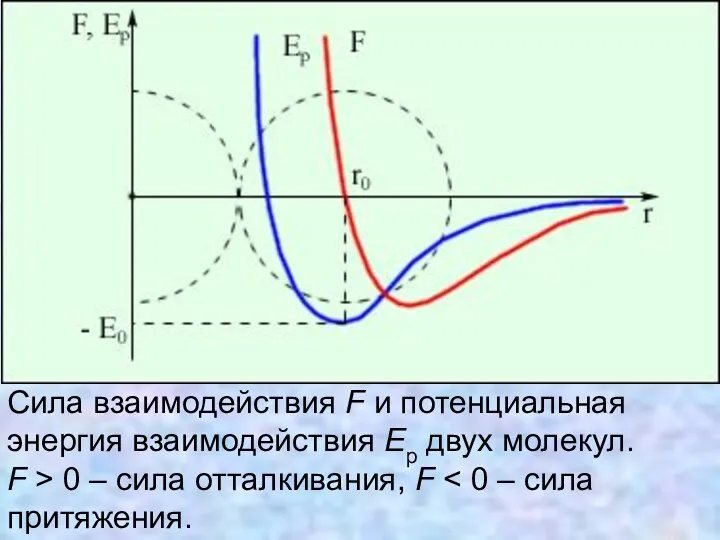
- 11. Сила взаимодействия F и потенциальная энергия взаимодействия Ep двух молекул. F > 0 – сила отталкивания,
- 12. Явления, подтверждающие идеи МКТ: Высокая сжимаемость газов свидетельствует о наличии больших расстояний между молекулами газа. Стремление
- 13. Явления, подтверждающие идеи МКТ: Давление газа на стенки сосуда (или на поверхность тела, введенного в газ),
- 14. Тема урока: Микро – и макропараметры вещества План урока 2. Размеры молекул. 3. Число молекул. 4.
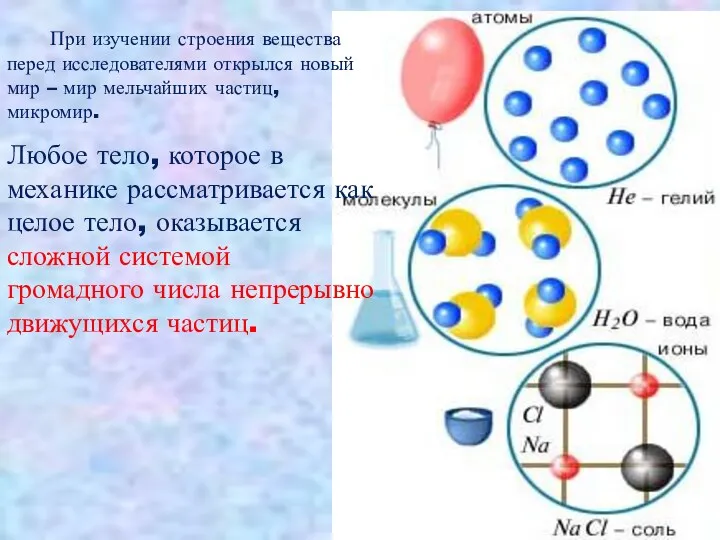
- 15. При изучении строения вещества перед исследователями открылся новый мир – мир мельчайших частиц, микромир. Любое тело,
- 16. И любое вещество (или тело) может быть охарактеризовано целым комплексом микро- и макропараметров Приступаем к изучению…
- 17. К микропараметрам вещества относятся: размеры молекул, масса молекулы, количество вещества (так как отражает количество структурных единиц
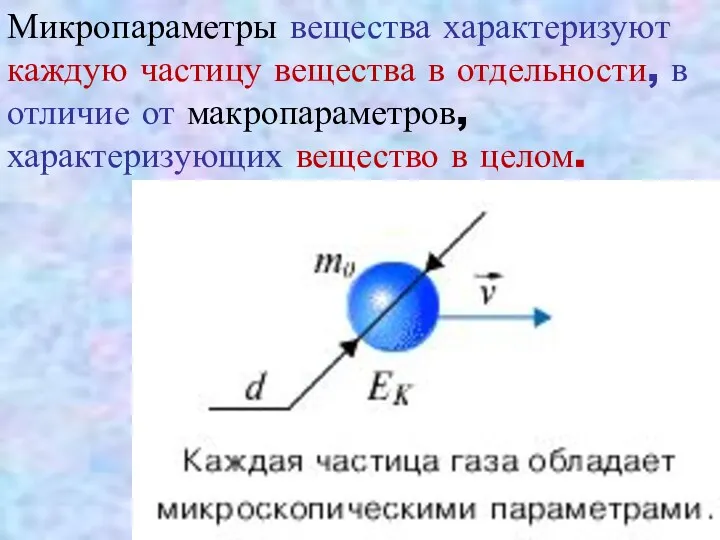
- 18. Микропараметры вещества характеризуют каждую частицу вещества в отдельности, в отличие от макропараметров, характеризующих вещество в целом.
- 19. К макропараметрам относятся:
- 20. Размеры молекул Как примерно оценить размер молекулы? При растекании масла на воде по максимальной площади пятно
- 21. Зная объем капли и измерив диаметр пятна, можно оценить размер молекулы. Если молекула состоит из одного
- 22. Число молекул При очень малых размерах число молекул в теле огромно. N– количество молекул В капле
- 23. Число 3,7⋅1022 примерно в 5000 миллиардов раз больше, чем количество людей на Земле. При каждом вдохе
- 24. Если взять число кирпичей, равное числу молекул в 1см3 газа (при нормальных условиях), то, будучи плотно
- 25. Масса молекулы Так как массы молекул очень малы ( к примеру, масса молекулы водорода составляет 3.3·10–27
- 26. Относительной атомной массой вещества Аr называют отношение массы атома к 1/12 массы атома углерода mo C
- 27. 1 а.е.м. = кг - единица измерения массы в а.е.м.
- 28. Относительные атомные массы всех известных химических элементов измерены и приведены в таблице Менделеева. Относительная молекулярная масса
- 29. Количество вещества Когда в задаче спрашивается: «Сколько воды можно нагреть…?», то физик подразумевает массу воды, а
- 30. Для физика – всё по 1 кг, а для химика – разное количество частиц в 1
- 31. Опыт показывает, что в равных объемах газа при одинаковых давлениях и температурах находится одинаковое число молекул
- 32. в единице количества вещества - 1 моле, находится одинаковое (!) количество частиц. N = 6⋅1023 атомов
- 33. Один моль – это такое количество вещества, в котором содержится столько же молекул (атомов), сколько атомов
- 34. Чтобы найти количество вещества, т.е. количество молей, нужно все количество атомов в веществе разделить на количество
- 35. Молярная масса М – это масса вещества, взятого в количестве одного моля. Молярную массу можно найти,
- 36. Если массу всего вещества поделить на массу одного моля, то получим количество молей: ν - количество
- 37. Основные формулы m0 = Mr ⋅1,66⋅10 -27 Mr =Ar если молекула из одного атома M =
- 38. Определите массу одной молекулы воды.
- 39. Зная число Авогадро, определите объем и диаметр атома золота.
- 40. На деталь, площадь поверхности которой 20 см², нанесен слой серебра толщиной 1 мкм. Сколько атомов серебра
- 42. Скачать презентацию
































 Урок-соревнование по физике в VIII классе по теме Тепловые явления +презентация
Урок-соревнование по физике в VIII классе по теме Тепловые явления +презентация Атмосферное давление презентация
Атмосферное давление презентация Физика атомного ядра
Физика атомного ядра Материалық нүктенің динамикасы
Материалық нүктенің динамикасы Эмальдар, Компаундтар. Клуазоне эмаль-бірегей зергерлік
Эмальдар, Компаундтар. Клуазоне эмаль-бірегей зергерлік Микроскопия. Микроскопы, их устройство и возможности для изучения поверхности на микро- и наноуровне
Микроскопия. Микроскопы, их устройство и возможности для изучения поверхности на микро- и наноуровне Основы теории судна. Мореходные, маневренные и эксплуатационные качества корабля
Основы теории судна. Мореходные, маневренные и эксплуатационные качества корабля Действие магнитного поля на проводник с током. Правило левой руки
Действие магнитного поля на проводник с током. Правило левой руки Ғажайып ұяшықтар
Ғажайып ұяшықтар Динамика. Инерциальные системы отсчета. Законы Ньютона. Масса и импульс материальной точки. Сила
Динамика. Инерциальные системы отсчета. Законы Ньютона. Масса и импульс материальной точки. Сила Повышение стойкости червячных фрез за счет нанесения фоп-покрытия нового поколения
Повышение стойкости червячных фрез за счет нанесения фоп-покрытия нового поколения ГАЗель Next c двигателем Monoturbo VW EA189
ГАЗель Next c двигателем Monoturbo VW EA189 Типы судовых энергетических установок. Тема №2
Типы судовых энергетических установок. Тема №2 Приборы для измерения давления
Приборы для измерения давления Россыпь анограмм. Физика в мультфильмах
Россыпь анограмм. Физика в мультфильмах Нанонаука (наука о наносистемах и наноструктурах). Термины и определения
Нанонаука (наука о наносистемах и наноструктурах). Термины и определения Разъемные соединения для передачи крутящего момента. Лекция № 17
Разъемные соединения для передачи крутящего момента. Лекция № 17 Тема 6. Устойчивость САУ. Лекция 11. Критерий устойчивости Найквиста для статических и астатических САУ. Запас устойчивости
Тема 6. Устойчивость САУ. Лекция 11. Критерий устойчивости Найквиста для статических и астатических САУ. Запас устойчивости Принцип действия циклона
Принцип действия циклона Альтернативные виды топлива
Альтернативные виды топлива Курс лекций по теоретической механике
Курс лекций по теоретической механике Выталкивающая сила
Выталкивающая сила Balers
Balers Гамма-гамма-каротаж
Гамма-гамма-каротаж методическая разработка раздела курса физики 7 класса Давление
методическая разработка раздела курса физики 7 класса Давление Сопротивление материалов (часть I)
Сопротивление материалов (часть I) Реактивное движение
Реактивное движение ВКР: Техническое обслуживание и анализ конструкции реверсивного устройства двигателя SAM-146
ВКР: Техническое обслуживание и анализ конструкции реверсивного устройства двигателя SAM-146