Содержание
- 2. Повторение Перечислите основные положения МКТ. Дайте определение относительной молекулярной массы. Что такое количество вещества? Что такое
- 3. Изопроцессы в газах Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. Рассмотрим следующие изопроцессы:
- 4. (Название процесса)
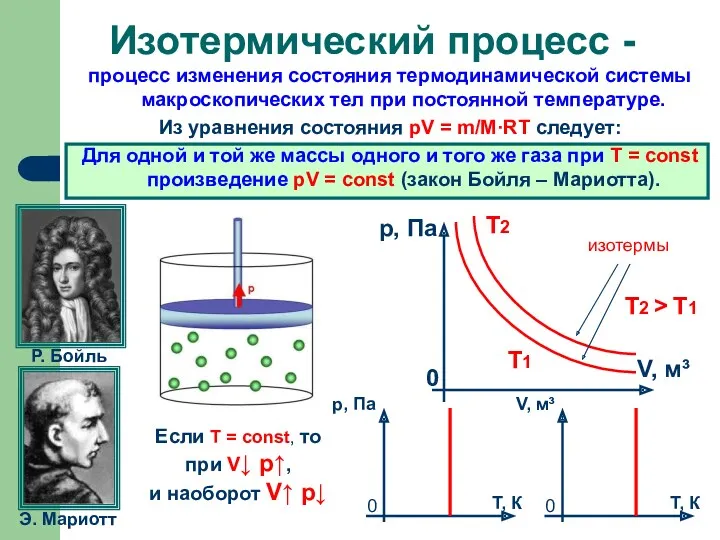
- 5. процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре. Из уравнения состояния pV = m/M·RT
- 6. (Название процесса)
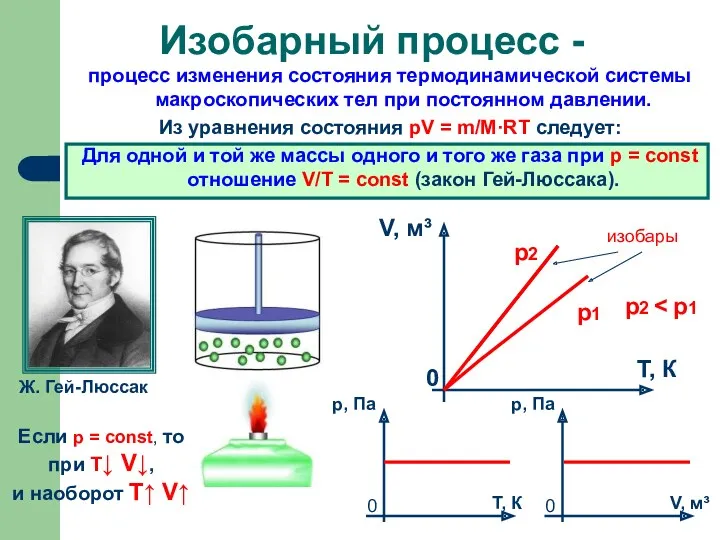
- 7. процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Из уравнения состояния pV = m/M·RT
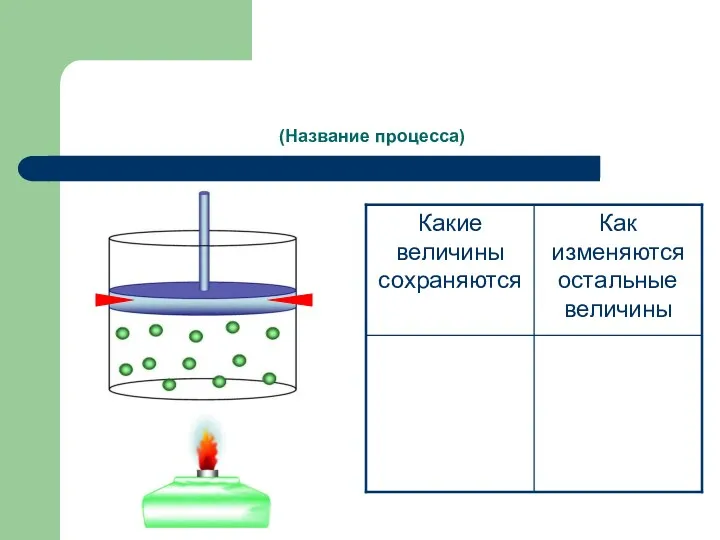
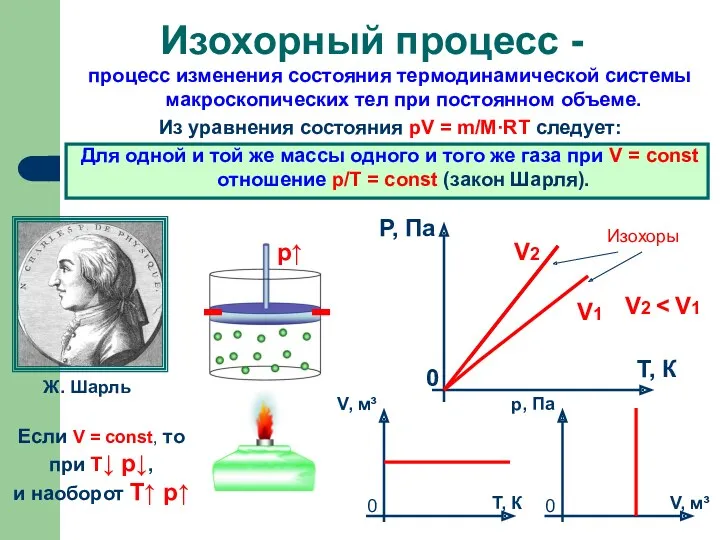
- 8. (Название процесса)
- 9. процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме. Из уравнения состояния pV = m/M·RT
- 11. Скачать презентацию


 Законы Кирхгофа
Законы Кирхгофа Электродинамика, обобщение темы
Электродинамика, обобщение темы US4/ Обновление ПО ГУ
US4/ Обновление ПО ГУ Плавание тел. Урок в физики в 7 классе с применением когнитивной технологии
Плавание тел. Урок в физики в 7 классе с применением когнитивной технологии Численный расчёт температурных полей на поверхности макета моноблока дивертора ИТЭР при высоких тепловых нагрузках
Численный расчёт температурных полей на поверхности макета моноблока дивертора ИТЭР при высоких тепловых нагрузках Подшипники качения
Подшипники качения Элементы трансмиссии в автомобилях
Элементы трансмиссии в автомобилях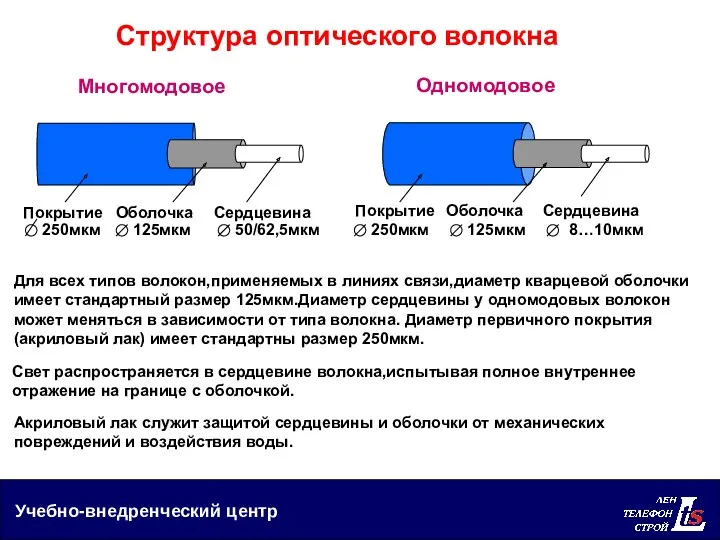 Структура оптического волокна
Структура оптического волокна Електрика: промислова, статична і атмосферна
Електрика: промислова, статична і атмосферна Презентация по Физики 7 класс На тему Механическая работа и мощность.
Презентация по Физики 7 класс На тему Механическая работа и мощность. Магнитные свойства аморфных микропроводов с положительной магнитострикцией
Магнитные свойства аморфных микропроводов с положительной магнитострикцией Требования к элементам дороги в продольном и поперечном профилях. Нормирование продольных уклонов
Требования к элементам дороги в продольном и поперечном профилях. Нормирование продольных уклонов Холодильні машини
Холодильні машини Сила. Явление тяготения. Сила тяжести
Сила. Явление тяготения. Сила тяжести Айналмалы бірқалыпты қозғалыс
Айналмалы бірқалыпты қозғалыс Тепловозные дизели
Тепловозные дизели Швидкість руху тіла
Швидкість руху тіла Схемы электрических соединений на стороне 6-10 кВ. (Лекция 12)
Схемы электрических соединений на стороне 6-10 кВ. (Лекция 12)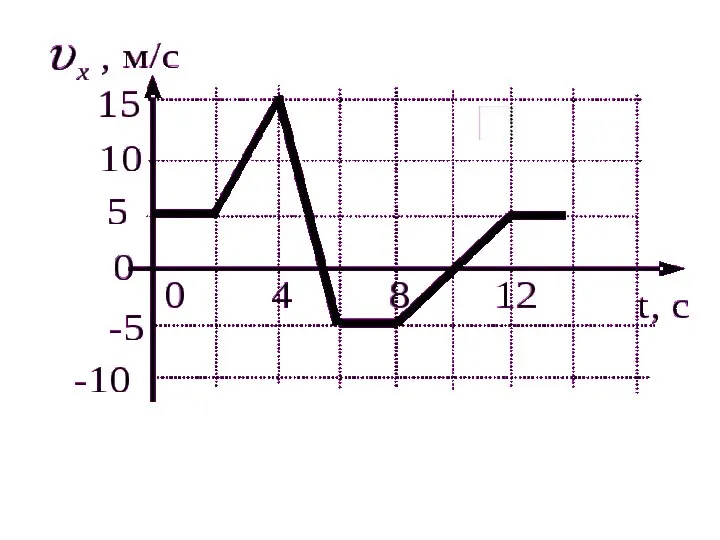 Сложение скоростей
Сложение скоростей Геометрическая оптика. Законы распространения света
Геометрическая оптика. Законы распространения света Експлуатація навчального вертольота. Експлуатація трансмісії
Експлуатація навчального вертольота. Експлуатація трансмісії Тема урока. Индукция магнитного поля.8 класс
Тема урока. Индукция магнитного поля.8 класс Конспект урока. Сила упругости. Закон Гука
Конспект урока. Сила упругости. Закон Гука Ядерная и термоядерная энергетика
Ядерная и термоядерная энергетика Поляризация света
Поляризация света презентация Векторы.Действия над векторами.Проекция вектора
презентация Векторы.Действия над векторами.Проекция вектора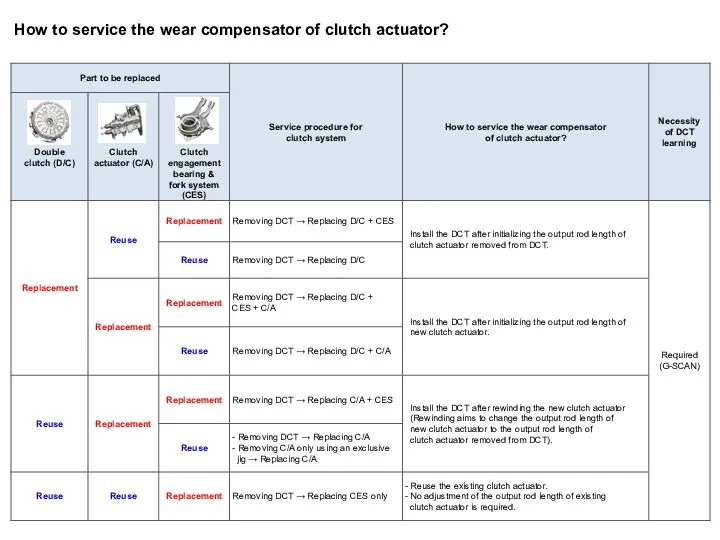 How to service the wear compensator of clutch actuator
How to service the wear compensator of clutch actuator Изменение энергии нейтронов при рассеянии. Замедляющая способность вещества
Изменение энергии нейтронов при рассеянии. Замедляющая способность вещества