Содержание
- 2. ЭЛЕМЕНТЫ СТАТИСТИЧЕСКОЙ ФИЗИКИ
- 3. Основы классической статистики заложены Д.К.Максвеллом (Англия), Л.Больцманом (Германия), В.У.Гиббсом (США) во второй половине XIX столетия. Задачи
- 4. В средине XIX века была сформулирована молекулярно-кинетическая теория, но тогда не было никаких доказательств существования самих
- 5. Проверка факта, что атомы и молекулы идеальных газов в термически равновесном пучке имеют различные скорости, была
- 6. Закономерности, обусловленные большим числом сталкивающихся атомов и молекул, и не свойственные отдельным атомам и молекулам, называются
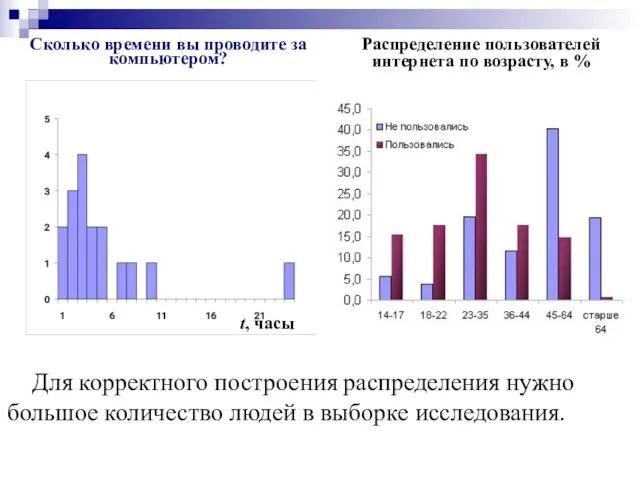
- 7. Сколько времени вы проводите за компьютером? t, часы Для корректного построения распределения нужно большое количество людей
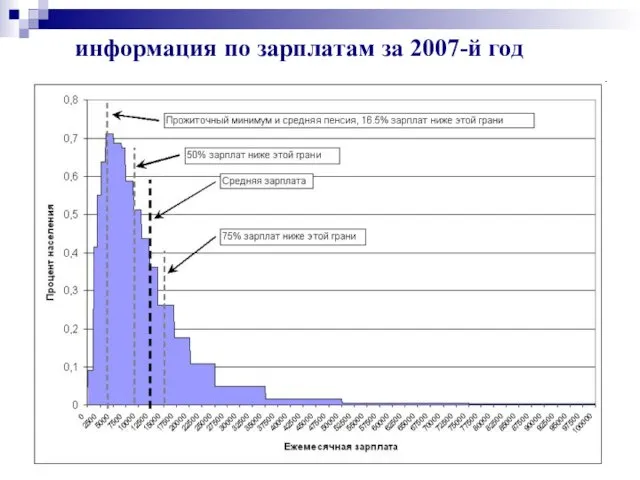
- 8. информация по зарплатам за 2007-й год
- 9. 1. Распределение Максвелла (для описания распределения молекул по скоростям)
- 10. Обозначим: dN – число молекул со скоростями от υ до υ + dυ. N – общее
- 11. – условие нормировки функции распределения Интеграл определяет вероятность того, что скорость молекулы попадает в интервал скоростей
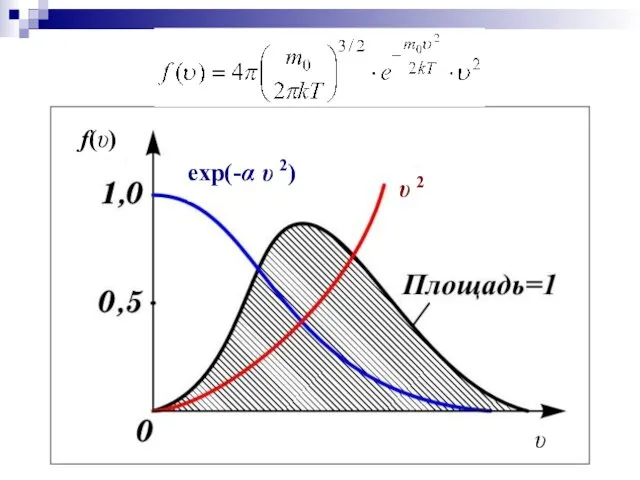
- 12. Явный вид функции f(υ) был получен теоретически Максвеллом в 1859 г. m0 – масса молекулы, Т
- 13. f(υ) υ υ 2 exp(-α υ 2)
- 14. Основные свойства функции распределения 1. При υ=0 и υ=∞ f (υ)=0 – очень большие и маленькие
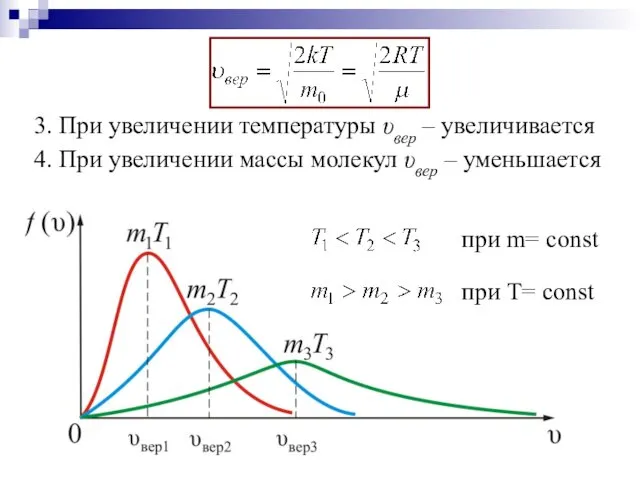
- 15. при Т= const при m= const 3. При увеличении температуры υвер – увеличивается 4. При увеличении
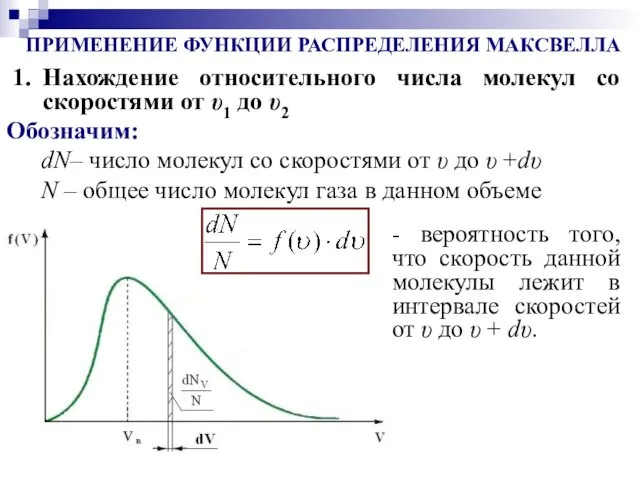
- 17. ПРИМЕНЕНИЕ ФУНКЦИИ РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА Нахождение относительного числа молекул со скоростями от υ1 до υ2 dN– число
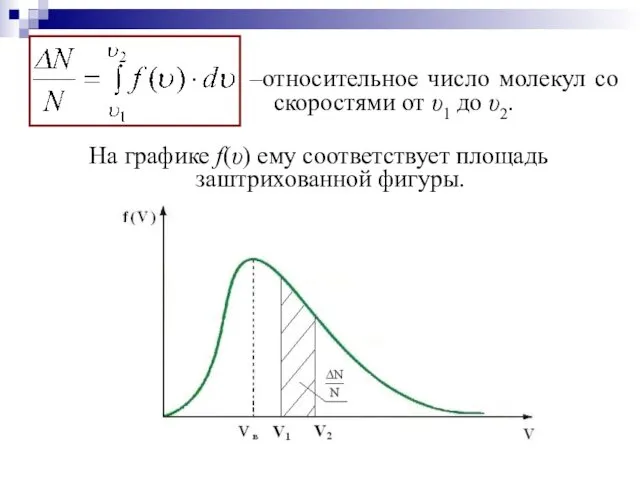
- 18. –относительное число молекул со скоростями от υ1 до υ2. На графике f(υ) ему соответствует площадь заштрихованной
- 19. 2. Нахождение средней скорости молекул υср По определению: Разобьем весь интервал возможных скоростей (от нуля до
- 20. - сумма скоростей молекул, скорости которых лежат в интервале от υ до υ + Δ υ.
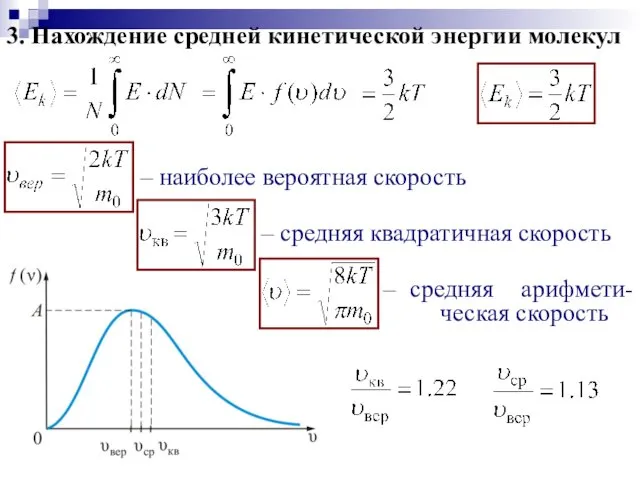
- 21. 3. Нахождение средней кинетической энергии молекул – наиболее вероятная скорость – средняя квадратичная скорость – средняя
- 22. 2. Распределение Больцмана (для описания распределения молекул по высоте в гравитационном поле Земли)
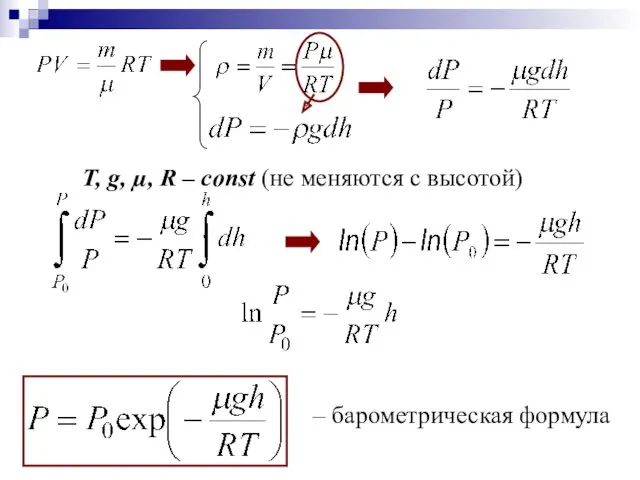
- 23. ИДЕАЛЬНЫЙ ГАЗ В ОДНОРОДНОМ ПОЛЕ ТЯГОТЕНИЯ БАРОМЕТРИЧЕСКАЯ ФОРМУЛА Барометрическая формула выражает зависимость атмосферного давления от высоты
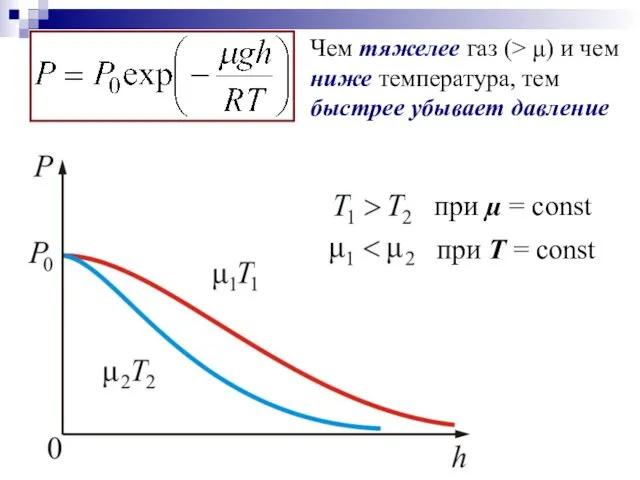
- 24. Т, g, µ, R – const (не меняются с высотой) - дифференциальное уравнение, связывающее давление с
- 25. Чем тяжелее газ (> μ) и чем ниже температура, тем быстрее убывает давление
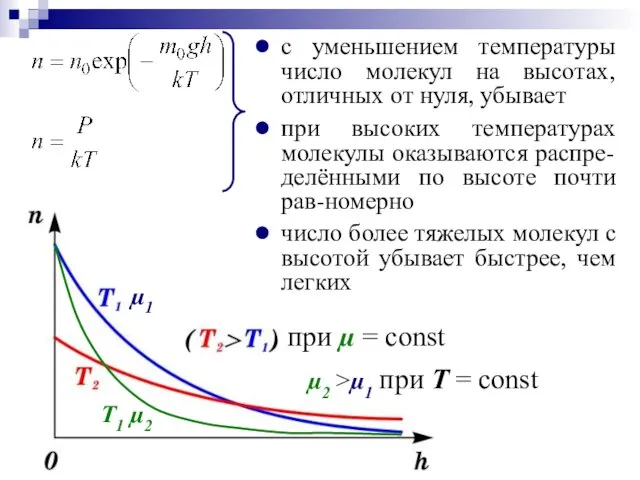
- 26. Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА P0 и
- 27. с уменьшением температуры число молекул на высотах, отличных от нуля, убывает при высоких температурах молекулы оказываются
- 28. Еп = m0gh – потенциальная энергия одной молекулы в поле тяготения на высоте h от уровня
- 30. ЯВЛЕНИЯ ПЕРЕНОСА в неравновесных системах
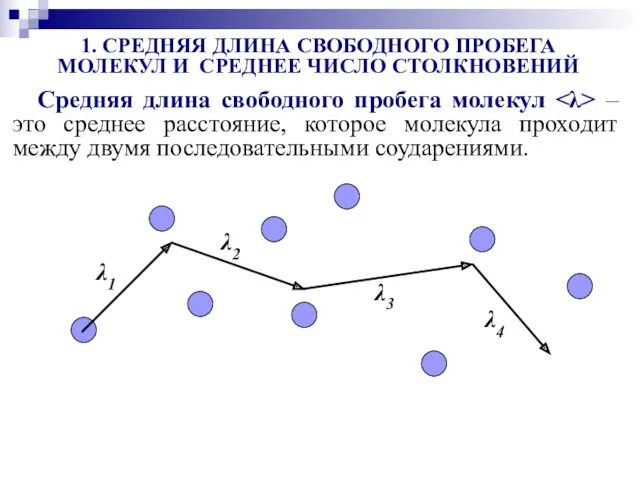
- 31. Средняя длина свободного пробега молекул – это среднее расстояние, которое молекула проходит между двумя последовательными соударениями.
- 32. Эффективный диаметр молекулы dэф – минималь-ное расстояние, на которое сближаются центры молекул при их соударении. определяется
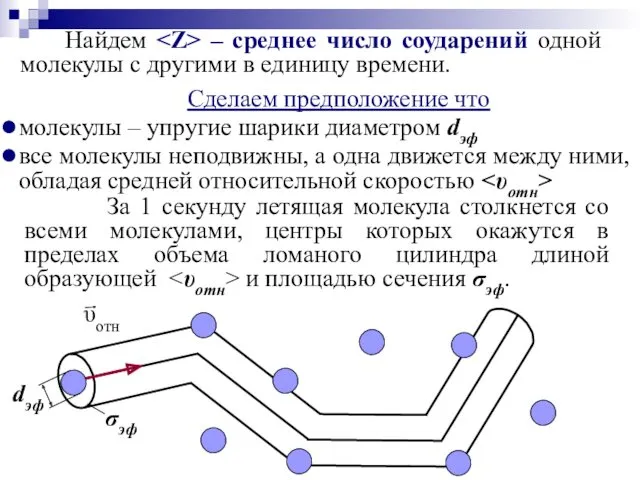
- 33. Сделаем предположение что молекулы – упругие шарики диаметром dэф все молекулы неподвижны, а одна движется между
- 34. – объем цилиндра – среднее число соударений одной молекулы с другими – средняя скорость молекулы, или
- 35. При нормальных условиях (Т = 300 К и Р = 105 Па) для газа с dэф
- 36. 1.V = const => P/T= const, но диаметр слабо уменьша-ется с ростом температуры и увеличивается. 2.
- 37. Явления переноса – круг явлений в термодинами-чески неравновесных системах, в процессе которых происходит выравнивание параметров макроскопи-ческой
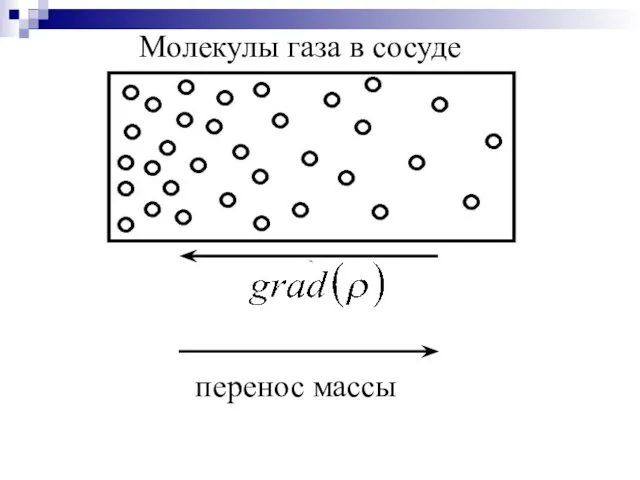
- 38. А) Диффузия – процесс переноса массы вещества молекулами за счет их хаотического движения при наличии градиента
- 39. Математически диффузия описывается законом Фика При диффузии масса переносится из мест с большей концентрацией в места
- 40. перенос массы Молекулы газа в сосуде
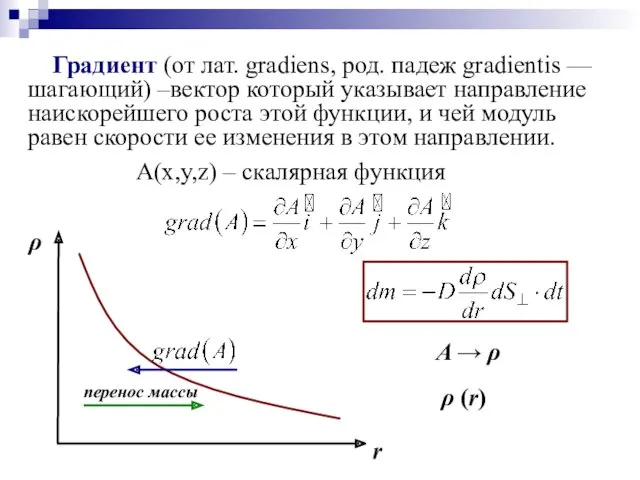
- 41. Градиент (от лат. gradiens, род. падеж gradientis — шагающий) –вектор который указывает направление наискорейшего роста этой
- 42. D – коэффициент диффузии Знак «–» показывает, что перенос массы происходит в направлении убывания плотности (обратно
- 43. Диффузия через пористую перегородку
- 44. Прибор Анселя
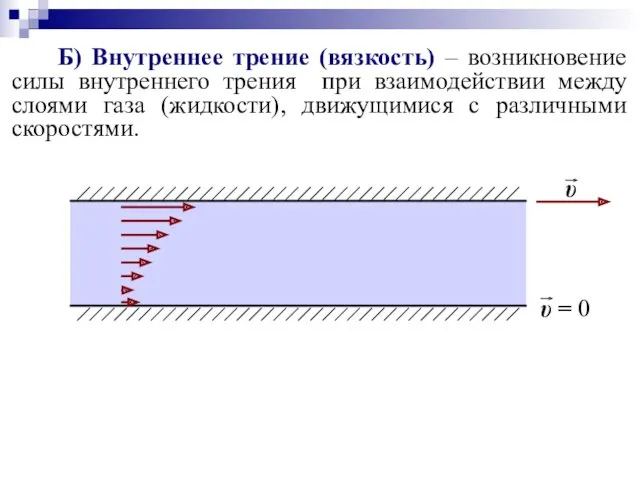
- 45. Б) Внутреннее трение (вязкость) – возникновение силы внутреннего трения при взаимодействии между слоями газа (жидкости), движущимися
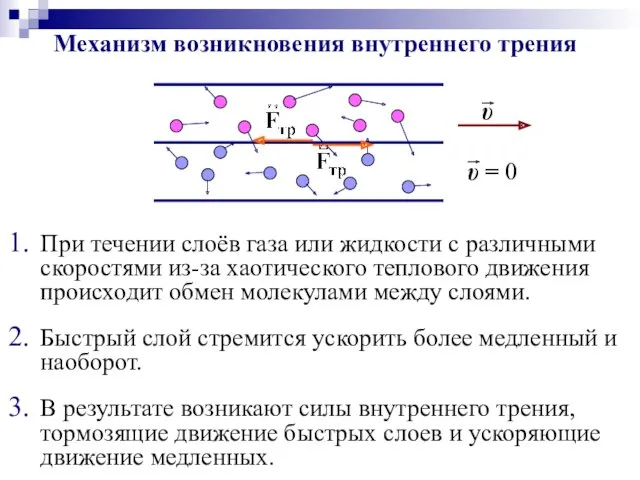
- 46. Механизм возникновения внутреннего трения В результате возникают силы внутреннего трения, тормозящие движение быстрых слоев и ускоряющие
- 47. Внутреннее трение подчиняется закону Ньютона: Вязкое трение в газе (жидкости) – это результат переноса импульса направленного
- 48. – динамическая вязкость (коэффициент вязкости) ρ – плотность газа – сила терния действующая на площадку dS⊥
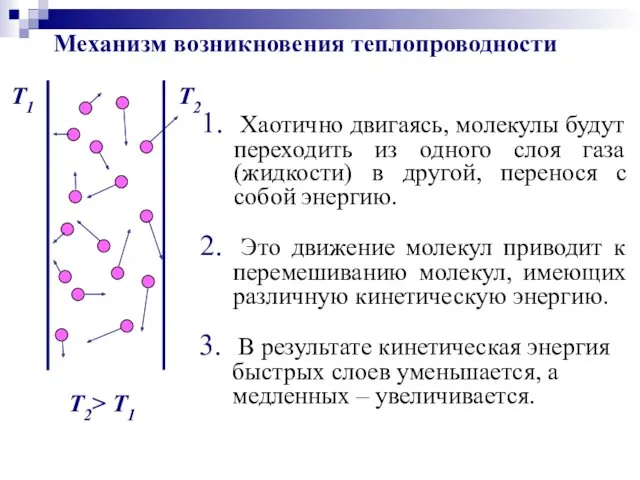
- 50. В) Теплопроводность – процесс выравнивания температуры, сопровождающийся направленным переносом тепловой энергии из более нагретых слоев в
- 51. Хаотично двигаясь, молекулы будут переходить из одного слоя газа (жидкости) в другой, перенося с собой энергию.
- 52. Процесс теплопроводности описывается законом Фурье: При теплопроводности энергия в виде тепла переносится из мест с большей
- 53. Знак «–» показывает, что при теплопроводности энергия переносится в сторону убывания температуры. – тепло переносимое через
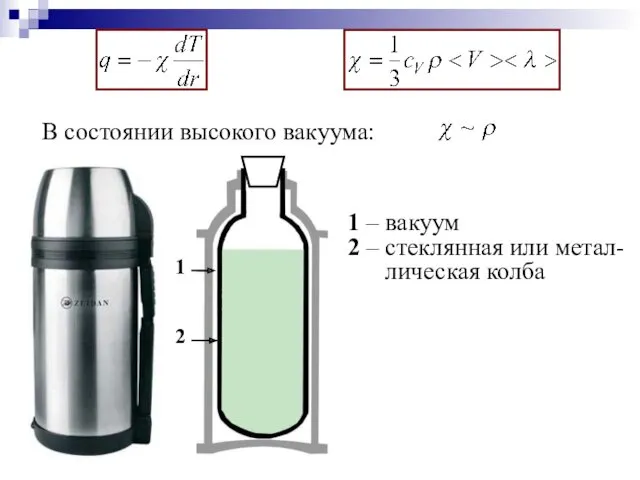
- 54. Коэффициент теплопроводности численно равен количеству теплоты, переносимому через единичную площадку в единицу времени при температурном градиенте,
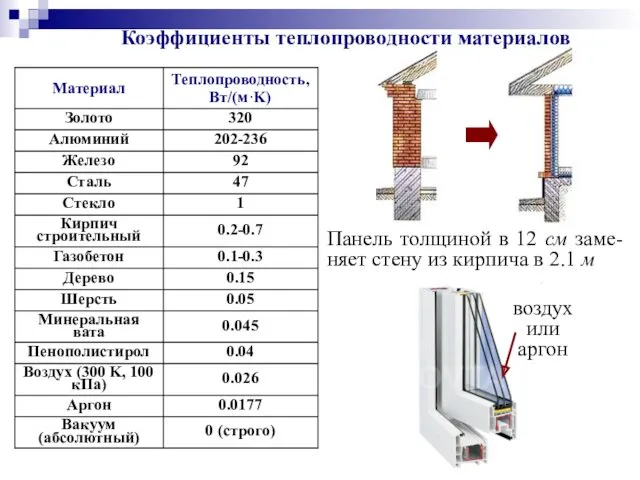
- 55. воздух или аргон Коэффициенты теплопроводности материалов Панель толщиной в 12 см заме-няет стену из кирпича в
- 56. Теплопроводность газов
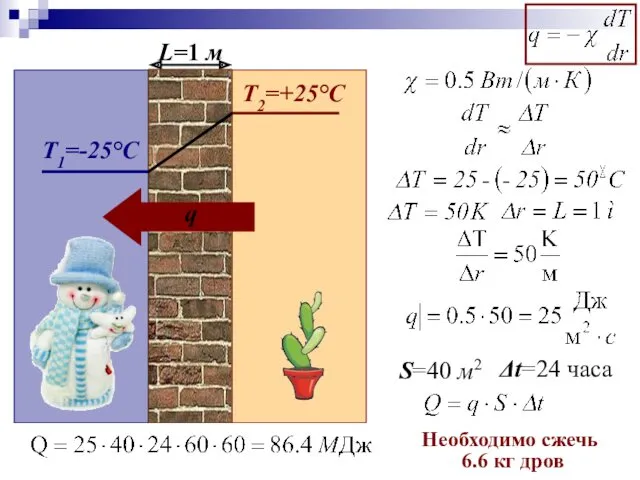
- 57. S=40 м2 Δt=24 часа Необходимо сжечь 6.6 кг дров
- 59. Скачать презентацию




































 Вимірювання неелектричних величин. Перетворювачі
Вимірювання неелектричних величин. Перетворювачі Проницаемость
Проницаемость Магнит өрісі. Тұрақты магниттер. Тогы бар катушка мен токтың магнит өріс. Электромагниттер
Магнит өрісі. Тұрақты магниттер. Тогы бар катушка мен токтың магнит өріс. Электромагниттер Банк российских и зарубежных мультимедийных средств обучения по физике
Банк российских и зарубежных мультимедийных средств обучения по физике Ионно- диффузионные методы ХТО
Ионно- диффузионные методы ХТО Механика. Механическое движение
Механика. Механическое движение Колесная пара
Колесная пара Интеллектуальное соревнование Гауссы и Ньютоны
Интеллектуальное соревнование Гауссы и Ньютоны Тепловые машины
Тепловые машины Что изучает физика. Междисциплинарные связи
Что изучает физика. Междисциплинарные связи Волновые свойства света
Волновые свойства света Магнитные свойства вещества
Магнитные свойства вещества Потенциал и работа электростатического поля. Связь напряженности с потенциалом
Потенциал и работа электростатического поля. Связь напряженности с потенциалом Типовые соединения, применяемые в электроустановках. Методы и средства контроля размеров и качества сборки
Типовые соединения, применяемые в электроустановках. Методы и средства контроля размеров и качества сборки Гидравлические сопротивления и потери энергии
Гидравлические сопротивления и потери энергии Равномерное движение по окружности. Решение задач.
Равномерное движение по окружности. Решение задач. Магнитное поле. Электромагнитная индукция
Магнитное поле. Электромагнитная индукция Урок физики в 8 классе Электризация тел
Урок физики в 8 классе Электризация тел Основные свойства диэлектриков. Сегнетоэлектрики
Основные свойства диэлектриков. Сегнетоэлектрики Радиоактивные превращения атомных ядер
Радиоактивные превращения атомных ядер Курс лекций по сопротивлению материалов (модуль 2, лекции 9-17)
Курс лекций по сопротивлению материалов (модуль 2, лекции 9-17) РАБОТА. МОЩНОСТЬ. ЭНЕРГИЯ.ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ.
РАБОТА. МОЩНОСТЬ. ЭНЕРГИЯ.ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ. Презентация к уроку в 10 классе на тему: Физика и научный метод познания
Презентация к уроку в 10 классе на тему: Физика и научный метод познания Структурные элементы механизмов
Структурные элементы механизмов Открытый урок по физике в 9 классе Реактивное движение
Открытый урок по физике в 9 классе Реактивное движение Устройство и ТО автомобиля
Устройство и ТО автомобиля Yüzey ve kompozi̇syon (9)
Yüzey ve kompozi̇syon (9) Ауырлық күші. Тұрақты шама
Ауырлық күші. Тұрақты шама