Содержание
- 2. Основне рівняння молекулярно-кінетичної теорії ідеального газу для тиску. Середня кінетична енергія молекул. Молекулярно-кінетичне тлумачення абсолютної температури.
- 3. Молекулярна фізика і термодинаміка – розділи фізики, в яких вивчаються макроскопічні процеси в тілах, що зв’язані
- 4. У молекулярно-кінетичній теорії користуються моделлю ідеального газу, що задовольняє такі умови: 1) власний об’єм молекул газу
- 5. Середня кінетична енергія молекул Отже, середня кінетична енергія поступального руху молекул ідеального газу залежить тільки від
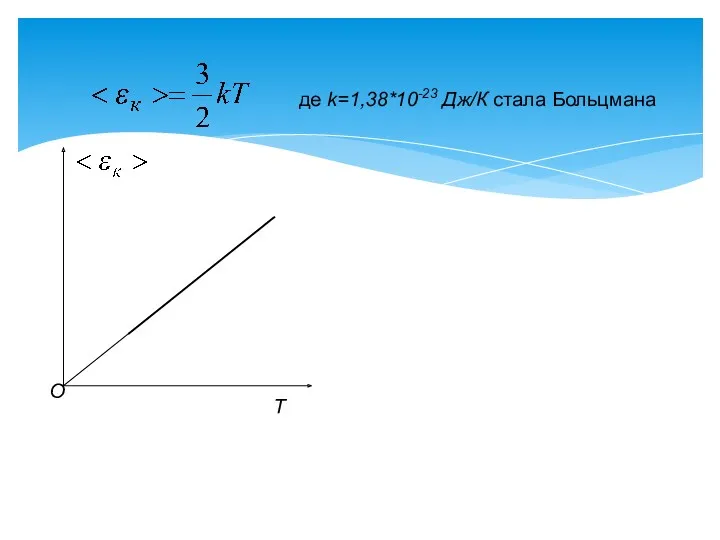
- 6. Абсолютна температура є міра середньої кінетичної енергії поступального руху молекул. де k=1,38*10-23 Дж/К стала Больцмана
- 7. Мінімальна відстань, на яку зближуються при зіткненні центри двох молекул, називається ефективним діаметром молекули. Середнє число
- 8. Закон рівномірного розподілу енергії за ступенями вільності молекул. Числом ступенів вільності називають найменше число координат, які
- 9. Закон Больцмана про рівномірний розподіл енергій за ступенями вільності молекул: Для статичної системи, що перебуває у
- 10. Внутрішня енергія – це енергія хаотичного (теплового) руху мікрочастинок системи (молекул, атомів, електронів, ядер і тощо)
- 11. Теплота, надана системі, витрача¬єть¬ся на збільшення її внутрішньої енергії і на виконання системою роботи проти зов¬ніш¬ніх
- 13. Скачать презентацию









 Презентация по теме Деформация. Виды деформации
Презентация по теме Деформация. Виды деформации Турбомашиналардың паралель жұмыс істеуі бір
Турбомашиналардың паралель жұмыс істеуі бір Система сходящихся сил. Основные понятия статики
Система сходящихся сил. Основные понятия статики Импульс тела презентация к уроку физики
Импульс тела презентация к уроку физики Рулевое управление. Устройство автомобиля
Рулевое управление. Устройство автомобиля Законы геометрической оптики: отражение, преломление, полное внутреннее отражение, предельный угол преломления
Законы геометрической оптики: отражение, преломление, полное внутреннее отражение, предельный угол преломления техника философиясы
техника философиясы Механические свойства твердых тел
Механические свойства твердых тел Звук, инфразвук, ультразвук
Звук, инфразвук, ультразвук Разработка урока физики 10 класс
Разработка урока физики 10 класс Тиристор деп төрт деңгейлі жартылай өткізгіш құрылғылардын
Тиристор деп төрт деңгейлі жартылай өткізгіш құрылғылардын Проект От опытных фактов – к научной гипотезе или заглядывая вглубь Вселенной
Проект От опытных фактов – к научной гипотезе или заглядывая вглубь Вселенной Линзы. Построение изображений, даваемых линзой.
Линзы. Построение изображений, даваемых линзой. Сообщающиеся сосуды
Сообщающиеся сосуды Лекция №6 (6 ). Поле системы элементарных излучателей
Лекция №6 (6 ). Поле системы элементарных излучателей презентация Сила трения
презентация Сила трения Теоретические и правовые основы метрологического обеспечения
Теоретические и правовые основы метрологического обеспечения Авиационные преобразователи электрической энергии
Авиационные преобразователи электрической энергии Магнітне поле постійного струму
Магнітне поле постійного струму Cathode Ray Oscilloscope
Cathode Ray Oscilloscope Электрическая цепь и ее элементы
Электрическая цепь и ее элементы Электрический ток в металлах. Действия электрического тока
Электрический ток в металлах. Действия электрического тока Импульсные сигналы и переходные процессы. Общие сведения об импульсных сигналах
Импульсные сигналы и переходные процессы. Общие сведения об импульсных сигналах Жылу мөлшері. Заттың меншікті жылусыйымдылығы
Жылу мөлшері. Заттың меншікті жылусыйымдылығы Простые механизмы
Простые механизмы Конспект урока с презентацией по физике 7 класс Диффузия
Конспект урока с презентацией по физике 7 класс Диффузия Гидравлический пресс
Гидравлический пресс Уравнение динамики идеальной сплошной среды. Модель линий ток. Уравнение динамики при возмущении среды
Уравнение динамики идеальной сплошной среды. Модель линий ток. Уравнение динамики при возмущении среды