Слайд 2

План лекції
1. Будова полум’я
1.1. Зони полум’я
1.2. Температурний режим полум’я
1.3. Колір
дифузійного полум’я
2. Основні теорії, що пояснюють процеси в полум’ї
2.1. Перекісна теорія окислення
2.2. Ланцюгова теорія окислення
Слайд 3

1. БУДОВА ПОЛУМ’Я
Полум’я – це газовий об’єм, в якому відбуваються всі
процеси, що пов’язані з підготовкою горючої суміші до горіння і сам процес горіння.
Види полум'я:
кінетичне та дифузійне;
ламінарне та турбулентне.
Висота ламінарного полум'я:
де w - швидкість витікання газу;
d - діаметр пальника;
D - коефіцієнт дифузії.
Слайд 4
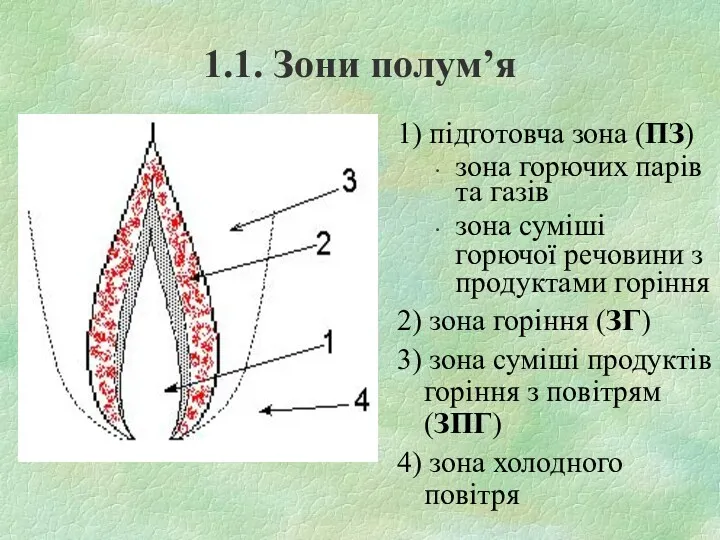
1.1. Зони полум’я
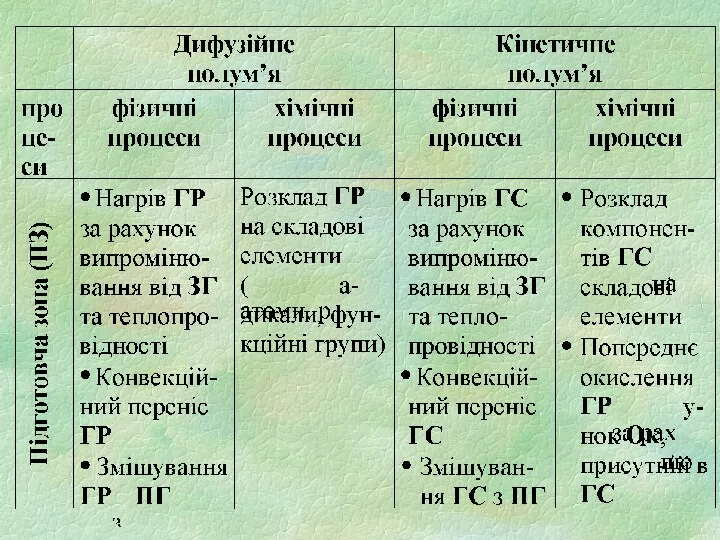
1) підготовча зона (ПЗ)
зона горючих парів та газів
зона суміші
горючої речовини з продуктами горіння
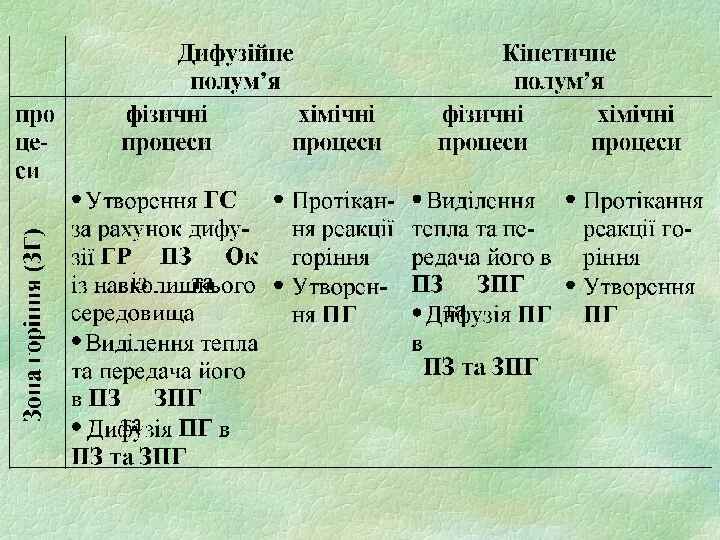
2) зона горіння (ЗГ)
3) зона суміші продуктів горіння з повітрям (ЗПГ)
4) зона холодного повітря
Слайд 5
Слайд 6
Слайд 7

Слайд 8
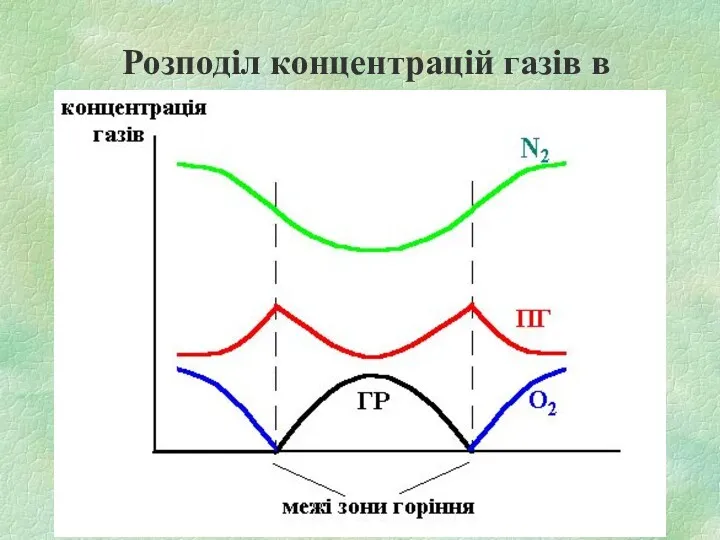
Розподіл концентрацій газів в дифузійному полум'ї
Слайд 9
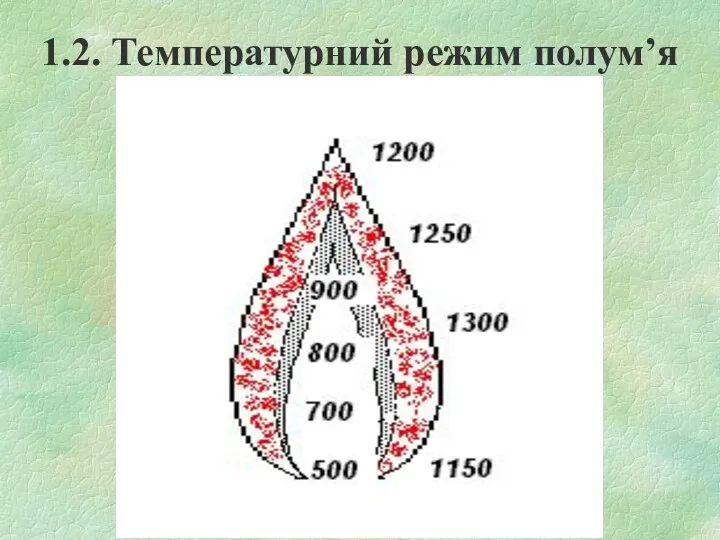
1.2. Температурний режим полум’я
Слайд 10

Температура в ПЗ значно нижча, ніж в ЗГ.
Температура ЗГ найбільша, але
неоднакова в різних по висоті точках полум’я. Пояснюється це зміною складу суміші в зоні горіння та витратами тепла на нагрів компонентів, які поступають в цю зону.
Температура в ЗПГ падає за рахунок розбавлення гарячих продуктів горіння холодним повітрям, яке дифундує із навколишнього середовища.
Температура дифузійного полум’я завжди менша, ніж кінетичного. Це пояснюється тим, що тепловтрати із ЗГ за рахунок випромінювання у кінетичного полум’я значно менші, ніж у дифузійного.
Слайд 11

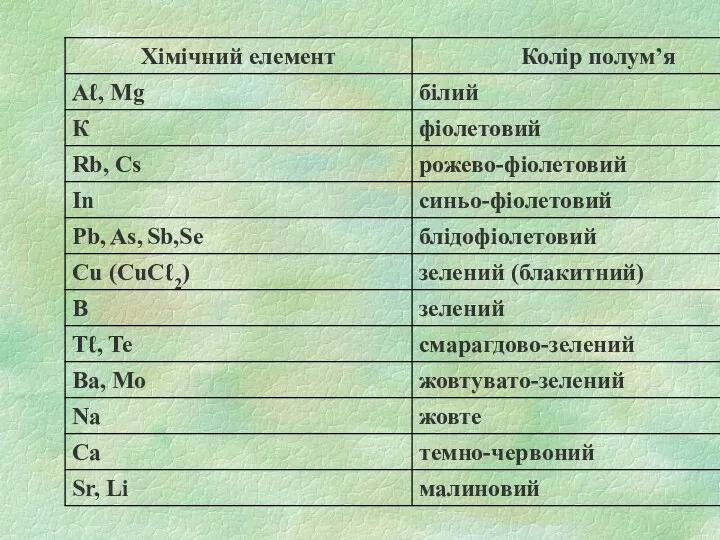
1.3. Колір дифузійного полум’я
Термічне розкладання речовин в підготовчій зоні:
СН2О2 = СО+
ОН+ Н ;
С3Н6О = СО +2С +6Н;
С8Н18 = 8С + 18Н
Окислення в зоні горіння:
СО +0,5 О2 = СО2 ;
ОН + 0,5 О2 =Н2О;
Н+ 0,5 О2 = Н2О.
Слайд 12

Залежність кольору дифузійного полум’я від вмісту деяких компонентів
Слайд 13
Слайд 14

2. ОСНОВНІ ТЕОРІЇ, ЩО ПОЯСНЮЮТЬ ПРОЦЕСИ В ПОЛУМ’Ї
2.1. Ланцюгова теорія окислення
Активні
центри полум'я (АЦП) − це частки (атоми, радикали чи функціональні групи), які мають енергію, більшу, ніж Еакт , що обумовлює їх високу реакційну спроможність.
Ланцюговими називають процеси, у яких перетворення вихідних речовин у продукти реакції здійснюється шляхом регулярного чергування декількох реакцій за участю АЦП.
Слайд 15

ТИПИ ЛАНЦЮГОВИХ РЕАКЦІЙ
Зародження (ініціювання) ланцюгів - стадія ланцюгової реакції, в якій
утворюються вільні радикали з валентнонасичених молекул:
Н2 + О2 = Н* + НО•2
Продовження ланцюга - стадія ланцюгової реакції, що йде із збереженням вільної валентності (один АЦП вступає в реакцію, внаслідок якої один АЦП утворюється):
ОН* + Н2 = Н2О + Н*
Слайд 16

Розгалуження ланцюгів - стадія ланцюгового процесу, у якій перетворення активних проміжних
продуктів реакції призводить до збільшення числа вільних радикалів (один АЦП вступає в реакцію, внаслідок якої утворюється два чи більше АЦП):
Н* + О2 = ОН* + *О*
Обрив ланцюга - стадія ланцюгового процесу, що призводить до зникнення вільної валентності.
Н* + ОН* + М = Н2О + М
Слайд 17
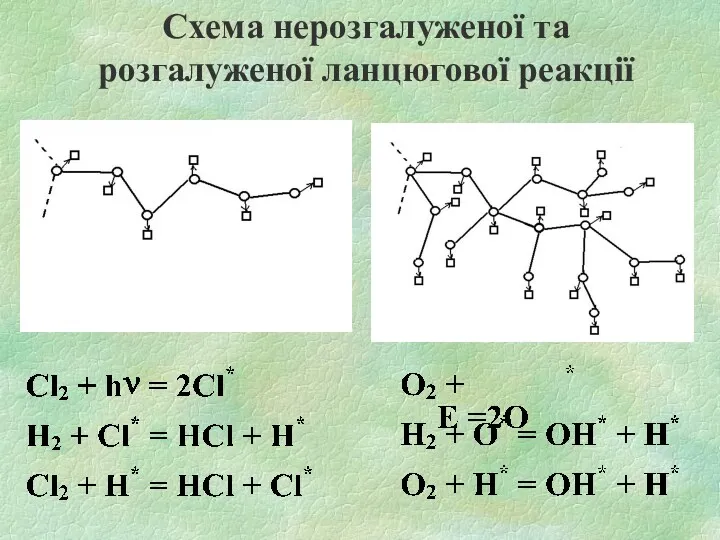
Схема нерозгалуженої та розгалуженої ланцюгової реакції
Слайд 18

Швидкість ланцюгової реакції:
ωлр = ωо + ωf – ωg
ωо - швидкість
початкового ініціювання (утворення) АЦП,
ωf - швидкість розгалуження ланцюга;
ωg - швидкість обриву ланцюга.
Умовою виникнення горіння є значне перебільшення швидкості реакції розгалуження над швидкістю обриву ланцюга ωf >> ωg. При цьому загальна швидкість процесу ωлр різко збільшується, реакція окислення переходить у процес горіння.
Слайд 19

2.2. Перекисна теорія окислення
ГР + Ок → перекис → ПГ
O=O + Е → – O – + – O – + 488 кДж
O=O + Е → – O – O – + 323 кДж
R-CH2 – О – О – CH2 –R → 2 R –CH2 – О –
R-O-O-H → RO* +ОН*
R-O-O-H + R-O-O-H → RO* +H2O +RO2*
Слайд 20

Пожежна небезпека органічних перекисей
1. Сильні окисники
С4H100 + 12Н202 =
4СО2+17Н2О - ΔH
2. Легко займаються від малопотужних джерел запалювання та згоряють із великою швидкістю.
3. Чутливі до тертя, удару або нагрівання.
4. Нестабільні в процесі зберігання. Можуть розкладатися за нормальної температури з вибухом.



















 Презентация к уроку физики в 7 классе Путешествие в Королевство Сил
Презентация к уроку физики в 7 классе Путешествие в Королевство Сил Использование ИКТ на уроках физики. Основная роль ИКТ в работе учителя
Использование ИКТ на уроках физики. Основная роль ИКТ в работе учителя Diffraction grating
Diffraction grating Жұмыс орындарындағы электромагниттік сәулеленулер
Жұмыс орындарындағы электромагниттік сәулеленулер Приборы электромагнитной и электродинамической систем
Приборы электромагнитной и электродинамической систем Расчет давления жидкости на дно и стенки сосуда
Расчет давления жидкости на дно и стенки сосуда Определение по заданному обозначению посадки, предельных отклонений и размеров элементов деталей, допусков отверстия вала
Определение по заданному обозначению посадки, предельных отклонений и размеров элементов деталей, допусков отверстия вала Основные понятия теории механизмов и машин
Основные понятия теории механизмов и машин Эксперимент – как метод активизации мыслительной деятельности учащихся на уроках физики
Эксперимент – как метод активизации мыслительной деятельности учащихся на уроках физики Механизмдердің күштік талдауының кинеитостатикалық әдісі
Механизмдердің күштік талдауының кинеитостатикалық әдісі Оптика
Оптика Методическая разработка урока Плотность вещества
Методическая разработка урока Плотность вещества Кольца Ньютона
Кольца Ньютона Водородоподобные системы в квантовой механике
Водородоподобные системы в квантовой механике Квалиметриялық шкалалар
Квалиметриялық шкалалар Презентация для 8 класса Испарение и конденсация
Презентация для 8 класса Испарение и конденсация Векторная диаграмма токов и напряжений
Векторная диаграмма токов и напряжений Общая химическая технология. Кинетика ХТП. Понятия движущей силы. Лекция №1
Общая химическая технология. Кинетика ХТП. Понятия движущей силы. Лекция №1 Ремонт и обслуживание проточного водонагревателя
Ремонт и обслуживание проточного водонагревателя Гидравлический пресс
Гидравлический пресс Решение задач по геометрической оптике
Решение задач по геометрической оптике Механічна робота. Потужність
Механічна робота. Потужність Рентгенофазовый анализ
Рентгенофазовый анализ Курс физики
Курс физики Презентация. Построение векторной диаграммы
Презентация. Построение векторной диаграммы Презентация по физике для 10 класса МКТ газов
Презентация по физике для 10 класса МКТ газов Основные положения МКТ.
Основные положения МКТ. Действие электрического тока на организм человека. (Лекция 6)
Действие электрического тока на организм человека. (Лекция 6)