Слайд 2

Молекулярная физика – раздел физики, изучающий внутреннее строение тел, а также
тепловые процессы, происходящие внутри вещества
Слайд 3

Молекула – наименьшая устойчивая частица вещества, обладающая его химиченскими свойствами. Молекулы
образуются из атомов.
Атом – наименьшая частица химического элемента, носитель его свойств.
Слайд 4

Тепловое движение.
Макроскопические тела.
Тепловые явления.
Слайд 5

Основные положения молекулярно-кинетической теории.
Слайд 6

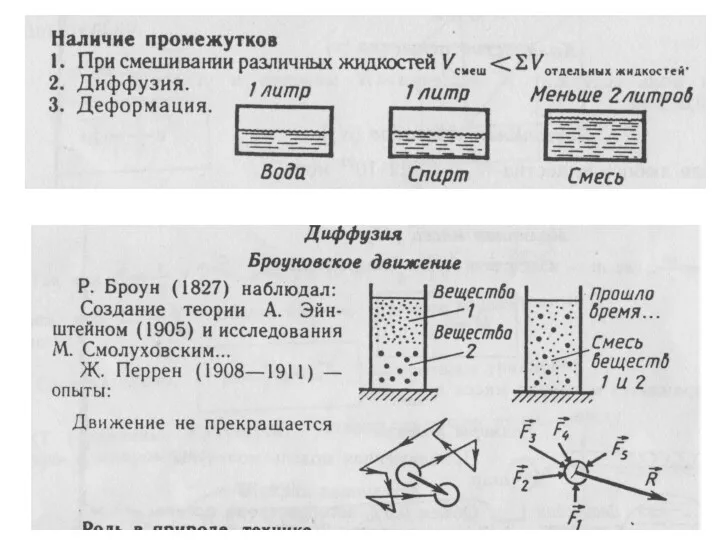
положение № 1 – все вещества состоят из частиц (молекул,
атомов, ионов …) между которыми есть промежутки. положение № 2 – частицы находятся в постоянном, беспорядочном (хаотичном движении (тепловое движение).
положение № 3 – между молекулами существует межмолекулярное взаимодействие (притяжение и отталкивание).
Слайд 7

положение № 1 – все вещества состоят из частиц (молекул,
атомов, ионов …) между которыми есть промежутки.
Опытные обоснования:
Крошение вещества
Испарение жидкостей
Смешивание веществ; диффузия
Фотографии туннельного микроскопа
Растворимость
Сжимаемость веществ
Слайд 8

положение № 2 – частицы находятся в постоянном, беспорядочном (хаотичном
движении (тепловое движение).
Опытные обоснования:
1. Испарение
2. Диффузия (самопроизвольное проникновение частиц одного вещества между частицами другого вещества. Скорость диффузии зависит от температуры и агрегатного состояния вещества).
Слайд 9

3. Броуновское движение (хаотическое движение взвешенных частиц в жидкости или
газе частиц под действием нескомпенсированных ударов молекул жидкости или газа).
4. Давление газа на стенки сосуда.
5. Стремление газа занять любой объем.
Слайд 10

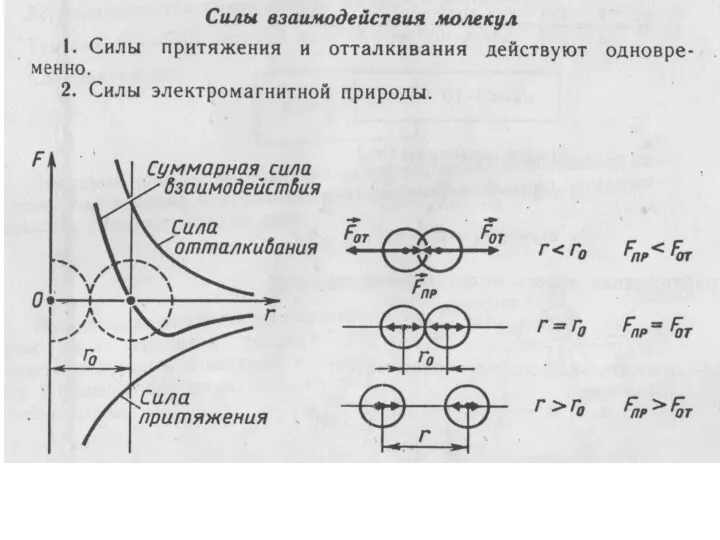
положение № 3 – между молекулами существует межмолекулярное взаимодействие (притяжение
и отталкивание).
Опытные обоснования:
1. Деформация тела
2. Сохранение формы твердого тела
3. Существование жидкостей.
4. Наличие промежутков между частицами.
5. Смачивание.
6. Молекулярное сцепление.
Слайд 11
Слайд 12
Слайд 13

Агрегатные состояния вещества
Слайд 14

Слайд 15
Агрегатные состояния вещества
Слайд 16

Масса молекул. Количество вещества.
Слайд 17

Количество вещества
Один моль - это количество вещества, в котором содержится столько
же частиц, сколько атомов в в углероде массой 0,012 кг.
N молекул = N молекул в углероде массой 0,012 кг
Слайд 18

Число Авогадро (NA)
В моле любого вещества
NA = 6,02*1023 1/моль
Слайд 19

Слайд 20

Слайд 21





















 Кинематика передач
Кинематика передач Мир физики
Мир физики Световая волна. Интерференция света. Когерентность
Световая волна. Интерференция света. Когерентность КПД простых механизмов. Уроки физики в 7 классе
КПД простых механизмов. Уроки физики в 7 классе Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы
Дисперстік жүйелердің тұрақтылығы. ДЛФО теориясы Силы электромагнитной природы.
Силы электромагнитной природы. Повышение качества обработки колец подшипников
Повышение качества обработки колец подшипников Электроснабжение промышленных предприятий
Электроснабжение промышленных предприятий Силы в природе. Понятие силы
Силы в природе. Понятие силы Общее устройство автомобилей
Общее устройство автомобилей Общие сведения о зубчатых передачах
Общие сведения о зубчатых передачах Применение фотоэффекта
Применение фотоэффекта Лампа накаливания. История создания. Современная конструкция
Лампа накаливания. История создания. Современная конструкция Функциональная оптоэлектроника. УФЭ (6)
Функциональная оптоэлектроника. УФЭ (6) Влажность воздуха.Способы определения влажности воздуха.
Влажность воздуха.Способы определения влажности воздуха. Теоретическая механика как наука и ее место среди естественных наук
Теоретическая механика как наука и ее место среди естественных наук Химическое равновесие и химическая кинетика
Химическое равновесие и химическая кинетика Принципы построения автоматических систем
Принципы построения автоматических систем Философские проблемы науки и техники. Классическая механика. (Лекция 5)
Философские проблемы науки и техники. Классическая механика. (Лекция 5) Равномерное движение по окружности
Равномерное движение по окружности Сила трения в природе и технике
Сила трения в природе и технике Работа Электрического тока
Работа Электрического тока Диффузия в газах, жидкостях и твердых телах
Диффузия в газах, жидкостях и твердых телах Электрические контакты и условия работы
Электрические контакты и условия работы Проектировочный расчет закрытой зубчатой передачи
Проектировочный расчет закрытой зубчатой передачи Электронные процессы в твердом теле. Оптические явления в твердом теле
Электронные процессы в твердом теле. Оптические явления в твердом теле Карбюраторные двигатели
Карбюраторные двигатели Электропроводность полупроводников. Электронно-дырочный переход и его свойства
Электропроводность полупроводников. Электронно-дырочный переход и его свойства