Содержание
- 2. Статистический и термодинамический методы Молекулярная физика и термодинамика изучают явления, именуемые тепловыми. Они связаны с процессами,
- 3. Термодинамика возникла в 1-ой половине 19 века и ставила своей первой задачей изучить процессы превращения тепла
- 4. Статистическая физика (молекулярная физика) исходит из представления об атомарно-молекулярном строении вещества и рассматривает теплоту как беспорядочное
- 5. Основные понятия и определения молекулярной физики и термодинамики Совокупность тел, составляющих макроскопическую систему, называется термодинамической системой.
- 6. Равновесной, называется такая система, макроскопические параметры состояния которой одинаковы во всех точках системы и не изменяются
- 7. Если равновесие установилось, то система самопроизвольно не сможет выйти из него. Например, если опустить горячий камень
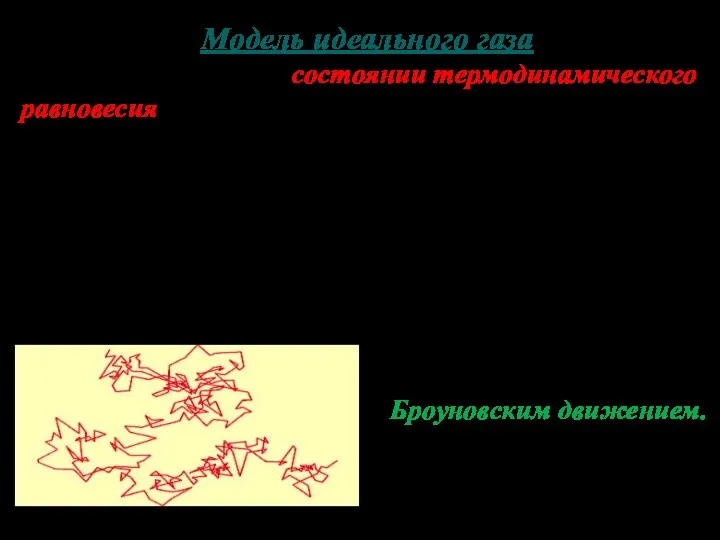
- 8. Модель идеального газа Если газ находится в состоянии термодинамического равновесия, атомы и молекулы движутся хаотически (или
- 9. Объясняется оно тем, что частицы спор со всех сторон “толкают “ молекулы воды, которые движутся беспорядочно
- 10. Такое представление о газе называют моделью идеального газа: Молекулы газа рассматриваются как материальные точки, не имеющие
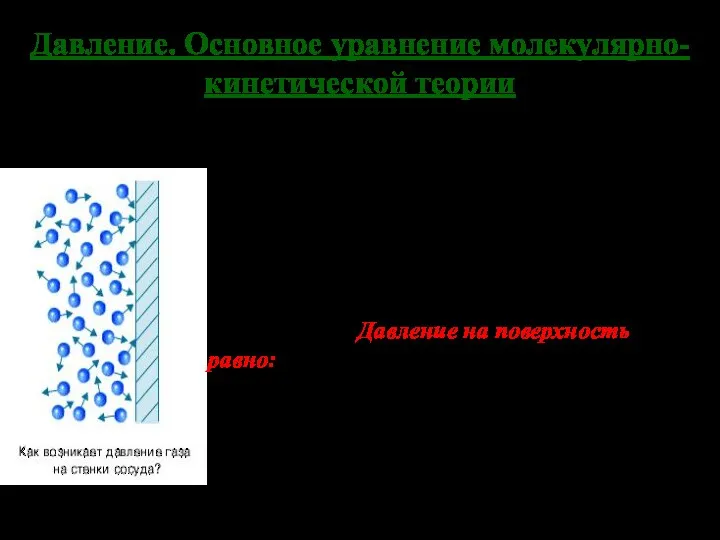
- 11. Давление. Основное уравнение молекулярно-кинетической теории Давление газа на стенку сосуда – это результат столкновений молекул с
- 12. Рассматривая давление на стенки сосуда как средний импульс, передаваемый единичной стенке молекулами газа в ходе соударений
- 13. Мы видим,что давление газов определяется средней кинетической энергией поступательного движения молекул, находящихся в единице объема. Единицы
- 14. Температура и средняя кинетическая энергия теплового движения молекул Из опыта известно, что если привести в соприкосно-вение
- 15. Опыт показывает: каково бы ни было состояние тел изолированной системы, в ней в конце концов установится
- 16. Введем новое понятие – энергетическая температура : , Итак, энергетическая температура – это средняя кинетическая энергия
- 17. Измерять температуру научились задолго до того, как поняли физический смысл температуры. Чтобы связать энергию с измеряемой
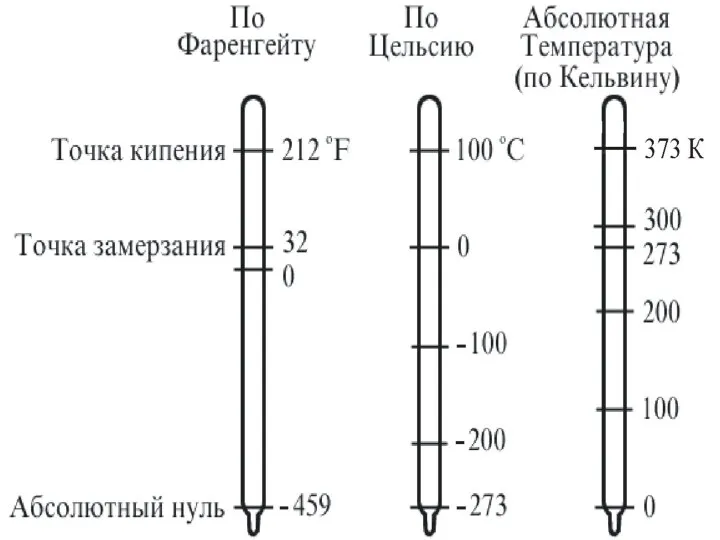
- 18. Величину T называют абсолютной температурой и измеряют в Кельвинах (К). Она служит мерой кинетической энергии теплового
- 19. Так как температура определяется средней энергией движения молекул, то она, как и давление, является статистической величиной,
- 20. Термометры. Единицы измерения температуры Наиболее естественно было бы использовать для измерения температуры определение т.е. измерять кинетическую
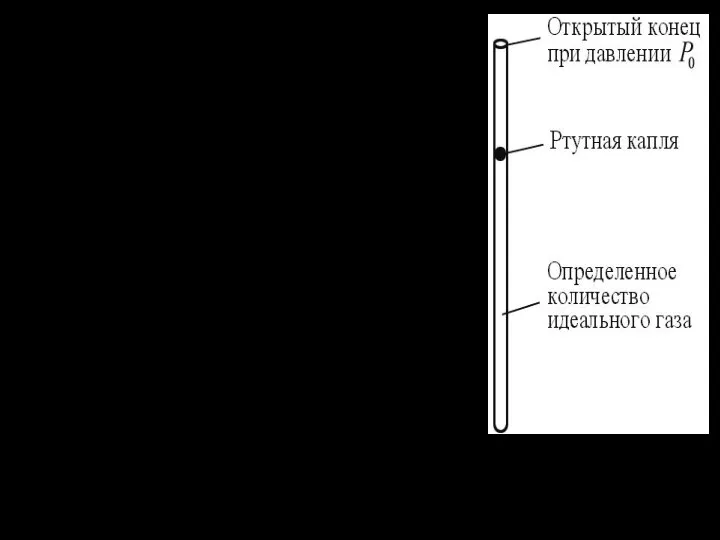
- 21. В качестве примера рассмотрим изображенный на рисунке простейший газовый термометр с постоянным давлением. Пусть количество молекул
- 22. Если же в трубку вместо идеального газа поместить фиксированное количество жидкой ртути, то мы получим обычный
- 23. В физике и технике за абсолютную шкалу температур принята шкала Кельвина, названная в честь знаменитого английского
- 24. Цельсий Андерс (1701 – 1744) – шведский астроном и физик. Работы относятся к астрономии, геофизике, физике.
- 25. Так как всегда, то и Т не может быть отрицательной величиной. При T = 0 (абсолютный
- 26. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) Параметры состояния термодинамической системы закономерно связаны между собой. Соотношение, определяющее
- 27. Введем еще несколько понятий и величин. Моль - количество вещества, содержащее столько атомов (или молекул) сколько
- 28. Уравнение, связывающее основные параметры состояния идеального газа вывел великий русский ученый Д.И. Менделеев. Менделеев объединил известные
- 29. Получим это уравнение, используя основное уравнение молекулярно-кинетической теории: Умножим обе части уравнения на объем V: здесь
- 30. Новая величина называется газовая постоянная. Она равна: Закон Авогадро: моли любых газов при одинаковых температуре и
- 31. Термодинамическим процессом называется переход системы из одного состояния в другое. Такой переход всегда связан с нарушением
- 32. Нарушение равновесия будет тем значительнее, чем быстрее пере-мещать поршень. Если двигать поршень очень медленно, то равно-весие
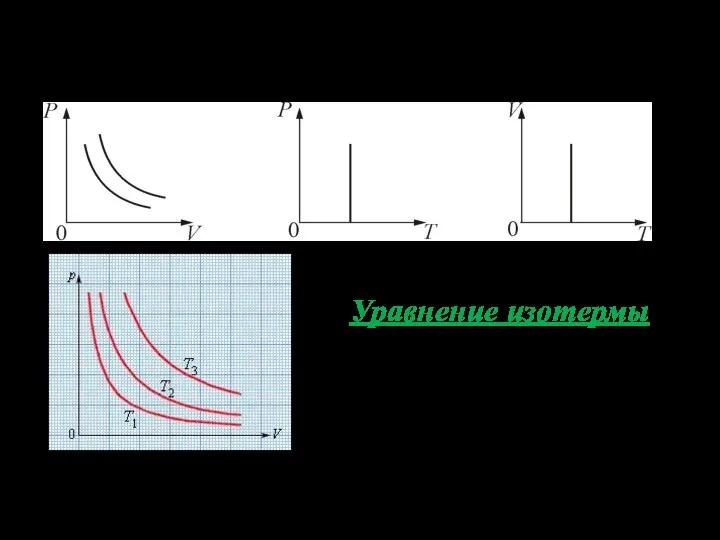
- 33. Рассмотрим примеры квазистатических процессов. 1. Изотермический процесс. T = const. Изотермическим процессом называется процесс, протекающий при
- 34. графики изотермического процесса на PV, VT и РT диаграммах: Уравнение изотермы
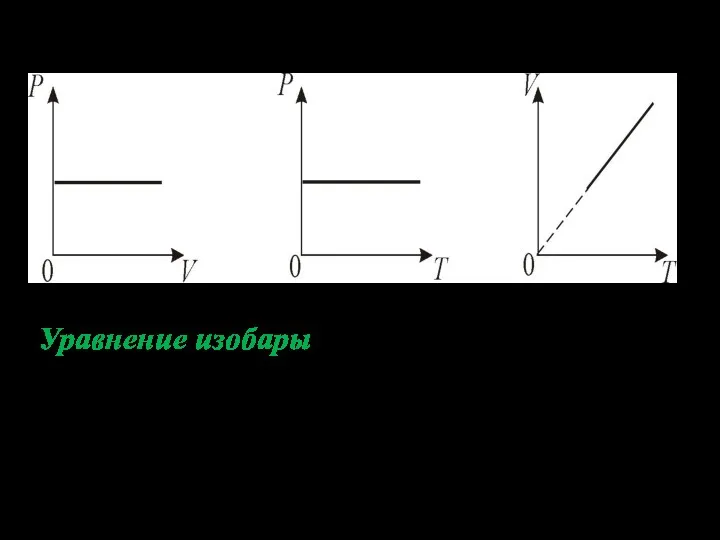
- 35. 2.Изобарический процесс. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа
- 36. Уравнение изобары
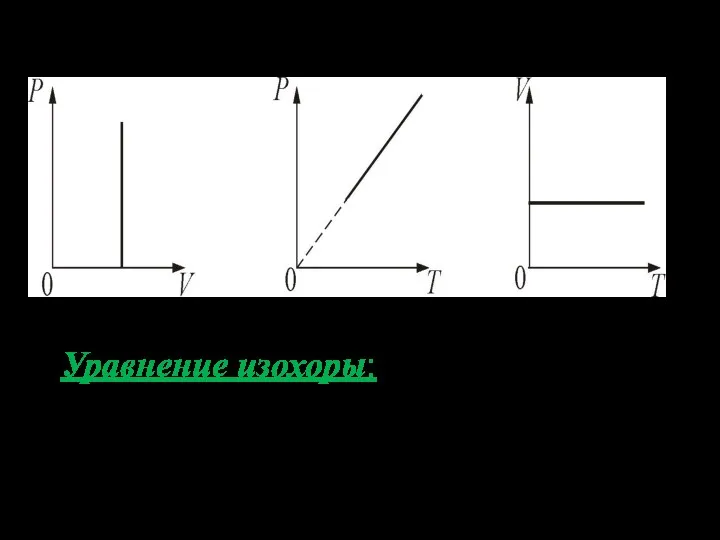
- 37. 3. Изохорический процесс. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение
- 38. Уравнение изохоры:
- 40. Скачать презентацию






























 Радиоприёмные устройства. Часть 2. Помехи
Радиоприёмные устройства. Часть 2. Помехи Презентация Испарение и конденсация
Презентация Испарение и конденсация Закон Ома для участка цепи. Урок 35
Закон Ома для участка цепи. Урок 35 Камера сгорания
Камера сгорания Закон Архимеда
Закон Архимеда Интерференция света
Интерференция света Зубчатые передачи
Зубчатые передачи Термодинамика. Законы термодинамики
Термодинамика. Законы термодинамики Закон Кулона
Закон Кулона Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Оптика. Развитие взглядов на природу света. Скорость света
Оптика. Развитие взглядов на природу света. Скорость света Макросистема (термодинамическая система)
Макросистема (термодинамическая система) Генератор
Генератор Электрическое поле. Свойства
Электрическое поле. Свойства В мире оптических иллюзий
В мире оптических иллюзий Сила Ампера. Задачи
Сила Ампера. Задачи Принцип работы центробежного нагнетателя. Силы, действующие на ротор нагнетателя при различных режимах работы
Принцип работы центробежного нагнетателя. Силы, действующие на ротор нагнетателя при различных режимах работы Презентация 7 кл. Измерение атмосферного давления
Презентация 7 кл. Измерение атмосферного давления Дизельна електростанція
Дизельна електростанція Теплообмен человека с окружающей средой
Теплообмен человека с окружающей средой Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы
Жарық дифракциясы. Френельдің аумақ әдісі. Жарықтың түзу сызықпен таралуы. Аумақ пластинасы Увеличение мощности автомобильного двигателя
Увеличение мощности автомобильного двигателя Сублимация. Применение процесса в лабораторной технике
Сублимация. Применение процесса в лабораторной технике Нанохимия и нанотехнологии. Методы и средства исследования нанообъектов. (Лекция 3)
Нанохимия и нанотехнологии. Методы и средства исследования нанообъектов. (Лекция 3) Презентация к уроку физики в 10 классе Закон всемирного тяготения
Презентация к уроку физики в 10 классе Закон всемирного тяготения Введение в ходкость
Введение в ходкость Открытие электромагнитных колебаний. 11 класс
Открытие электромагнитных колебаний. 11 класс Механические колебания
Механические колебания