Содержание
- 2. Атом ( с греческого «неделимый») Обыкновенно мы говорим о сладком и горьком, о теплом и холодном,
- 3. Моле́кула (новолатинское molecula, уменьшительное от лат. moles — масса) Пьер Гассенди (1592 — 1655) не только
- 4. М.В.Ломоносов (1711 - 1765) "Наиболее удачно, - говорит профессор Меньшуткин, - разработаны Ломоносовым два основных вопроса
- 5. Амедео Авогадро ( 1776-1856) «одинаковые объёмы различных газов, при одинаковых температурах и давлениях, содержат одинаковое число
- 6. Людвиг Больцман ( 1844-1906) "Тепловая смерть - блеф. Никакого конца света не предвидится. Вселенная существовала и
- 7. Все тела состоят из отдельных частиц, между которыми есть промежутки…
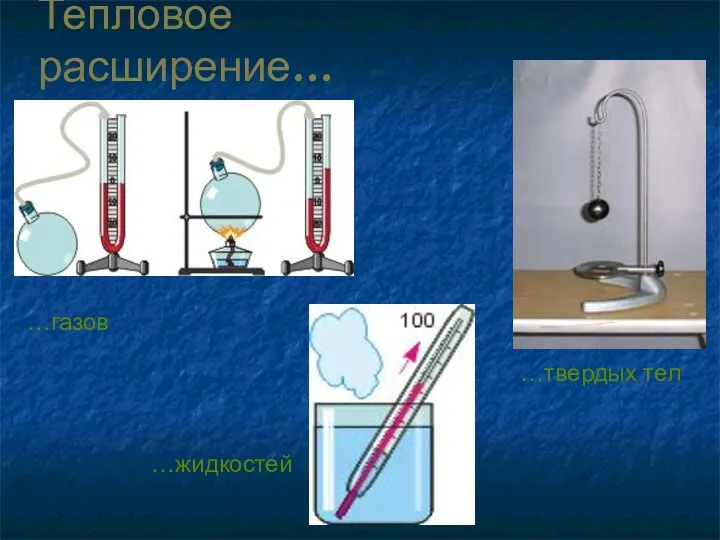
- 8. Тепловое расширение… …газов …твердых тел …жидкостей
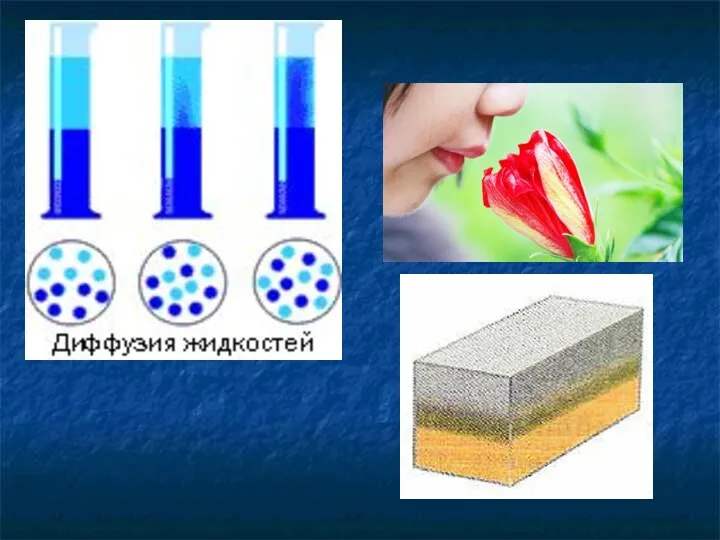
- 9. Между молекулами есть промежутки
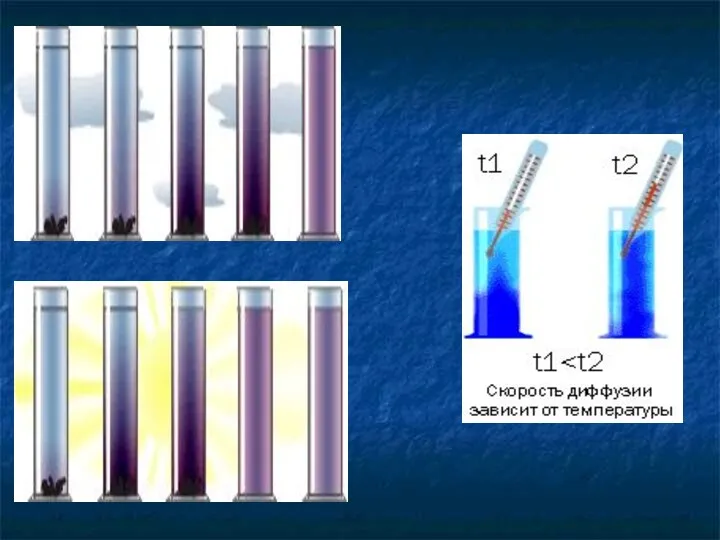
- 10. Испарение жидкости
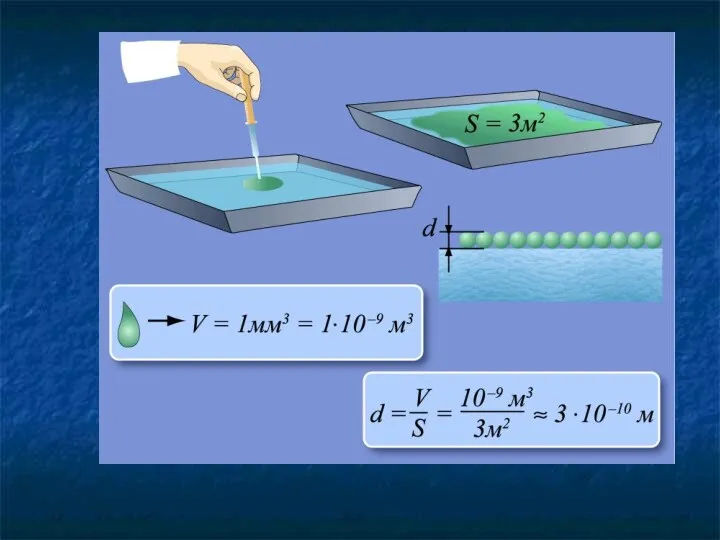
- 11. Диаметр молекул воды составляет приблизительно
- 14. Если молекулу увеличить до размера яблока…. …то яблоко вырастет до размера Земного шара
- 15. Электронный микроскоп – заглянем в глубины вещества
- 16. Так выглядят атомы под микроскопом золото платина никель углерод Разные атомы
- 17. Масса Масса молекулы Относительная молекулярная масса Молярная масса Масса вещества
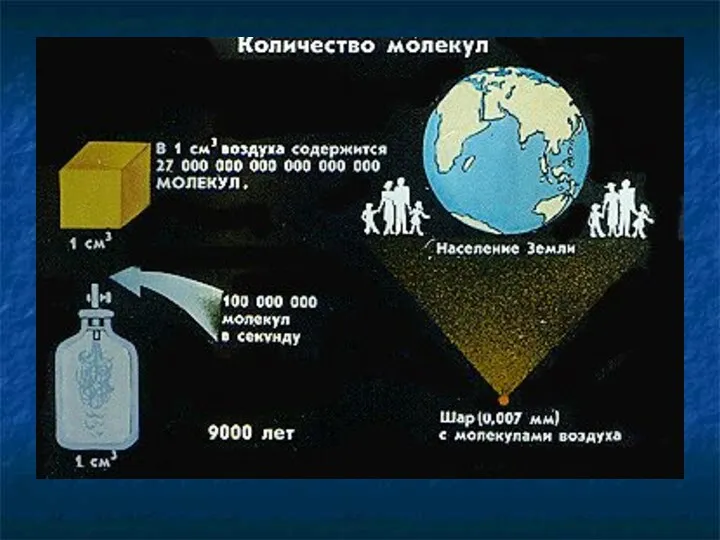
- 18. Количество молекул Количество молекул Число Авогадро Концентрация
- 20. Количество вещества Относительная величина, которая показывает, во сколько раз число молекул в данном теле отличается от
- 21. Количество молекул Количество молекул Число Авогадро – количество молекул в одном моле любого вещества. Универсальная физическая
- 22. Масса Масса молекулы Относительная молекулярная масса – величина, которая показывает во сколько раз масса молекулы данного
- 23. Создание веществ с заранее известными свойствами
- 24. Молекулы движутся непрерывно и хаотично.
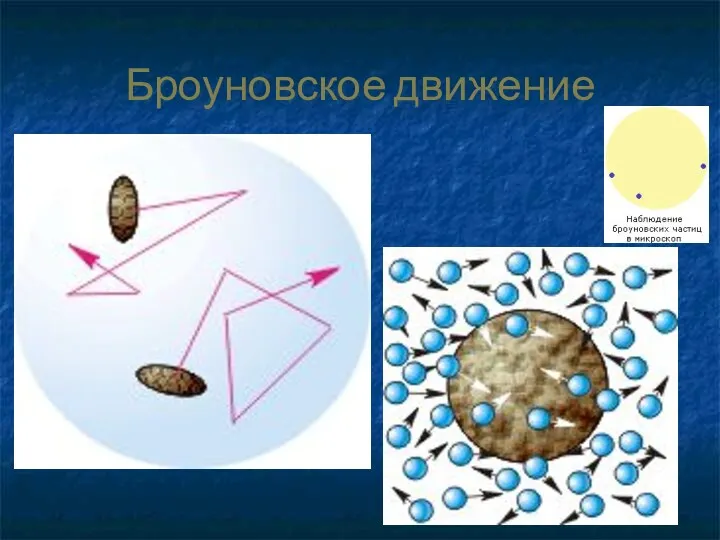
- 27. Броуновское движение
- 28. Однажды я поместил каплю воды на стеклышко микроскопа и насыпал в нее немного цветочной пыльцы. Я
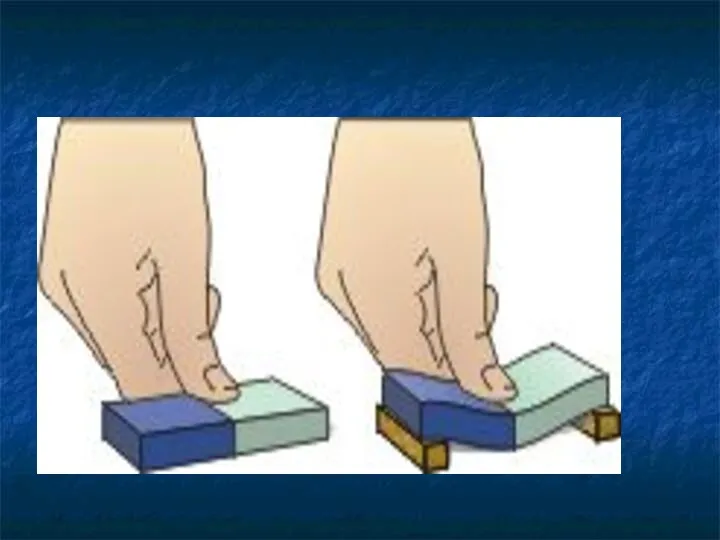
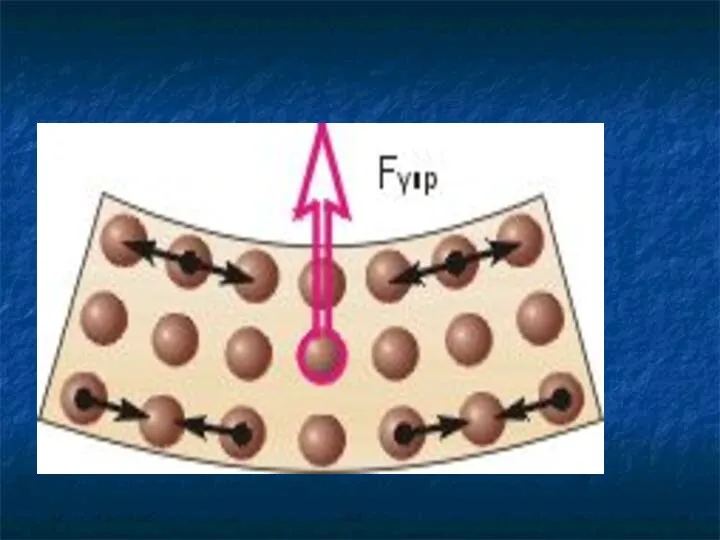
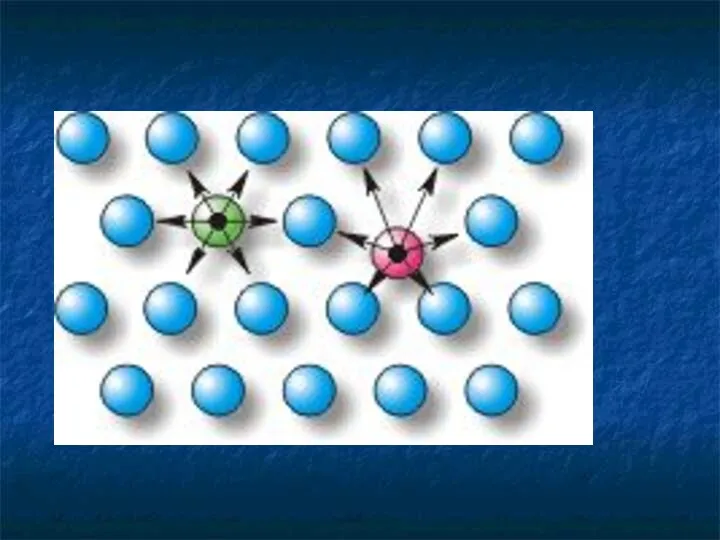
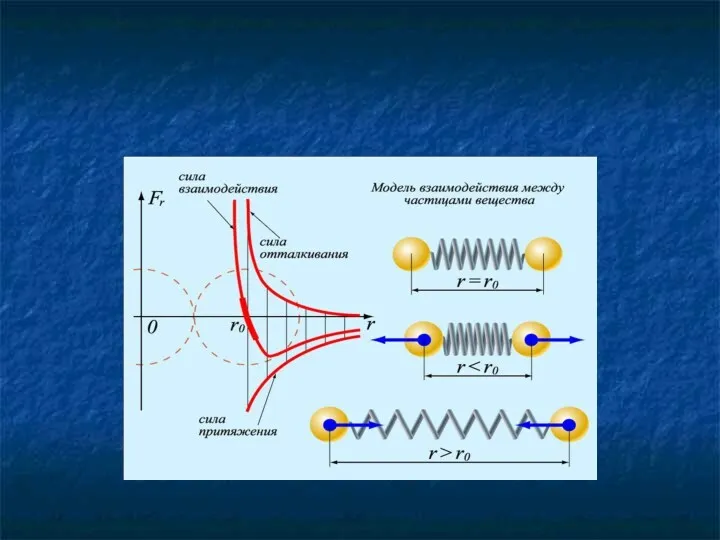
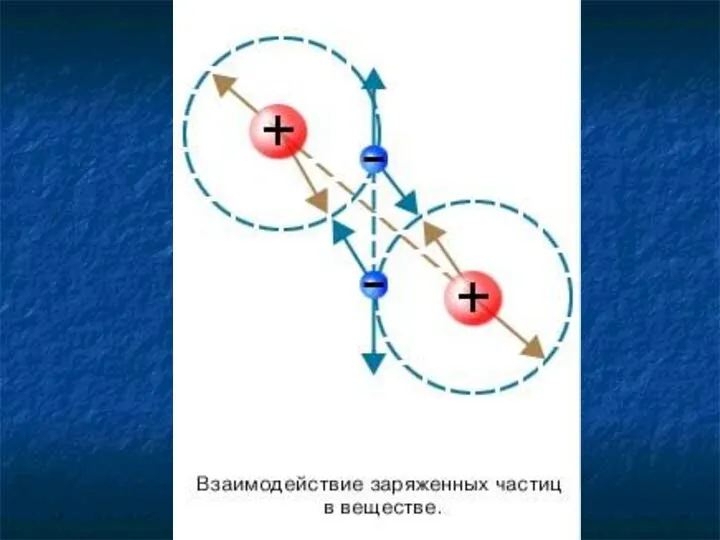
- 29. Молекулы взаимодействуют друг с другом: притягиваются и отталкиваются
- 38. Скачать презентацию
























 Исаак Ньютон
Исаак Ньютон Пара сил. Момент
Пара сил. Момент Конвекция. Конвекция как способ теплопередачи. Конвекция в жидкостях и газах
Конвекция. Конвекция как способ теплопередачи. Конвекция в жидкостях и газах Сила трения
Сила трения Современные попытки создания вечного двигателя
Современные попытки создания вечного двигателя Презентация по физике 7 класс. Тема: Плотность вещества
Презентация по физике 7 класс. Тема: Плотность вещества Модальный метод синтеза непрерывных систем
Модальный метод синтеза непрерывных систем Физические свойства
Физические свойства Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Accumulation of electricity. Leadacid batteries
Accumulation of electricity. Leadacid batteries Тест по физике (10 класс)
Тест по физике (10 класс) Электромагнитная индукция. Опыты Фарадея
Электромагнитная индукция. Опыты Фарадея Естествознание. Почему дует ветер?
Естествознание. Почему дует ветер? Звук. Источники звука
Звук. Источники звука Электростатика. Первоначальная энергия электрона
Электростатика. Первоначальная энергия электрона Сила упругости
Сила упругости Интегрированный урок (физика – экология) в 8 классе по теме: Тепловые двигатели и охрана окружающей среды
Интегрированный урок (физика – экология) в 8 классе по теме: Тепловые двигатели и охрана окружающей среды Принципы радиосвязи
Принципы радиосвязи Построение изображений, даваемых линзой (9 класс)
Построение изображений, даваемых линзой (9 класс) Термометры и их виды
Термометры и их виды Дисперсия света. Цвета тел. Типы оптических спектров
Дисперсия света. Цвета тел. Типы оптических спектров Подшипники качения
Подшипники качения Конструирование и управление БПА
Конструирование и управление БПА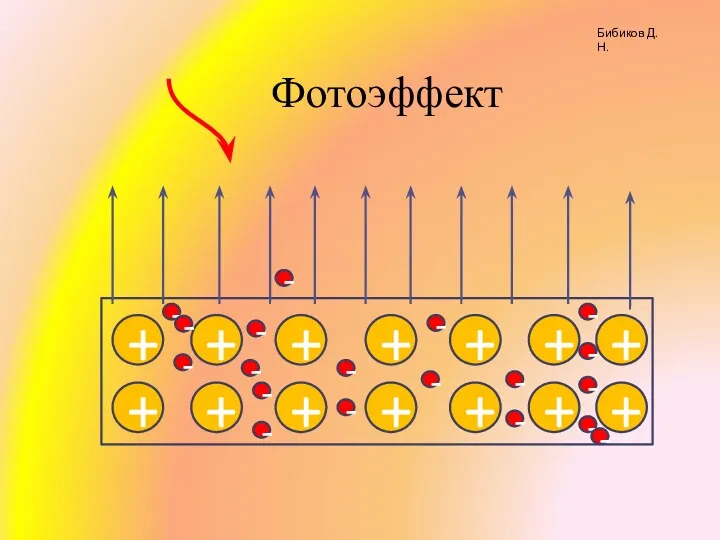 Фотоэффект
Фотоэффект Галерея автомобилей
Галерея автомобилей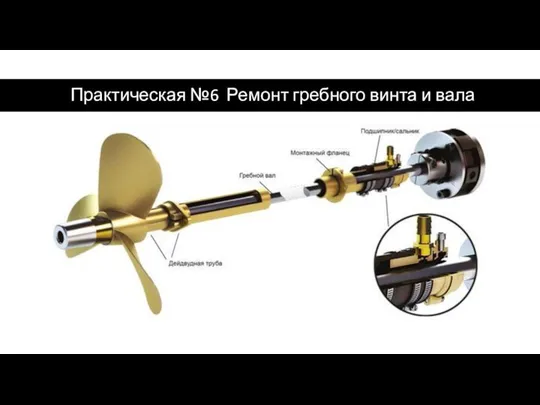 Ремонт гребного винта и вала
Ремонт гребного винта и вала Устройство круиз-контроль на автомобиле
Устройство круиз-контроль на автомобиле Ядерные реакции. Радиоактивность
Ядерные реакции. Радиоактивность