Содержание
- 2. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ 1. ВСЕ ТЕЛА СОСТОЯТ ИЗ МЕЛЬЧАЙШИХ ЧАСТИЦ – АТОМОВ И МОЛЕКУЛ Молекула —
- 3. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ 1. ВСЕ ТЕЛА СОСТОЯТ ИЗ МЕЛЬЧАЙШИХ ЧАСТИЦ – АТОМОВ И МОЛЕКУЛ Размеры атомов
- 4. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ 2. ЧАСТИЦЫ НАХОДЯТСЯ В ПОСТОЯННОМ ХАОТИЧЕСКОМ ДВИЖЕНИИ Диффузия – явление, когда соприкасающиеся вещества
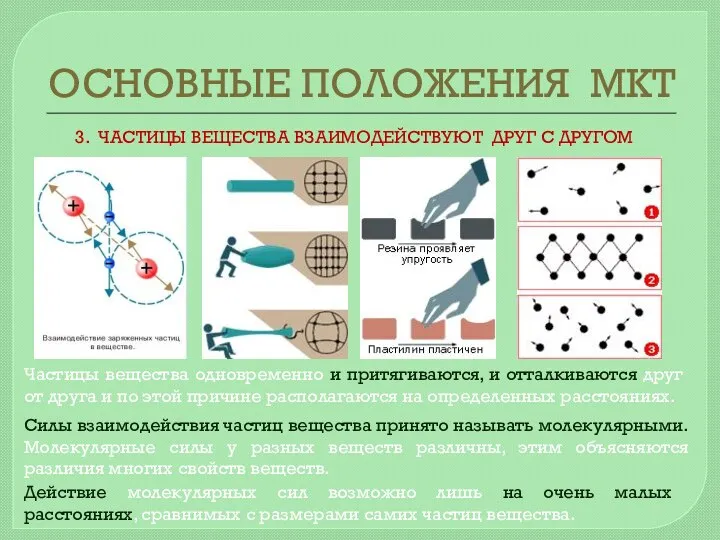
- 5. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ 3. ЧАСТИЦЫ ВЕЩЕСТВА ВЗАИМОДЕЙСТВУЮТ ДРУГ С ДРУГОМ Силы взаимодействия частиц вещества принято называть
- 6. ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ 3. ЧАСТИЦЫ ВЕЩЕСТВА ВЗАИМОДЕЙСТВУЮТ ДРУГ С ДРУГОМ 2. ЧАСТИЦЫ НАХОДЯТСЯ В ПОСТОЯННОМ ХАОТИЧЕСКОМ
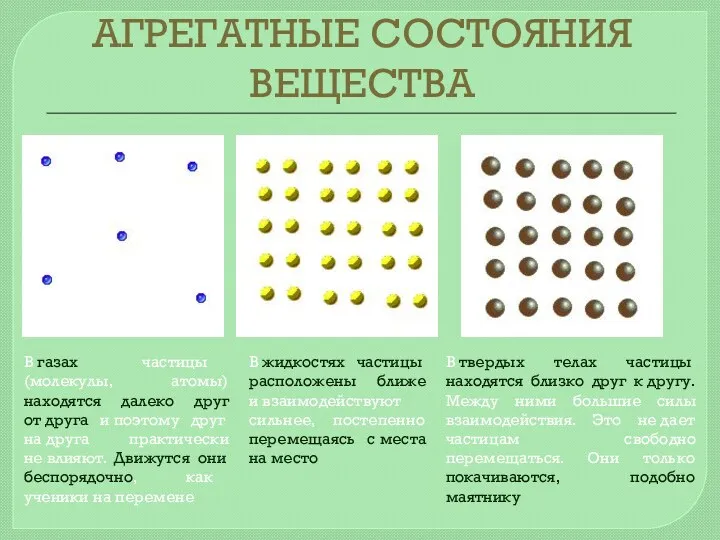
- 7. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА Вещества могут находиться в различных агрегатных состояниях – твердом, жидком, газообразном. Молекулярные силы
- 8. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА В газах частицы (молекулы, атомы) находятся далеко друг от друга и поэтому друг
- 9. СКОРОСТЬ ЧАСТИЦ ВЕЩЕСТВА 1920 год - впервые были экспериментально определены скорости частиц вещества Отто Штерн (1888-1969)
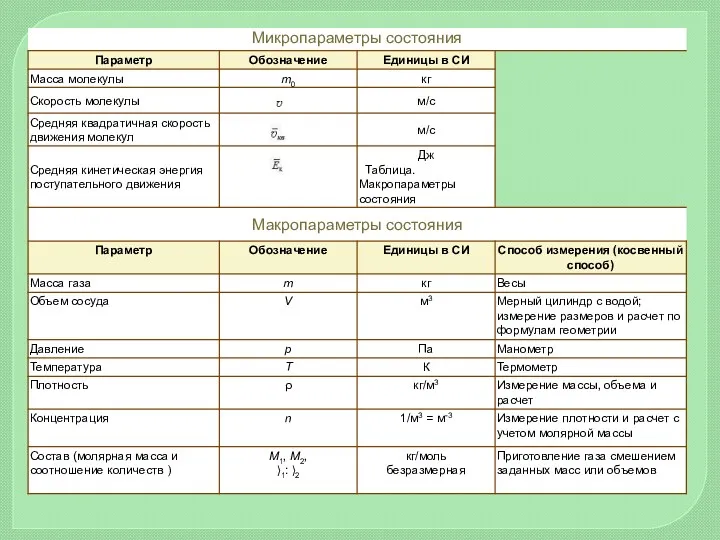
- 10. Основная задача МКТ – вывести уравнение состояния вещества, установив связь между макроскопическими и микроскопическими параметрами. Величины,
- 11. Постоянная Авогадро численно равна количеству частиц, содержащихся в 1 моле любого вещества: Na= 6· 1023 моль-1
- 13. Основные отличия идеального газа от реального газа: 1. Частицы идеального газа - сферические тела очень малых
- 14. Идеальный газ. Основное уравнение МКТ
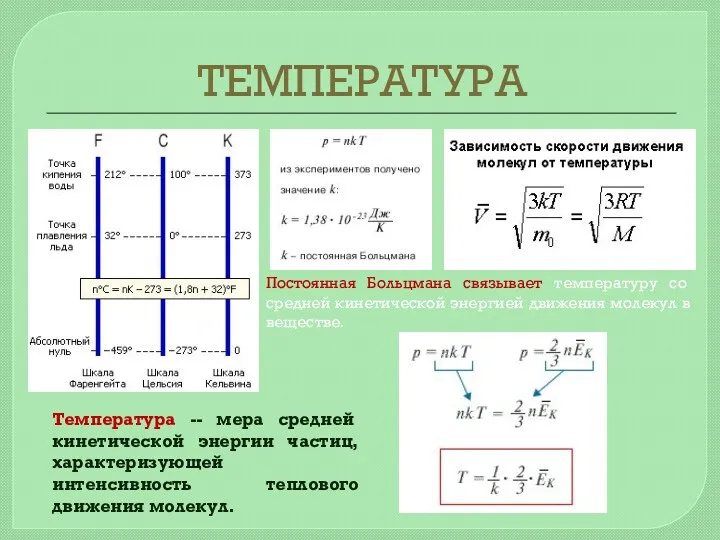
- 15. ТЕМПЕРАТУРА Газовый термометр с постоянным объемом Зависимость давления газа от температуры при V = const. Тепловым
- 16. ТЕМПЕРАТУРА Постоянная Больцмана связывает температуру со средней кинетической энергией движения молекул в веществе. Температура -- мера
- 19. Скачать презентацию












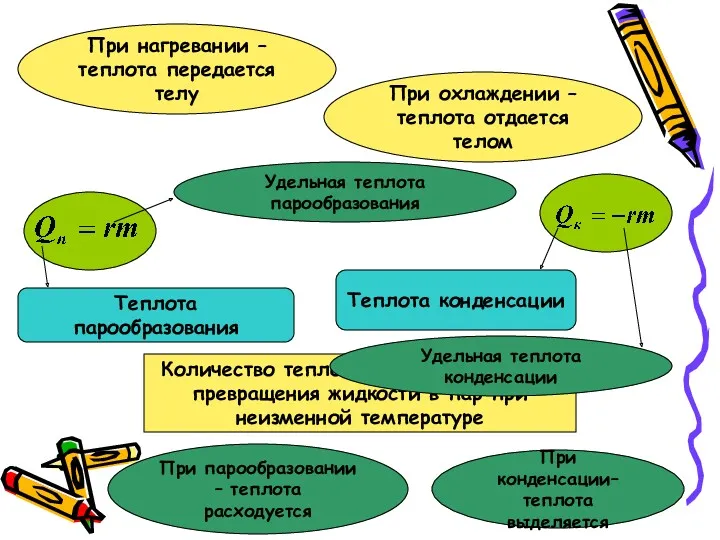 Термодинамика. Теплота
Термодинамика. Теплота Диффузия примесей. Практическое занятие №7
Диффузия примесей. Практическое занятие №7 Барометрическая формула. (Лекция 6)
Барометрическая формула. (Лекция 6) Рекомендации по выбору посадок
Рекомендации по выбору посадок Образование гидридов
Образование гидридов Скорость испарения воды. Опыты
Скорость испарения воды. Опыты Прямолинейные колебания точки
Прямолинейные колебания точки Процессы переноса: диффузия, теплопроводность и вязкость
Процессы переноса: диффузия, теплопроводность и вязкость Механическая работа. 7 класс
Механическая работа. 7 класс Электрическое напряжение. Единицы напряжения. Вольтметр. Измерение напряжения
Электрическое напряжение. Единицы напряжения. Вольтметр. Измерение напряжения Электромонтер по ремонту электрооборудования
Электромонтер по ремонту электрооборудования Метрология, стандартизация и сертификация
Метрология, стандартизация и сертификация Билеты. Кислородного баллона
Билеты. Кислородного баллона Источники света
Источники света А.С. Попов, изобретатель радио
А.С. Попов, изобретатель радио Интегрированный урок по физике и информатике 6 класс
Интегрированный урок по физике и информатике 6 класс Атмосферное давление 7
Атмосферное давление 7 Энергия. Потенциальная и кинетическая энергия тел
Энергия. Потенциальная и кинетическая энергия тел Ультразвук
Ультразвук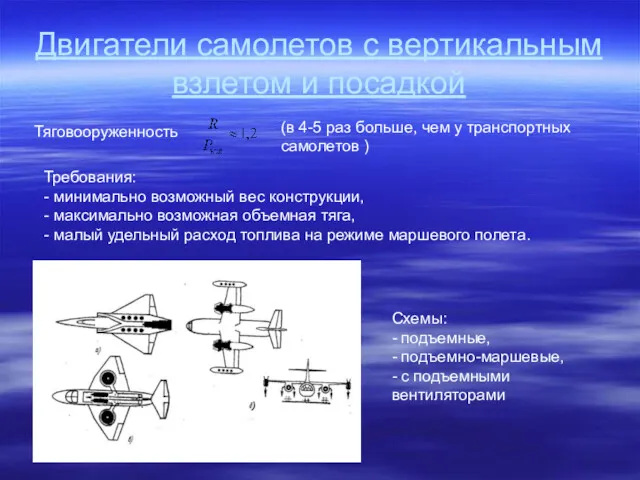 Двигатели самолетов с вертикальным взлетом и посадкой. Тяговооруженность
Двигатели самолетов с вертикальным взлетом и посадкой. Тяговооруженность Исследовательский проект Машина Голдберга Как включить свет?
Исследовательский проект Машина Голдберга Как включить свет? Решение задач по теме Закон сохранения импульса
Решение задач по теме Закон сохранения импульса Реактивний двигун
Реактивний двигун Проектировочный расчет закрытой зубчатой передачи
Проектировочный расчет закрытой зубчатой передачи Quick Quiz
Quick Quiz Презентация Законы Ньютона
Презентация Законы Ньютона Применение первого закона термодинамики к различным процессам
Применение первого закона термодинамики к различным процессам Системно-деятельностный подход в обучении физики как основа ФГОС
Системно-деятельностный подход в обучении физики как основа ФГОС