Содержание
- 2. Атом ( с греческого «неделимый») Обыкновенно мы говорим о сладком и горьком, о теплом и холодном,
- 3. Моле́кула (новолатинское molecula, уменьшительное от лат. moles — масса) Пьер Гассенди (1592 — 1655) не только
- 4. М.В.Ломоносов (1711 - 1765) "Наиболее удачно, - говорит профессор Меньшуткин, - разработаны Ломоносовым два основных вопроса
- 5. Амедео Авогадро ( 1776-1856) «одинаковые объёмы различных газов, при одинаковых температурах и давлениях, содержат одинаковое число
- 6. Людвиг Больцман ( 1844-1906) "Тепловая смерть - блеф. Никакого конца света не предвидится. Вселенная существовала и
- 7. Основные положения МКТ Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят
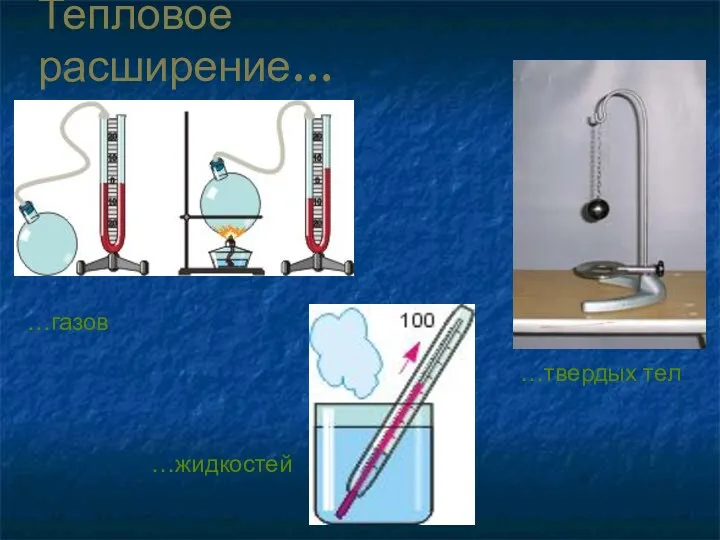
- 8. Тепловое расширение… …газов …твердых тел …жидкостей
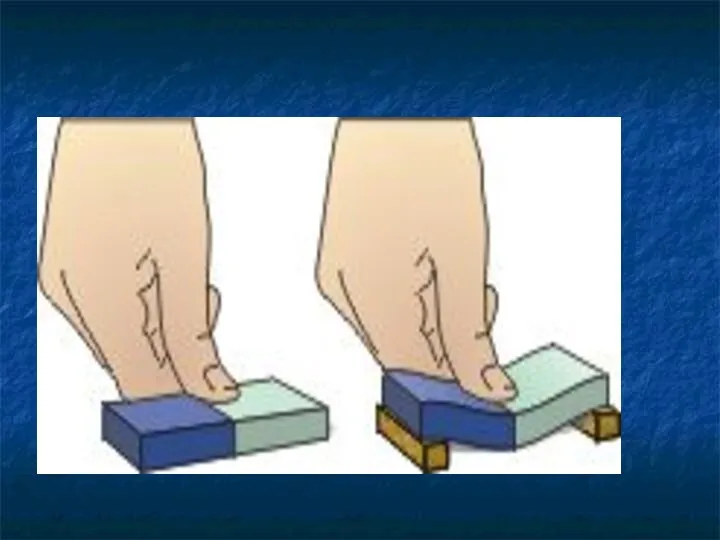
- 9. Между молекулами есть промежутки
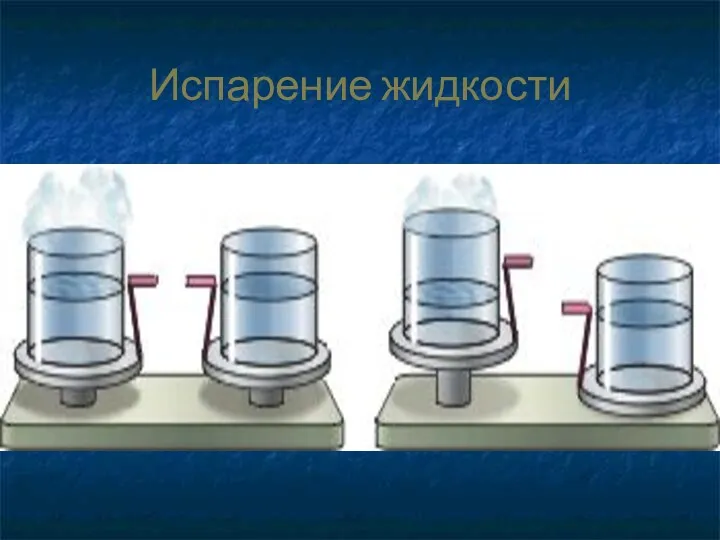
- 10. Испарение жидкости
- 11. Молекула – мельчайшая устойчивая частица данного вещества обладающая его основными химическими свойствами. Диаметр молекул воды составляет
- 14. Если молекулу увеличить до размера яблока…. …то яблоко вырастет до размера Земного шара
- 15. Электронный микроскоп – заглянем в глубины вещества
- 16. Так выглядят атомы под микроскопом золото платина никель углерод Разные атомы
- 17. Масса - масса одной молекулы - относительная молекулярная масса - молярная масса - масса вещества
- 18. Количество вещества - относительная величина, которая показывает, во сколько раз число молекул в данном теле отличается
- 19. Количество молекул Число Авогадро – количество молекул в одном моле любого вещества. Концентрация – количество молекул
- 20. Молярная масса – масса одного моля вещества. Масса вещества – находится взвешиванием, рассчитывается с помощью плотности
- 21. Молекулы движутся непрерывно и хаотично.
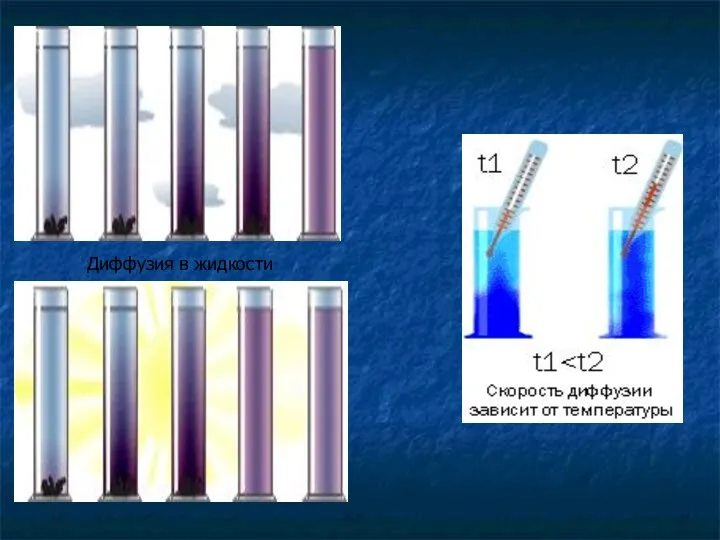
- 22. Диффузия – самопроизвольное взаимное проникновение молекул одного вещества в промежутки между молекулами другого.
- 23. Диффузия в жидкости
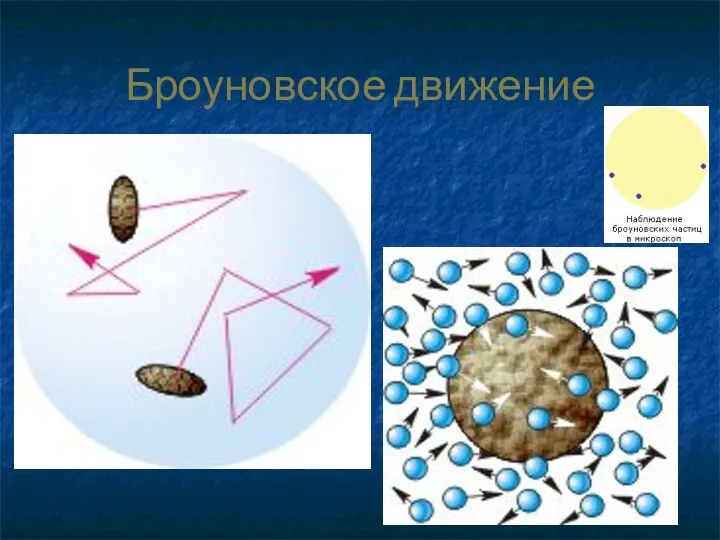
- 24. Броуновское движение
- 25. Бро́уновское движе́ние — беспорядочное движение микроскопических видимых взвешенных частиц твёрдого вещества в жидкости или газе, вызываемое
- 26. Однажды я поместил каплю воды на стеклышко микроскопа и насыпал в нее немного цветочной пыльцы. Я
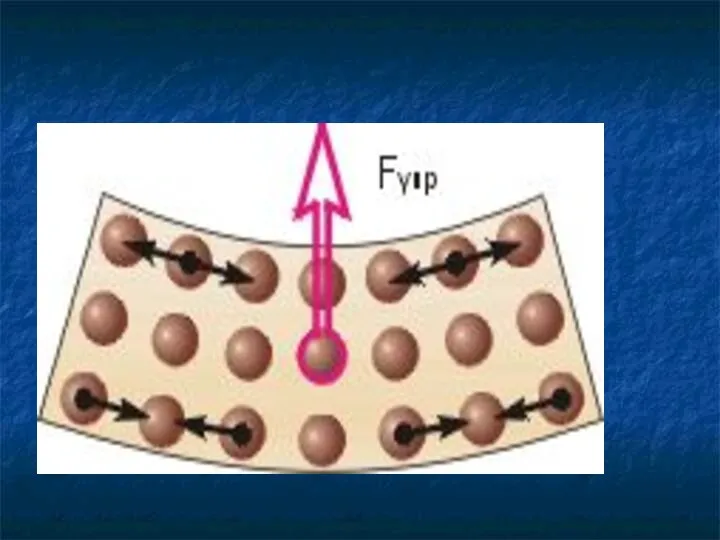
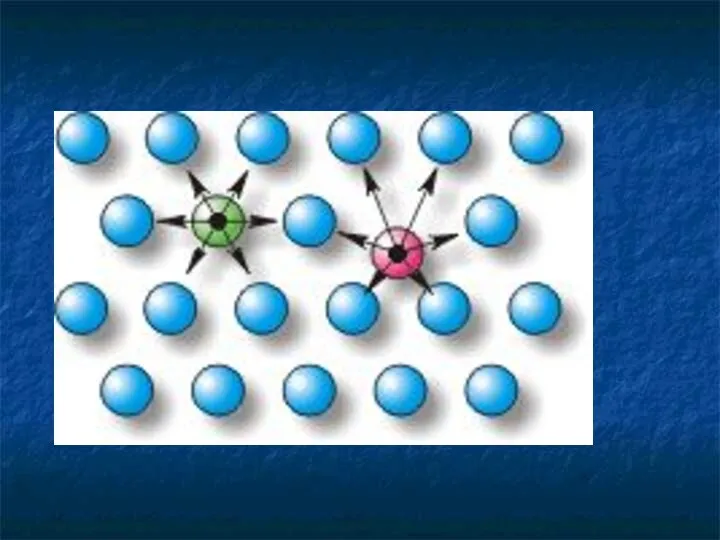
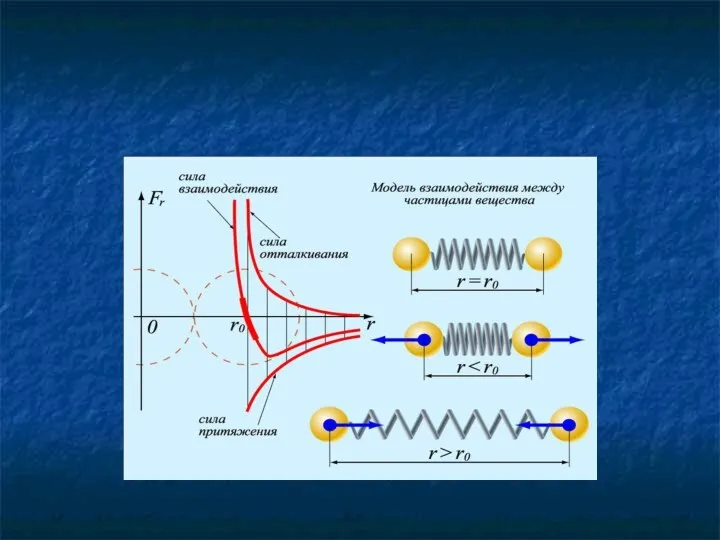
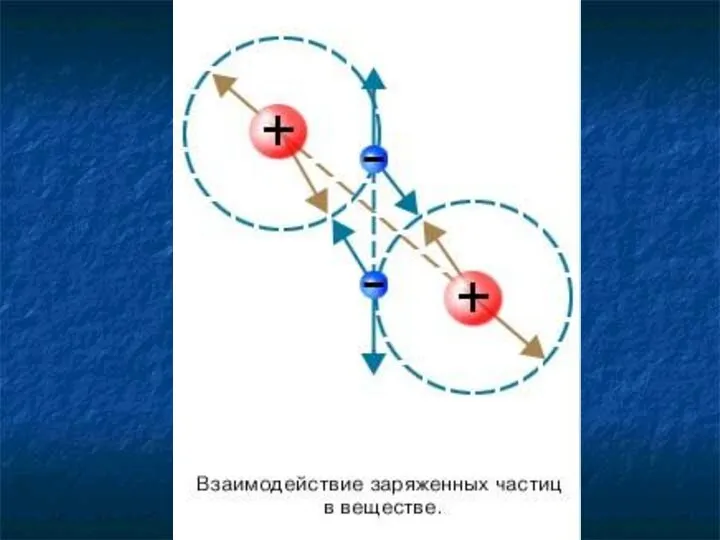
- 27. Молекулы взаимодействуют друг с другом: притягиваются и отталкиваются
- 35. Задача №1 Чему равен объем 50 молей ртути? 0,794 л
- 36. Задача № 2(Р.-460) Сколько молекул содержится в углекислом газе (СO2) массой 1 г?
- 37. Задача № 3 В озеро, имеющее среднюю глубину 10 м и площадь поверхности 10 км2, бросили
- 38. Задача № 4(Р.-466) Находившаяся в стакане вода массой 200 г полностью испарилась за 20 сут. Сколько
- 39. Задача №5 (Р.-461) На изделие, поверхность которого 20 см2, нанесен слой серебра толщиной 1 мкм. Сколько
- 41. Скачать презентацию





























 Понятие дозы
Понятие дозы Точность и погрешность измерений
Точность и погрешность измерений Model de elaborare a raportului
Model de elaborare a raportului Реактивное движение.
Реактивное движение. Действие магнитного поля на движущуюся заряженную частицу. Сила Лоренца
Действие магнитного поля на движущуюся заряженную частицу. Сила Лоренца Електромагнітні коливання. Електричний коливальний контур. Коливальний контур
Електромагнітні коливання. Електричний коливальний контур. Коливальний контур Механика привода
Механика привода Закон радиоактивного распада. Изотопы
Закон радиоактивного распада. Изотопы Толқындық қозғалыс
Толқындық қозғалыс Работа газа и пара при расширении. Двигатель внутреннего сгорания
Работа газа и пара при расширении. Двигатель внутреннего сгорания Мастер-класс Формирование мотивации к изучению предмета посредством использования информационно - коммуникационных технологий на уроках физики
Мастер-класс Формирование мотивации к изучению предмета посредством использования информационно - коммуникационных технологий на уроках физики Основы молекулярной физики и термодинамики
Основы молекулярной физики и термодинамики Резьбовые соединения (РС)
Резьбовые соединения (РС) Известные учёные физики
Известные учёные физики Расчет на устойчивость центрального сжатия гибкого стержня
Расчет на устойчивость центрального сжатия гибкого стержня Трехфазные цепи переменного синусоидального тока, практика
Трехфазные цепи переменного синусоидального тока, практика Естественное и искусственное освещение. Лекция 5
Естественное и искусственное освещение. Лекция 5 Задачи, решаемые специализированными ТВ системами
Задачи, решаемые специализированными ТВ системами Давление света. 11 класс
Давление света. 11 класс Smart педалі,
Smart педалі, Поршневая группа
Поршневая группа Рентгеноструктурный анализ
Рентгеноструктурный анализ Quick Quiz
Quick Quiz Шкала та властивості електромагнітних хвиль різних діапазонів частот. Електромагнітні хвилі в природі і техніці
Шкала та властивості електромагнітних хвиль різних діапазонів частот. Електромагнітні хвилі в природі і техніці Силы сопротивления при движении твердых тел в жидкостях и газах
Силы сопротивления при движении твердых тел в жидкостях и газах Пособие по гидроманипуляторам
Пособие по гидроманипуляторам Условия плавания тел. 7 класс
Условия плавания тел. 7 класс Лазерные сканирующие системы
Лазерные сканирующие системы