Содержание
- 2. Объектная область исследования –электродинамика Объект исследования –электрический ток в различных средах Предмет исследования – электрический ток
- 3. Цель работы –установить особенности протекания электрического тока в жидкостях Задачи: Ознакомиться с историей развития научных исследований
- 4. Актуальность темы исследования Расширение областей применения материалов, получаемых электролитическим способом Возрастание роли электрохимии для получения новых
- 5. Методы исследования Теоретические методы: анализ и синтез Эмпирические методы: наблюдение, сравнение и сопоставление
- 6. Имена. События (Историческая справка) УПРЯМЫЙ "ЛЯГУШАТНИК" ЗАГАДОЧНЫЙ ТРИУМФ Луиджи Гальвани Алессандро Вольта «…он возник и сделал
- 7. Исследование особенностей электрического тока в жидкостях Оборудование для эксперимента Установка для исследования
- 8. Доказательства существования тока в жидкостях Дистиллированная вода Раствор поваренной соли Раствор медного купороса
- 9. Опыт №1 « Установление зависимости силы тока от концентрации раствора» Опыт №2 «Влияние площади электродов на
- 10. Опыт №3 «Установление зависимости силы тока от расстояния между электродами» Опыт №4 «Влияние глубины погружения электродов
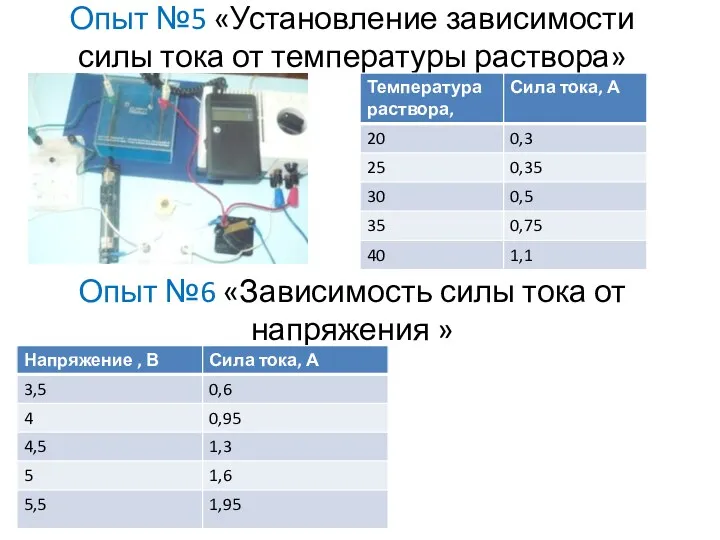
- 11. Опыт №5 «Установление зависимости силы тока от температуры раствора» Опыт №6 «Зависимость силы тока от напряжения
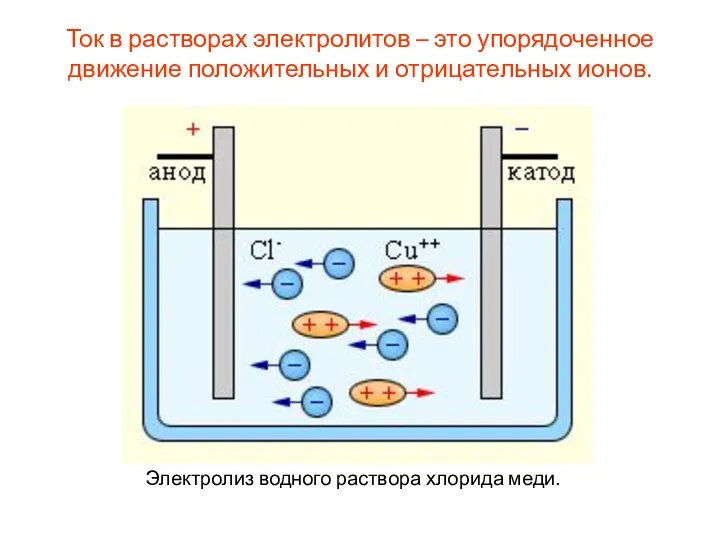
- 12. Ток в растворах электролитов – это упорядоченное движение положительных и отрицательных ионов. Электролиз водного раствора хлорида
- 13. Законы Фарадея Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Первый закон
- 14. Практическое применение электролиза получение неорганических веществ (водорода, кислорода, хлора, щелочей и т.д.); получение металлов (литий, натрий,
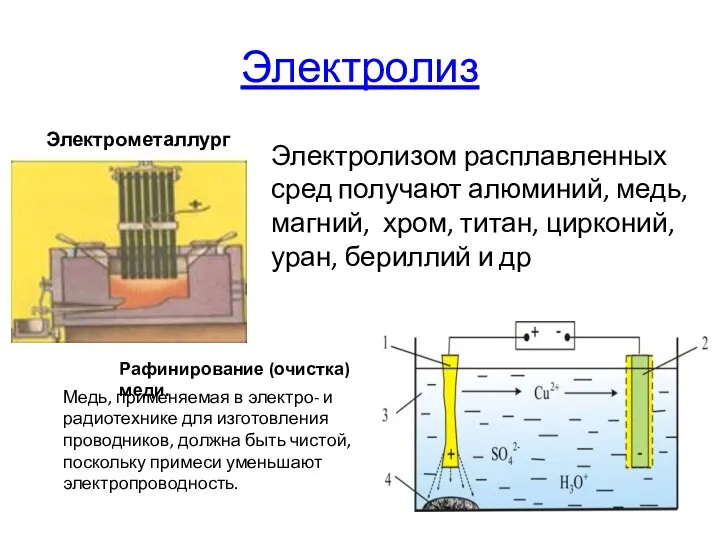
- 15. Электролиз Электролизом расплавленных сред получают алюминий, медь, магний, хром, титан, цирконий, уран, бериллий и др Электрометаллургия.
- 16. Гальванотехника Гальваностегия - электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не
- 17. Произведения искусства Барельефы для Исаакиевского собора Зимнего дворца Петропавловского собора Эрмитажа Большого театра
- 18. Изготовление медалей, монет. Медные клише для типографии
- 19. Гальванопластика Чайно-кофейный сервиз мануфактуры Кристофля, 1875, одно из первых применений гальванопластического серебрения и золочения Гальванопластические скульптуры
- 20. Гальванополировка. Если резное металлическое изделие поместить в раствор электролита и включить ток, то наиболее сильное электрическое
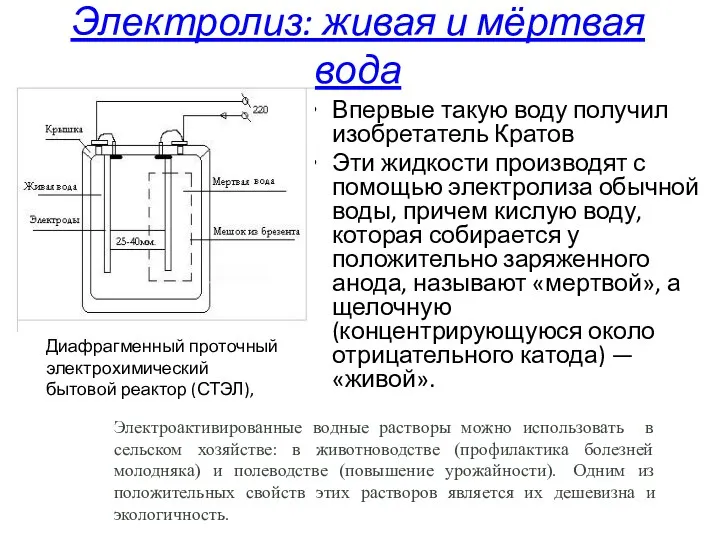
- 21. Электролиз: живая и мёртвая вода Впервые такую воду получил изобретатель Кратов Эти жидкости производят с помощью
- 22. Выводы Опыты показали, что сила тока в электролитах увеличивается при увеличении напряжения, температуры и концентрации электролита,
- 23. Проверь себя! 1. Электрический ток в электролитах создаётся… А. Электронами и ионами обоих знаков. Б. Ионами
- 24. 6. Через электролит может быть перенесено током минимальное по абсолютному значению количество электричества, равное… А. 1,6∙10-19
- 25. 8. Соотнеси имена ученых и их открытия Ученые А. Борис Якоби Б. Луиджи Гальвани В. Алессандро
- 27. Скачать презентацию




















 Равномерное прямолинейное движение
Равномерное прямолинейное движение Явление электромагнитной индукции 9 класс, презентация
Явление электромагнитной индукции 9 класс, презентация Вес тела. Единицы силы. Связь между силой тяжести и массой тела. 7 класс
Вес тела. Единицы силы. Связь между силой тяжести и массой тела. 7 класс Конвективный теплообмен
Конвективный теплообмен Экологическое воспитание на уроках физики
Экологическое воспитание на уроках физики Государственная итоговая аттестация по физике в новой форме (9 класс)
Государственная итоговая аттестация по физике в новой форме (9 класс) Обработка металлов давлением. Лекция №22
Обработка металлов давлением. Лекция №22 Тепловыделение в ядерном реакторе
Тепловыделение в ядерном реакторе Способы изменения внутренней энергии тела
Способы изменения внутренней энергии тела Условие равновесия рычага
Условие равновесия рычага Второй и третий законы Ньютона
Второй и третий законы Ньютона Оптическая спектроскопия твердотельных наноструктур
Оптическая спектроскопия твердотельных наноструктур Психолого-педагогическое сопровождение введения ФГОС основного общего образования
Психолого-педагогическое сопровождение введения ФГОС основного общего образования Износостойкие покрытия режущих инструментов
Износостойкие покрытия режущих инструментов Энергия и работа. Лекция 3
Энергия и работа. Лекция 3 Взаимное притяжение и отталкивание между молекулами. Физика. 7 класс
Взаимное притяжение и отталкивание между молекулами. Физика. 7 класс Заттың тығыздығы
Заттың тығыздығы Методы формирования и исследования квазиодномерных проводников
Методы формирования и исследования квазиодномерных проводников Устройство крышки бензобака
Устройство крышки бензобака Резьбовые соединения
Резьбовые соединения Методы исследования поверхности и/или тонких слоев
Методы исследования поверхности и/или тонких слоев Выключатель на pin-диоде. Антенный переключатель. Стабилизатор мощности
Выключатель на pin-диоде. Антенный переключатель. Стабилизатор мощности Вещества и явления в окружающем мире
Вещества и явления в окружающем мире Austro engine
Austro engine физика 9 класс колебания.
физика 9 класс колебания. Портфолио учителя физики. Пожарицкая Татьяна Геннадьевна
Портфолио учителя физики. Пожарицкая Татьяна Геннадьевна презентация урока по физике 10 класс Газовые законы
презентация урока по физике 10 класс Газовые законы Электрическое поле. Напряжённость электрического поля
Электрическое поле. Напряжённость электрического поля