Содержание
- 2. Цель урока: Установить зависимость между термодинамическими параметрами при неизменном третьем. Задачи: 1.Образовательные: -изучить , используя групповой
- 3. ПЛАН УРОКА: I. Организационный момент. II. Подготовка к восприятию нового материала. III. Сообщение темы и цели
- 4. II.Подготовка к восприятию нового материала: PV= (m/M)RT m=… p=… V=… T =… 1 . Используя уравнение
- 5. 2.Теоретический опрос в форме теста, с выбором правильного ответа: 1.Какая из приведённых формул является уравнением Клапейрона:
- 6. III. Сообщение темы и целей урока: Все знают: мир из Атомов построен, – Но был не
- 7. IV. Изучение нового материала. Мы знаем термодинамические параметры P, V, T, между которыми, согласно уравнению Менделеева
- 8. Изотермический процесс - V р1 р2 процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре
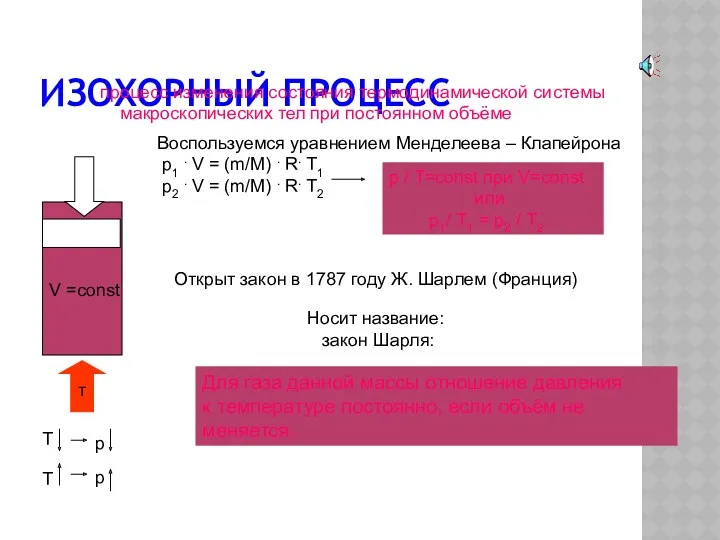
- 9. Изохорный процесс процесс изменения состояния термодинамической системы макроскопических тел при постоянном объёме Воспользуемся уравнением Менделеева –
- 10. Изобарный процесс процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Воспользуемся уравнением Менделеева –
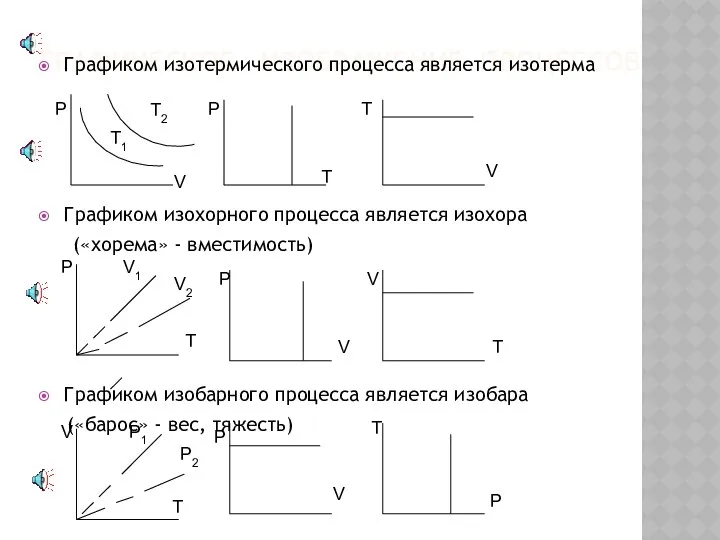
- 11. Графическое изображение процессов Графиком изотермического процесса является изотерма Графиком изохорного процесса является изохора («хорема» - вместимоcть)
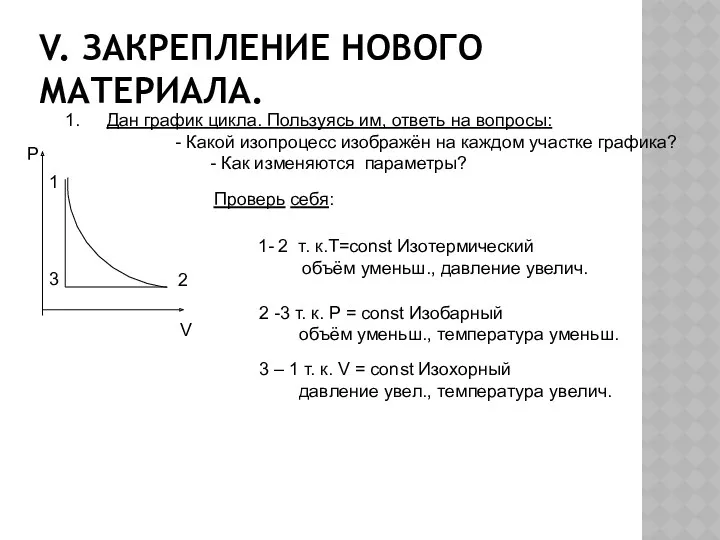
- 12. V. Закрепление нового материала. Дан график цикла. Пользуясь им, ответь на вопросы: - Какой изопроцесс изображён
- 13. 2. Решите задачу: № 521 ( сборник задач А.П. Рымкевич) Условие задачи: При температуре – 27о
- 15. Скачать презентацию









 Модели турбулентности
Модели турбулентности Основы процесса фрезерования. Оборудование и инструмент
Основы процесса фрезерования. Оборудование и инструмент Методы расчёта электрических цепей
Методы расчёта электрических цепей Значение влажности воздуха для человека
Значение влажности воздуха для человека Методы обработки наружных поверхностей
Методы обработки наружных поверхностей Ядерная физика (Лекция 9)
Ядерная физика (Лекция 9) Аккумулятор. Применение аккумуляторов в жизни
Аккумулятор. Применение аккумуляторов в жизни Электродинамика
Электродинамика Электрический ток
Электрический ток Дисперсия света. Цвета тел. Типы оптических спектров
Дисперсия света. Цвета тел. Типы оптических спектров Обобщающий урок по физике: Применение закона сохранения энергии в механических процессах. 10 класс.
Обобщающий урок по физике: Применение закона сохранения энергии в механических процессах. 10 класс. Плотность вещества. Продолжи предложение
Плотность вещества. Продолжи предложение Основы прикладной гидравлики
Основы прикладной гидравлики Физические основы механики. Основные положения общей теории относительности. (Тема 9)
Физические основы механики. Основные положения общей теории относительности. (Тема 9) Теория теплообмена. Влажный воздух
Теория теплообмена. Влажный воздух Юные знатоки физики
Юные знатоки физики Презентация к уроку по физике Скорость 7 класс
Презентация к уроку по физике Скорость 7 класс Электростатика. (Лекция 12)
Электростатика. (Лекция 12) ВАЗ 2106 Автомобильінің жалпы құрылысы
ВАЗ 2106 Автомобильінің жалпы құрылысы Задачи ДП
Задачи ДП Диагностирование системы смазки двигателя
Диагностирование системы смазки двигателя Масса тела. Измерение массы тела с помощью весов
Масса тела. Измерение массы тела с помощью весов Расчет потенциалов простейших электростатических полей
Расчет потенциалов простейших электростатических полей Явления переноса в газах
Явления переноса в газах Классификация оптических методов анализа. Абсорбционная молекулярная спектроскопия
Классификация оптических методов анализа. Абсорбционная молекулярная спектроскопия Атомные уровни строения материи. (Лекция 5)
Атомные уровни строения материи. (Лекция 5) Урок 51 Паралельне з’єднання провідників
Урок 51 Паралельне з’єднання провідників Электромагнитные колебания
Электромагнитные колебания