Содержание
- 2. Физические свойства макросистем, состоящих из большого количества частиц, изучаются взаимно дополняющими методами: статистическим и термодинамическим. Термодинамический
- 3. Внутренняя энергия термодинамической системы включает в себя кинетическую энергию движения частиц (поступательного и вращательного движения), а
- 4. В идеальном газе пренебрегают силами межмолекулярного взаимодействия, поэтому внутренняя энергия может быть принята как сумма кинетических
- 5. Таким образом внутренняя энергия идеального газа равна: где i – число степеней свободы молекулы. Одноатомный газ
- 6. Изменение внутренней энергии может осуществляться двумя качественно различными способами: путем совершения работы и путем теплообмена. Изменение
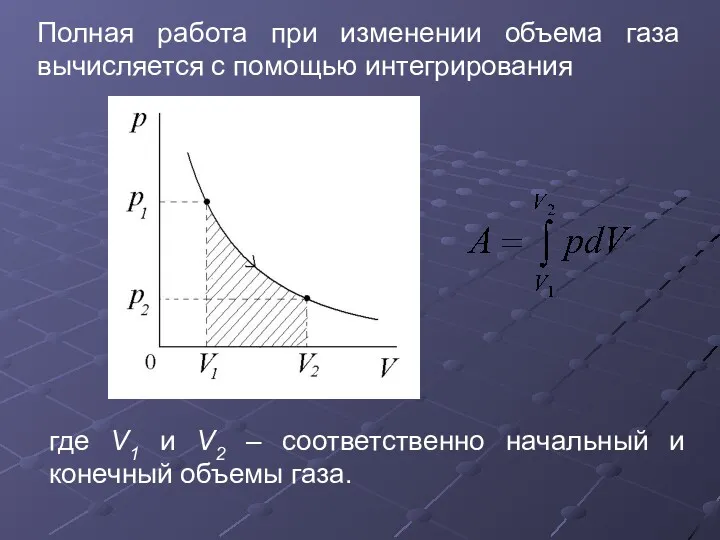
- 7. Элементарная работа, совершаемая газом при изменении его объема Полная работа при изменении объема газа вычисляется с
- 8. Полная работа при изменении объема газа вычисляется с помощью интегрирования где V1 и V2 – соответственно
- 9. Количество теплоты, переданное системе, определяется по формуле где с – удельная теплоемкость газа при данном процессе.
- 10. Первое начало термодинамики утверждает, что количество теплоты Q, сообщаемое системе, затрачивается на приращение внутренней энергии системы
- 11. Первое начало термодинамики в дифференциальной форме имеет вид Отличия в записи малых величин отражают тот факт,
- 12. В отличие от внутренней энергии системы, которая является однозначной функцией состояния этой системы, понятия теплоты и
- 13. Первый закон термодинамики запрещает существование вечного двигателя 1-го рода: периодически действующий двигатель, который совершал бы большую
- 14. 5. Применение первого начала термодинамики к изопроцессам. Зависимость теплоемкости идеального газа от вида процесса
- 15. Применим первое начало термодинамики к изопроцессам. Запишем закон в развернутом виде:
- 16. Так, при изохорном процессе dV=0, т.е. работа А=0 и вся теплота идет на изменение внутренней энергии
- 17. Откуда удельная теплоемкость газа при изохорном процессе: В других процессах объем газа изменяется.
- 18. При изобарном процессе работа газа: Изменение внутренней энергии
- 19. Количество теплоты Удельная теплоемкость газа при изобарном процессе
- 20. Молярные теплоемкости газа при постоянном объеме и постоянном давлении связаны между собой
- 21. Уравнение Майера связывает молярные теплоемкости газа при изохорном и изобарном процессах
- 22. При изотермическом процессе температура газа постоянна, поэтому количество теплоты идет на совершение работы Q=A. Работа вычисляется
- 23. 7. Адиабатный процесс. Политропный процесс.
- 24. Адиабатный процесс реализуется в условиях теплоизоляции системы, т.е. когда система не обменивается энергией в форме теплоты
- 25. Получим соотношение между параметрами состояния газа. Записывая выражения для работы и изменения внутренней энергии
- 27. Разделяем переменные
- 28. Интегрируя, получаем
- 29. Таким образом, связь температуры и объема газа при адиабатном процессе имеет вид
- 30. Поскольку при любом процессе для идеального газа Связь давления и объема при адиабатном процессе
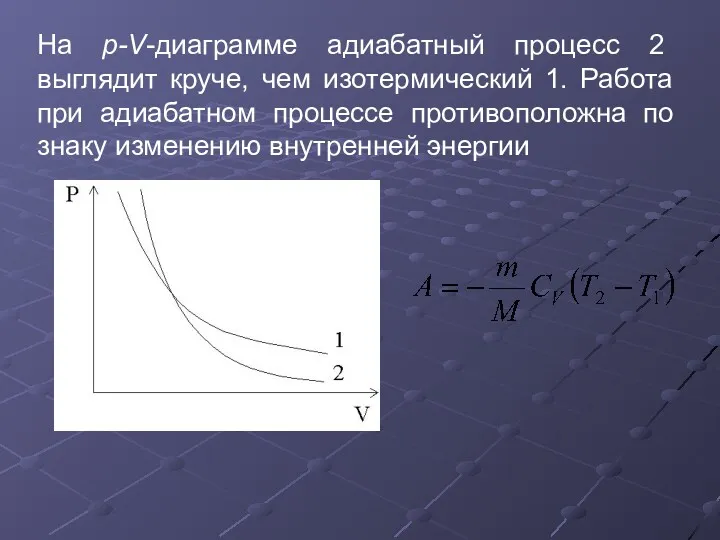
- 31. На p-V-диаграмме адиабатный процесс 2 выглядит круче, чем изотермический 1. Работа при адиабатном процессе противоположна по
- 32. Политропными называются процессы, при которых теплоемкость тела остается постоянной. Для идеального газа уравнение политропы имеет вид
- 33. 8. Обратимые и необратимые процессы. Круговой процесс (цикл). Цикл Карно.
- 34. Для описания термодинамических процессов одного первого начала термодинамики недостаточно, поскольку оно не позволяет определить направление протекания
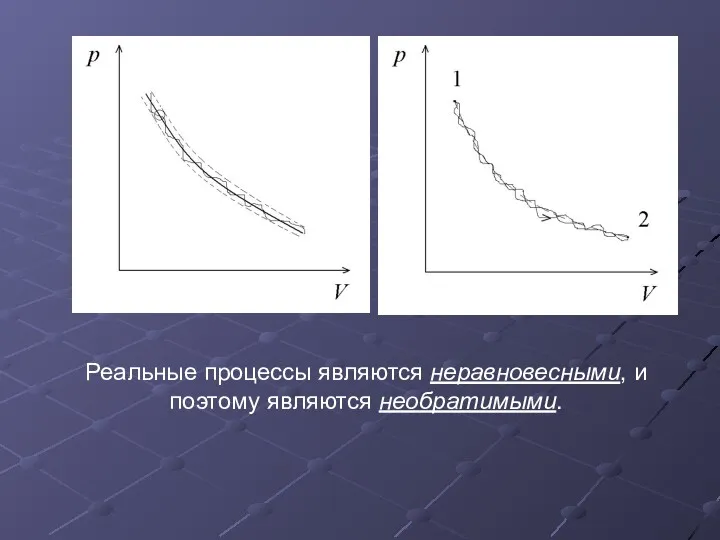
- 35. Термодинамический процесс называется обратимым, если после него можно возвратить систему в начальное состояние таким образом, чтобы
- 36. Реальные процессы являются неравновесными, и поэтому являются необратимыми.
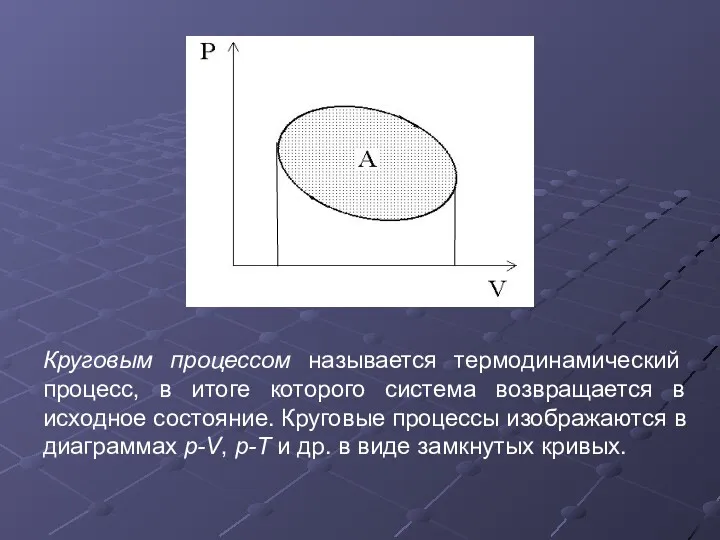
- 37. Круговым процессом называется термодинамический процесс, в итоге которого система возвращается в исходное состояние. Круговые процессы изображаются
- 38. Основные части тепловой машины: нагреватель, рабочее тело и холодильник. Рабочее тело (обычно газ) получает количество теплоты
- 39. Эффективность холодильной машины определяется холодильным коэффициентом
- 40. Среди всех круговых процессов наиболее эффективным является процесс, составленный из четырех обратимых процессов: двух изотерм и
- 41. Определим КПД данного цикла. Участок 1-2: изотерма с Т1 Участок 2-3: адиабата Участок 3-4: изотерма с
- 42. Температура и объем в состояниях 2-3 и 1-4 связаны:
- 43. где Т1 – температура нагревателя; Т2 – температура холодильника. КПД цикла Карно В обратимом цикле Карно
- 44. 9. Энтропия. Второе начало термодинамики. Вычисление энтропии идеального газа.
- 45. В отличие от количества теплоты δQ, величина δQ/T (приведенная теплота) в обратимом процессе сохраняется и является
- 46. Энтропия – функция состояния системы, изменение которой в обратимом процессе равно отношению бесконечно малого количества теплоты,
- 47. В произвольном необратимом процессе изменение энтропии системы т.е. изменение энтропии системы больше величины δQ/T , где
- 48. Тогда для любых процессов ,где знак равенства относится к обратимым процессам, а знак "больше" к необратимым.
- 49. Если система адиабатически изолирована (Q=0), то при любых процессах, происходящих в системе, энтропия системы не может
- 50. Изменение энтропии при равновесном переходе системы из состояния 1 в состояние 2 вычисляется через интеграл
- 51. Изменение энтропии при переходе из состояния с параметрами T0, V0, конечное – T, V: Энтропия, подобно
- 53. Скачать презентацию














































 Теория методов ГИС
Теория методов ГИС Теория цепей. Операторный метод анализа переходных процессов
Теория цепей. Операторный метод анализа переходных процессов Classical angular momentum and magnetic dipole moment
Classical angular momentum and magnetic dipole moment Конденсатор. Электрическое поле
Конденсатор. Электрическое поле Радиоактивные превращения атомных ядер
Радиоактивные превращения атомных ядер Эндодонтический инструментарий. Требования, маркировка. Особенности работы
Эндодонтический инструментарий. Требования, маркировка. Особенности работы Рентгенофлуоресцентный анализ (РФлА)
Рентгенофлуоресцентный анализ (РФлА) Материал и конструкция рабочих колес гидромашин
Материал и конструкция рабочих колес гидромашин Работа газа. Внутренняя энергия идеального одноатомного газа
Работа газа. Внутренняя энергия идеального одноатомного газа Гидродинамика. Поток жидкости и его основные понятия
Гидродинамика. Поток жидкости и его основные понятия Ядерные реакции
Ядерные реакции Токи короткого замыкания в СЭЭС
Токи короткого замыкания в СЭЭС Создание источника электричества из овощей и фруктов
Создание источника электричества из овощей и фруктов Фізичні параметри радіобіологічних процессів
Фізичні параметри радіобіологічних процессів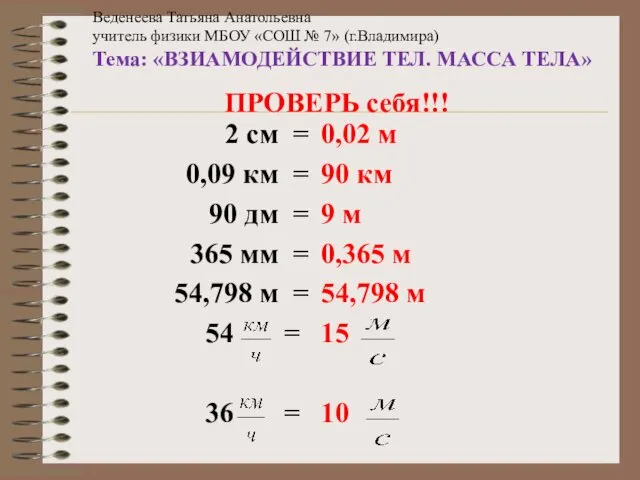 ВЗИАМОДЕЙСТВИЕ ТЕЛ. МАССА ТЕЛА
ВЗИАМОДЕЙСТВИЕ ТЕЛ. МАССА ТЕЛА Биологические мембраны. Биоэлектрогенез
Биологические мембраны. Биоэлектрогенез Диэлектрические потери и диэлектрическая спектроскопия
Диэлектрические потери и диэлектрическая спектроскопия Универсальные учебные действия на уроках физики
Универсальные учебные действия на уроках физики Окраска и сушка автомобилей, агрегатов и узлов
Окраска и сушка автомобилей, агрегатов и узлов Урок физики по теме Закон сохранения энергии 9 -10 класс
Урок физики по теме Закон сохранения энергии 9 -10 класс Оптическая спектроскопия твердотельных наноструктур
Оптическая спектроскопия твердотельных наноструктур Магнитное поле
Магнитное поле Тюнинг двигателя
Тюнинг двигателя 7 класс презентация Сила
7 класс презентация Сила Flexible pipelines
Flexible pipelines Лекция №20. Трансформирование трёхфазного тока и схемы соединения обмоток трёхфазных трансформаторов
Лекция №20. Трансформирование трёхфазного тока и схемы соединения обмоток трёхфазных трансформаторов Гидравлический пресс.
Гидравлический пресс. Магнитное поле в веществе. Лекция 18
Магнитное поле в веществе. Лекция 18