Слайд 2

Закон сохранения энергии
Энергия в природе не возникает из ничего и не
исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
Слайд 3
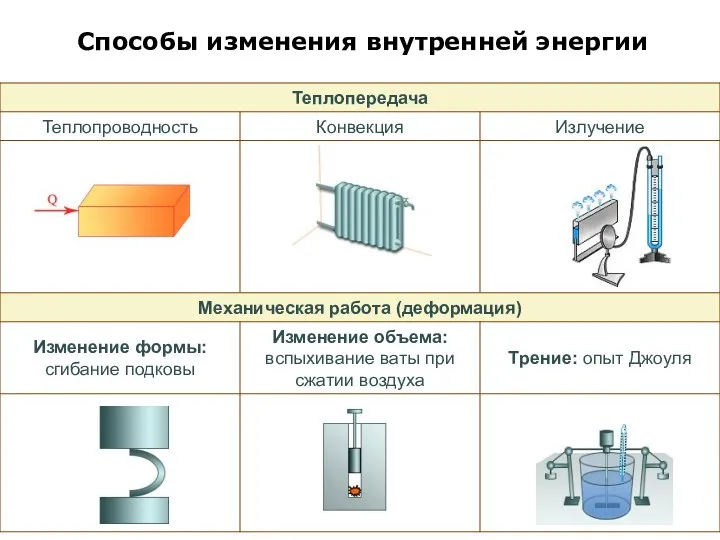
Способы изменения внутренней энергии
Слайд 4
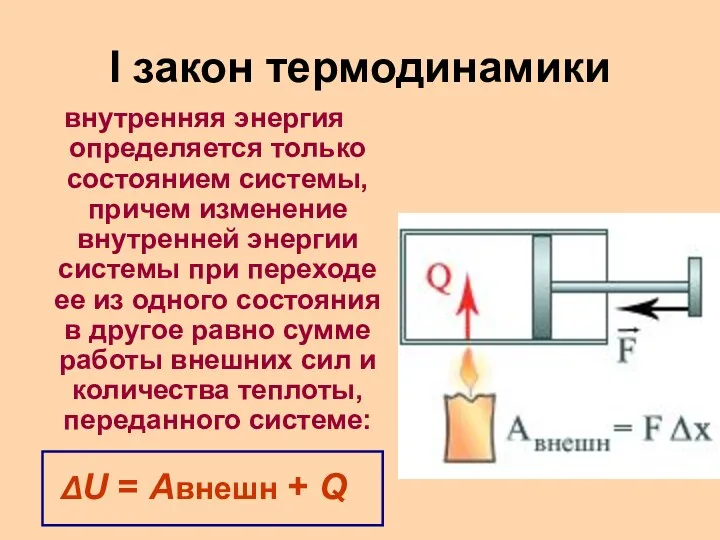
I закон термодинамики
внутренняя энергия определяется только состоянием системы, причем изменение внутренней
энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
ΔU = Aвнешн + Q
Слайд 5

Если при нагревании газ расширяется и при этом совершает работу A,
то первый закон термодинамики можно сформулировать по-другому:
Q = ΔU + AI
Количество теплоты, переданное газу, равно сумме изменения его внутренней энергии и работы, совершенной газом.
Так как работа газа и работа внешних сил вследствие 3-го закона Ньютона равны по модулю и имеют противоположный знак:
Aвнешн = –AI
Слайд 6
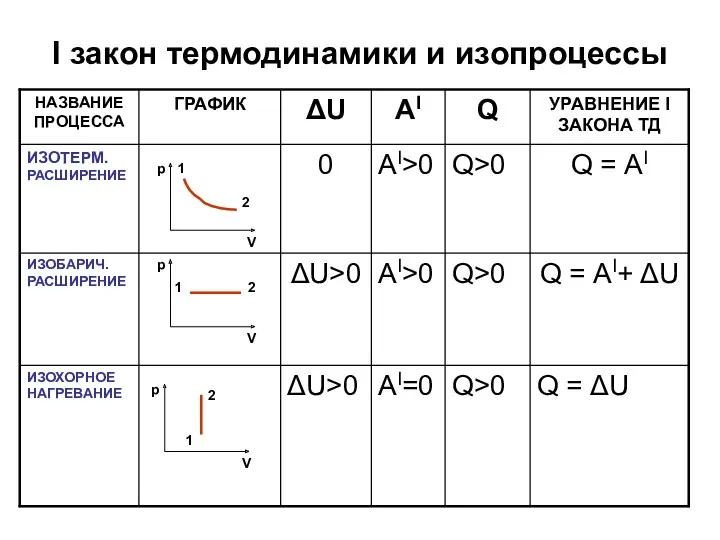
I закон термодинамики и изопроцессы
Слайд 7
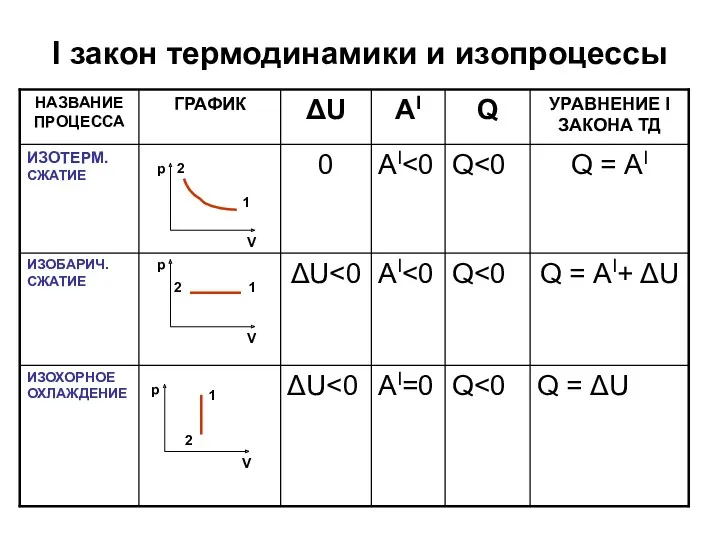
I закон термодинамики и изопроцессы
Слайд 8
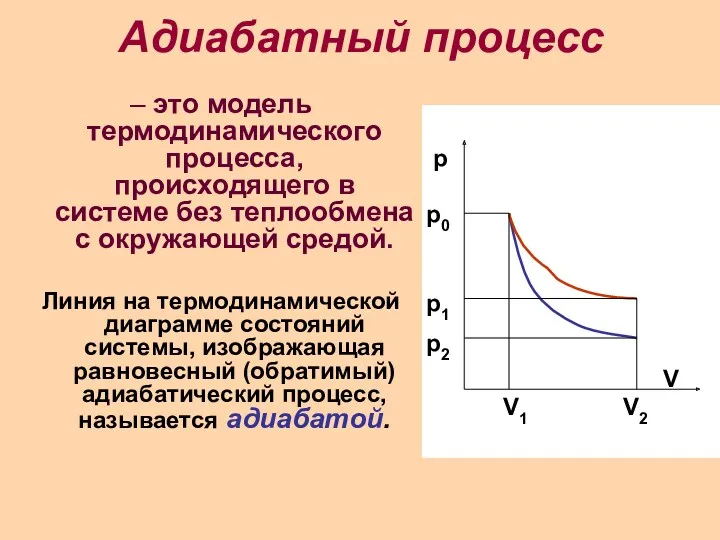
Адиабатный процесс
– это модель термодинамического процесса, происходящего в системе без теплообмена
с окружающей средой.
Линия на термодинамической диаграмме состояний системы, изображающая равновесный (обратимый) адиабатический процесс, называется адиабатой.







 Инженерно-авиационное обеспечение безопасности полётов
Инженерно-авиационное обеспечение безопасности полётов Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение)
Хроматографические методы анализа и их применение для контроля качества лекарственных средств (продолжение) Тормозная система КамАЗа
Тормозная система КамАЗа Тюнинг двигателя
Тюнинг двигателя Электромагнитная пушка – основа космической транспортной системы. 7 класс
Электромагнитная пушка – основа космической транспортной системы. 7 класс Презентация Проектное обучение
Презентация Проектное обучение ОГЭ - 2016. Физика.
ОГЭ - 2016. Физика. Основы расчета элементов стальных конструкций
Основы расчета элементов стальных конструкций Урок Механическая работа 7 класс
Урок Механическая работа 7 класс Коррозия металлов
Коррозия металлов Простые механизмы
Простые механизмы Основные неисправности и нормы ТОиР. Лекция 6
Основные неисправности и нормы ТОиР. Лекция 6 Біртекті емес электр өрісі кезіндегі разрядтың пайда болуы
Біртекті емес электр өрісі кезіндегі разрядтың пайда болуы Открытый урок по физике 7 класс. Сила давления
Открытый урок по физике 7 класс. Сила давления Полупроводники. Собственная проводимость полупроводников. Полупроводниковые приборы
Полупроводники. Собственная проводимость полупроводников. Полупроводниковые приборы Конвективный теплообмен. Глава 2
Конвективный теплообмен. Глава 2 Инструментальные методы качественного анализа органических веществ
Инструментальные методы качественного анализа органических веществ Инерция
Инерция Делимость электрического заряда. Электрон. Строение атома
Делимость электрического заряда. Электрон. Строение атома Тепловой расчет двигателя внутреннего сгорания
Тепловой расчет двигателя внутреннего сгорания Магнитное поле в вакууме
Магнитное поле в вакууме Интеллектуальная игра по физике Умники и умницы
Интеллектуальная игра по физике Умники и умницы Индикаторные и эффективные показатели ДВС. Тема 8
Индикаторные и эффективные показатели ДВС. Тема 8 Применение аккумуляторов
Применение аккумуляторов Водяной пар
Водяной пар Технологии выращивания кристаллов. Технология полупроводниковых материалов
Технологии выращивания кристаллов. Технология полупроводниковых материалов Возникновение радио
Возникновение радио