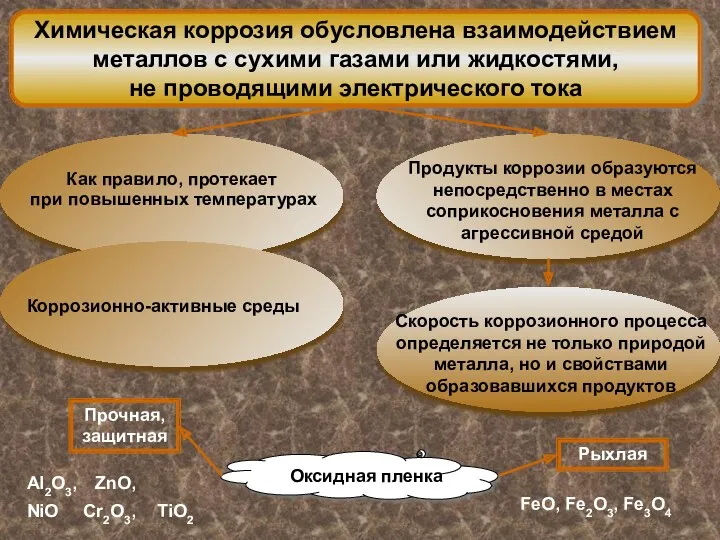
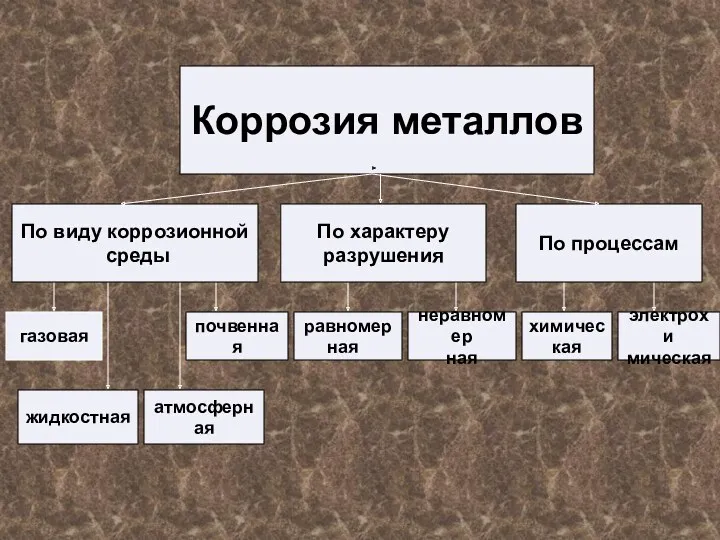
Коррозия металлов
СПЛОШНАЯ
МЕСТНАЯ
не представляет особой опасности для конструкций и аппаратов особенно в
тех случаях, когда потери металлов не превышают технически обоснованных норм. Ее последствия могут быть сравнительно легко учтены.
потери металла небольшие. Наиболее опасна – точечная коррозия(образование сквозных поражений, точечных полостей – так называемых питтингов. Местной коррозии благоприятствуют морская вода, растворы солей, в частности галогенидных (хлорид натрия, магния и др.). Опасность местной коррозии состоит в том, что, снижая прочность отдельных участков, она резко уменьшает надежность конструкций, сооружений, аппаратов.










 Кремний. Строение полупроводников
Кремний. Строение полупроводников Отличительные особенности конструкции базовой машины КУР 31
Отличительные особенности конструкции базовой машины КУР 31 Расчет шпоночных соединений
Расчет шпоночных соединений Презентация Манометры
Презентация Манометры Мектептегі механиканы оқыту үдерісіндегі тапсырмалардың рөлі
Мектептегі механиканы оқыту үдерісіндегі тапсырмалардың рөлі Гибридные двигатели
Гибридные двигатели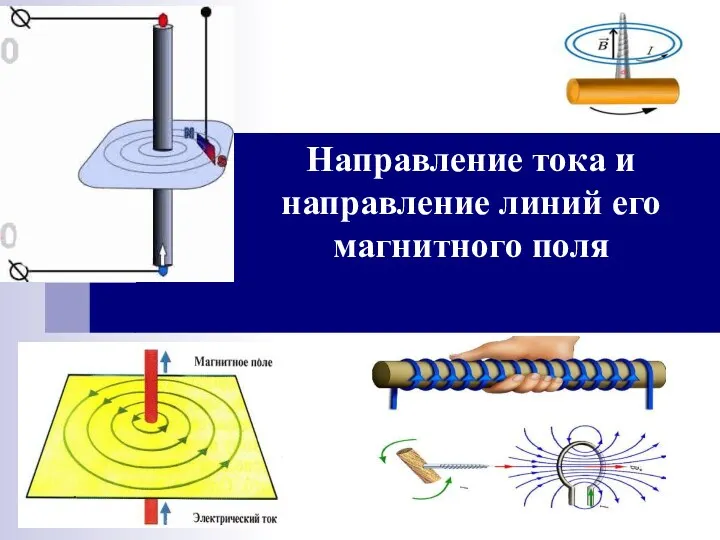 Направление тока и направление линий его магнитного поля
Направление тока и направление линий его магнитного поля Давление. Сила давления
Давление. Сила давления Разработка урока на тему : Плотность вещества
Разработка урока на тему : Плотность вещества Твердотельный лазер на основе кристалла Nd:YAG
Твердотельный лазер на основе кристалла Nd:YAG Inverzná kinematika – aprox. metóda
Inverzná kinematika – aprox. metóda История полетов в космос
История полетов в космос Технология машиностроения
Технология машиностроения Закон сохранения энергии
Закон сохранения энергии Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Эмальдар, Компаундтар. Клуазоне эмаль-бірегей зергерлік
Эмальдар, Компаундтар. Клуазоне эмаль-бірегей зергерлік Машины постоянного тока. Устройство, материалы и принцип действия. Карточка 16
Машины постоянного тока. Устройство, материалы и принцип действия. Карточка 16 Давление света
Давление света Оценка последствий взрыва
Оценка последствий взрыва Электрические явления презентация к открытому уроку 8 класс
Электрические явления презентация к открытому уроку 8 класс Диэлектрические потери
Диэлектрические потери Олимпиадная физика
Олимпиадная физика Термоэлектрические явления и их применение
Термоэлектрические явления и их применение Архимедова сила. Подготовка к ГИА
Архимедова сила. Подготовка к ГИА Бинарный урок. Энергосбережение. Пути решения проблемы
Бинарный урок. Энергосбережение. Пути решения проблемы Элементы специальной теории относительности. Релятивистская динамика
Элементы специальной теории относительности. Релятивистская динамика Положительные лучи. Определение истинных масс атомов. Изотопы. АФ1.5
Положительные лучи. Определение истинных масс атомов. Изотопы. АФ1.5 Механическая энергия. Урок №1-2
Механическая энергия. Урок №1-2