Содержание
- 2. Цели урока: 1. Обучающая: изучение физической модели атомов; 2. Воспитательная: формирование положительного отношения к знаниям; воспитание
- 3. Род около 470-460лет до н. э.; умер в глубокой старости) из Абдер (Фракия), древнегреческий философ, один
- 4. Томсон (Thomson) Джозеф Джон (18.XII.1856–30.VIII.1940) Английский физик, член Лондонского королевского общества (с 1884, в 1915–20 –
- 5. Д.Д. Томсон 1856 — 1940 гг ЭЛЕКТРОН ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННОЕ ОБЛАКО «ПУДИНГ С ИЗЮМОМ» + + +
- 6. ЦЕЛЬ ОПЫТА: проверить, является ли правильной модель Томсона. Э. РЕЗЕРФОРД 1871 — 1937 гг 1910 —
- 7. Рассеяние α-частицы в атоме Томсона и в атоме Резерфорда α Атом Резерфорда ат м омсона α
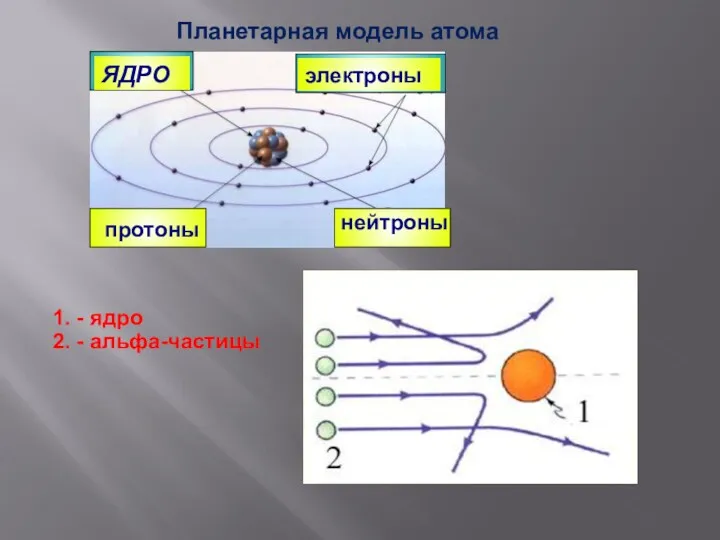
- 8. ЯДРО электроны протоны нейтроны Планетарная модель атома 1. - ядро 2. - альфа-частицы
- 9. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА ПРОТИВОРЕЧИЛА ЗАКОНАМ КЛАССИЧЕСКОЙ ЭЛЕКТРОДИНАМИКИ — электрон должен был непрерывно излучать электромагнитные волны. ТАКОЙ
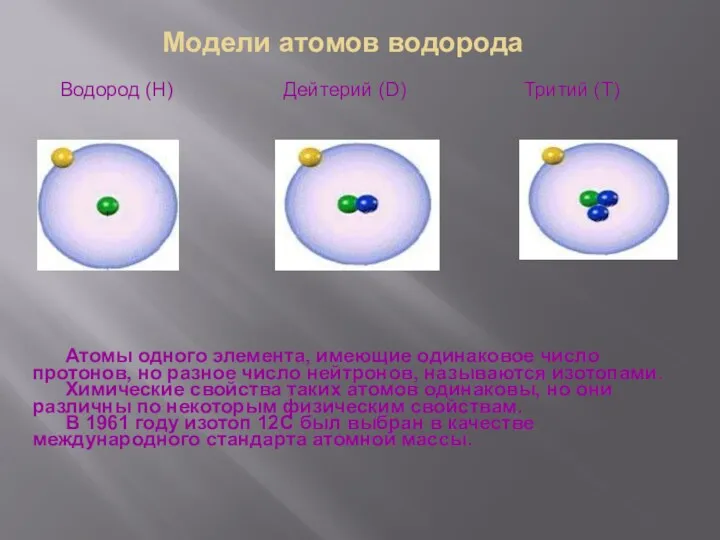
- 10. Модели атомов водорода Водород (H) Дейтерий (D) Тритий (T) Атомы одного элемента, имеющие одинаковое число протонов,
- 11. I ПОСТУЛАТ БОРА Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых
- 12. II ПОСТУЛАТ БОРА При переходе атома из стационарного состояния с большей энергией En в стационарное состояние
- 13. Недостатки теории Бора 1. Не смогла объяснить интенсивность спектральных линий. 2. Справедлива только для водородоподобных атомов
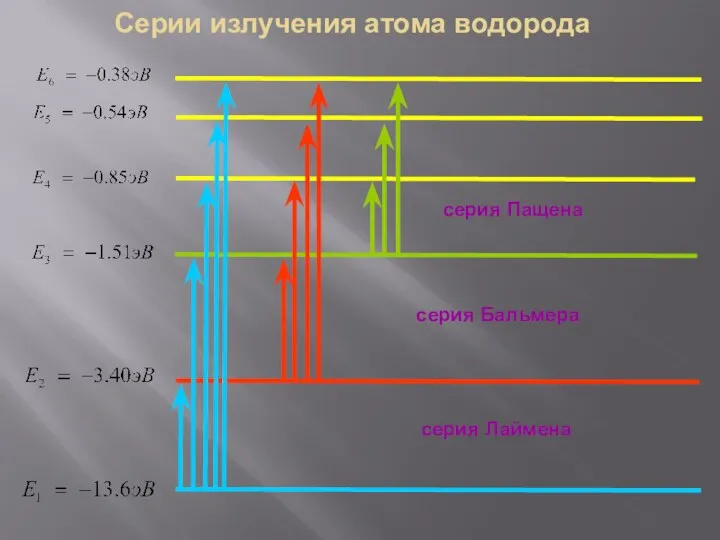
- 14. Серии излучения атома водорода серия Пащена серия Лаймена серия Бальмера
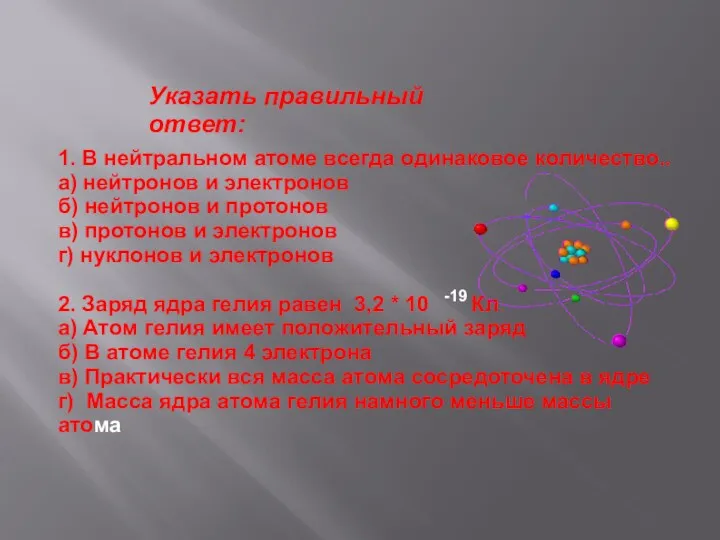
- 15. Указать правильный ответ: 1. В нейтральном атоме всегда одинаковое количество.. а) нейтронов и электронов б) нейтронов
- 16. 3. В чем заключается противоречие между планетарной моделью атома по Резерфорду и законами классической физики? 4.
- 18. Скачать презентацию











 Магнит өрісі
Магнит өрісі Электризация тел
Электризация тел Проблемное обучение на уроках физики
Проблемное обучение на уроках физики Эндодонтический инструментарий. Требования, маркировка. Особенности работы
Эндодонтический инструментарий. Требования, маркировка. Особенности работы Терминалы
Терминалы Расчет нелинейных цепей графическим методом
Расчет нелинейных цепей графическим методом Физические основы механики
Физические основы механики Нелинейные элементы электрических цепей постоянного тока. Лекция 13, 1 часть
Нелинейные элементы электрических цепей постоянного тока. Лекция 13, 1 часть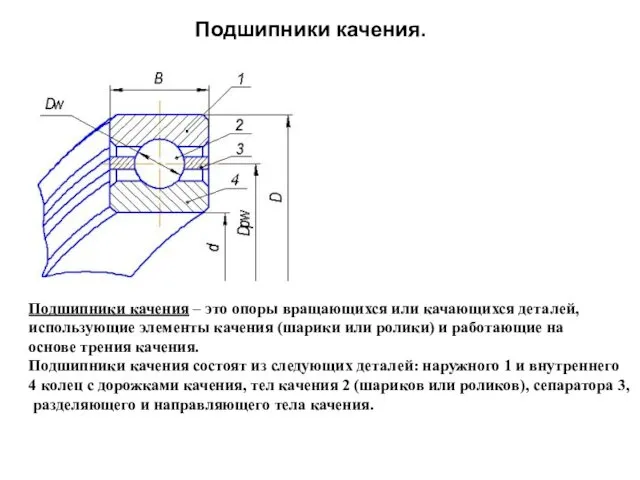 Подшипники качения
Подшипники качения Тасымалдаушы машиналар
Тасымалдаушы машиналар
 Энергия связи. Ядерные силы. Дефект масс
Энергия связи. Ядерные силы. Дефект масс Основные разделы. Законы взаимодействия и движения тел
Основные разделы. Законы взаимодействия и движения тел Электрическое поле. Напряженность и потенциал электрического поля
Электрическое поле. Напряженность и потенциал электрического поля Закон Кулона – основной закон электростатики
Закон Кулона – основной закон электростатики Автоколебания. Генератор незатухающих электромагнитных колебаний
Автоколебания. Генератор незатухающих электромагнитных колебаний Смесеобразования в дизелях
Смесеобразования в дизелях Определение зависимости силы трения скольжения от веса тела
Определение зависимости силы трения скольжения от веса тела Механические свойства металлов
Механические свойства металлов Структура и взаимодействие адронов
Структура и взаимодействие адронов Система питания двигателя от впрыска топлива
Система питания двигателя от впрыска топлива Мастер-класс по теме Использование системно-деятельностного подхода для повышения качества на уроках физики
Мастер-класс по теме Использование системно-деятельностного подхода для повышения качества на уроках физики Квантовые явления в оптике
Квантовые явления в оптике Становление и развитие паротурбинных установок. (Тема 4)
Становление и развитие паротурбинных установок. (Тема 4) Bonds and Molecules
Bonds and Molecules Оптика. Закон отражения света
Оптика. Закон отражения света Вакуумдағы электр тогы жөніндегі оқу материалын тө мендегідей жүйелілікпен оқытқан қолайлы болар деп санаймыз
Вакуумдағы электр тогы жөніндегі оқу материалын тө мендегідей жүйелілікпен оқытқан қолайлы болар деп санаймыз Экспериментальные и теоретические основы квантовой теории
Экспериментальные и теоретические основы квантовой теории