Содержание
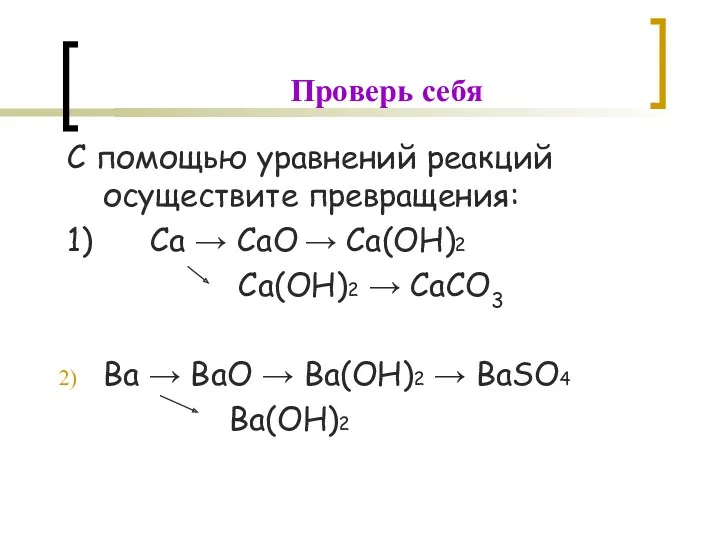
- 2. С помощью уравнений реакций осуществите превращения: 1) Сa → СaO → Сa(OН)2 Сa(OH)2 → СaCO3 Ва
- 5. Тест 1 Оксиду кальция соответствует формула 1. МеО 2. Ме2О3 3. Ме2О 4. МеО2
- 6. Тест 2 Оксид бария по свойствам относится к Основным оксидам Кислотным оксидам Амфотерным оксидам Несолеобразующим оксидам
- 7. Тест 3 Формула нитрида кальция 1. CaN 2. Ca3N 3. Ca2N3 4. Ca3N2
- 8. Тест 4 Формула каустической соды: 1. K2CO3 2. Na2CO3 3. NaOH 4. NaHCO3
- 9. Тест 5 Металлический барий можно получить 1. BaCl2 + Mg = 2. BaCl2 тв 3. BaO
- 10. Соединения щелочноземельных металлов
- 11. Оксиды II А группы Получение Окисление металлов 2Ca + O2→2CaO Нужно помнить!!! Be + H2O →
- 12. Теория 1. Известно, что металлам соответствует основные оксиды. Докажите, что оксид кальция – основной оксид, составив
- 13. Гидроксиды II А группы Получение 1) Реакции щелочноземельных металлов с водой: Ba + 2H2O → Ba(OH)2
- 14. Теория 2. Известно, что металлу соответствует основной оксид и основание. Докажите, что гидроксид кальция – основание.
- 15. Способ получения щелочных и щелочноземельных металлов - Электрометаллургический - Составьте уравнения электролиза расплавов природных соединений калия
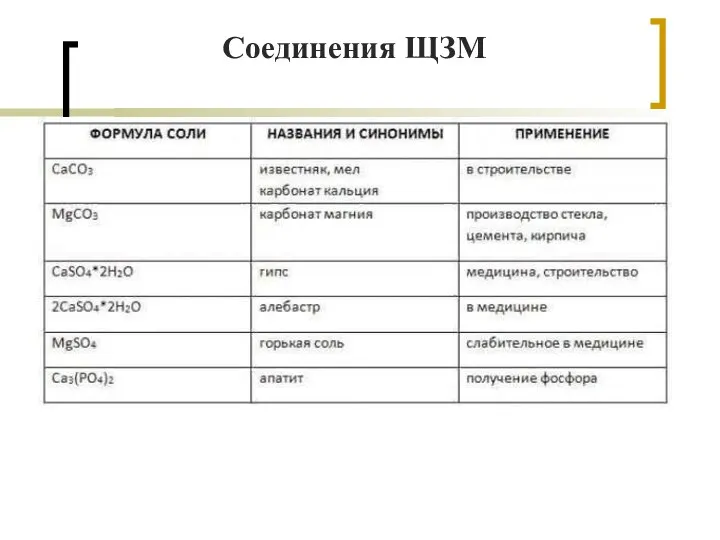
- 16. Соединения ЩЗМ
- 17. Природные соединения щелочноземельных металлов 1. CaCO3 – мел, мрамор, известняк;
- 18. 2. CaSO4 ∙ 2H2O – природный гипс, кристаллогидрат сульфата кальция;
- 19. 3. MgSO4 - горькая английская соль;
- 20. Влияние кальция и магния на организм человека (стр 66). 4. Ca3(PO4)2
- 21. Технические соединения щелочноземельных металлов 1. CaO - негашеная, жженная известь CaCO3 = CaO + СО2↑
- 22. 2. MgO – жженная магнезия MgCO3 = MgO + CO2↑
- 23. 4. CaSO4 ∙ 0,5H2O или 2CaSO4 ∙ H20 - алебастр
- 24. 3. Ca(OH)2 - гашеная известь Раствор Ca(OH)2 - известковая вода Взвесь Ca(OH)2 –известковое молоко
- 25. Жесткость воды Природная вода, содержащая ионы Ca2+ и Mg2+, называется жесткой. Жесткая вода при кипячении образует
- 27. Скачать презентацию






















 История создания ядерного оружия
История создания ядерного оружия Радиоактивность
Радиоактивность Атмосферний тиск. Вимірювання атмосферного тиску. Барометри
Атмосферний тиск. Вимірювання атмосферного тиску. Барометри Презентация Недостаточно только получить знания: надо найти им приложение. И. Гете
Презентация Недостаточно только получить знания: надо найти им приложение. И. Гете Синтез зубчатых передач
Синтез зубчатых передач Модели атомов. Атом водорода по теории Бора
Модели атомов. Атом водорода по теории Бора Викторина по физике
Викторина по физике Разработка моделей и исследование напряженного состояния дискретноармированного стеклопластика на основе термопластичной матрицы
Разработка моделей и исследование напряженного состояния дискретноармированного стеклопластика на основе термопластичной матрицы Экологические проблемы работы АЭС
Экологические проблемы работы АЭС Разъемные и неразъемные соединения
Разъемные и неразъемные соединения Все что надо знать об ОГЭ по физике
Все что надо знать об ОГЭ по физике Тест по физике 8 класса по теме Внутренняя энергия. Количество теплоты
Тест по физике 8 класса по теме Внутренняя энергия. Количество теплоты Панели смыва и система инсталляции
Панели смыва и система инсталляции Капиллярлық құбылыстар
Капиллярлық құбылыстар Основы технического обслуживания и ремонта. (Занятие 1)
Основы технического обслуживания и ремонта. (Занятие 1) Цепные передачи
Цепные передачи Преломление света
Преломление света Силы в механике
Силы в механике Строительная механика пластин. Изгиб пластин
Строительная механика пластин. Изгиб пластин Открытие нейтрона
Открытие нейтрона Атомная и ядерная физика. Лекция 1
Атомная и ядерная физика. Лекция 1 Оптическое волокно
Оптическое волокно Скорость при равномерном движении
Скорость при равномерном движении Общие сведения об интерференции света
Общие сведения об интерференции света Магнитное поле
Магнитное поле Загадки непростые, а с подсказками
Загадки непростые, а с подсказками Renewable and Nonrenewable Energy
Renewable and Nonrenewable Energy Электрооборудование автомобилей. Электроприводные устройства. (Урок 11)
Электрооборудование автомобилей. Электроприводные устройства. (Урок 11)