Слайд 2
Гидроэлектрометаллургия
Гидроэлектрометаллургия – получение чистых металлов; получение металлов с помощи электролиза заправленных ред; электролиз
вредных растворов без выделенных металлов производства водорода, перекиси водорода, щелочей и некоторых органических соединений

Слайд 3
Гальванотехника
Гальванотехника – получение покрытий с целью защиты металлов от коррозии и предание металлов
функциональных свойств твердоты износостойкости электропроводности.

Слайд 4
Электролиз
Электролиз – это совокупность окислительно-восстановительных процессов, протекающих при прохождении электрического тока через
электролит с погружёнными в него электродами
Электролиз возможен только для растворов и расплавов электролитов, когда в системе присутствуют ионы
Суммарный процесс противоположен по направлению процессу, протекающему в гальваническом элементе
Анодом является (+) электрод, на нём протекает реакция окисления
Катодом является (-) электрод, на нём протекает реакция восстановления
Потенциал (напряжение)разложения – минимальное значение внешней разности потенциалов, при которой начинается электролиз данного соединения (для каждого вещества это const)
Для увеличения скорости электролиза к электродам прикладывают разность потенциалов, превышающую напряжение разложение
Тип электродного процесса зависит от состава электролита, материала электродов температуры, напряжения, плотности тока и др.

Слайд 5

Слайд 6
Электролиз расплавов электролитов
Протекает наиболее просто
В расплавах электролитов существует по одному виду катионов и
анионов, которые разряжаются на электродах
Катионы движутся к катоду (-) и принимают от него электроны – восстанавливаются
Анионы движутся к аноду (+) и отдают
ему электроны – окисляются
Примеры: электролиз расплавов хлоридов
металлов, щелочей и др.

Слайд 7
Электролиз растворов электролитов
Появляется ещё одно вещество – вода
В электродных реакциях наряду с ионами
растворённой соли участвуют молекулы воды, катионы водорода и гидроксид-ионы
Из электродных процессов наиболее вероятен тот, осуществление которого связано с минимальной затратой энергии
На катоде первым восстанавливается
наиболее сильный окислитель
На аноде первым окисляется наиболее
сильный восстановитель

Слайд 8
Возможные катодные процессы

Слайд 9
Возможные анодные процессы

Слайд 10
Практическое применение электролиза
Электролизом раствора NaCl получают гидроксид натрия, хлор и водород
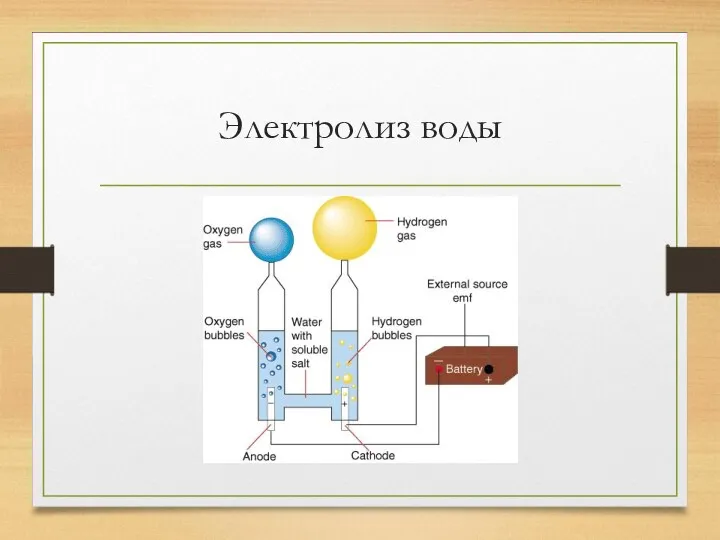
Электролизом воды получают
кислород и водород высокой чистоты
Получают многие сильные окислители: гипохлорит натрия NaClO, хлорат натрия NaClO₃, хлорную кислоту HClO₄ и её соли, пероксид водорода H₂O₂, перманганат калия KMnO₄, дихромат калия K₂Cr₂O₇ и др.
В металлургии получают металлы (золото, серебро, медь, никель, алюминий и др.)
Электролиз с растворимым анодом используют при электролитическом рафинировании (очистке) черновых металлов (меди, серебра, олова и др.); металл, подвергаемый очистке, является анодом
Гальванопластика – получение изделий путём осаждения металла на модели
Гальваностегия – нанесение металлических покрытий путём электролиза

Слайд 11
Слайд 12
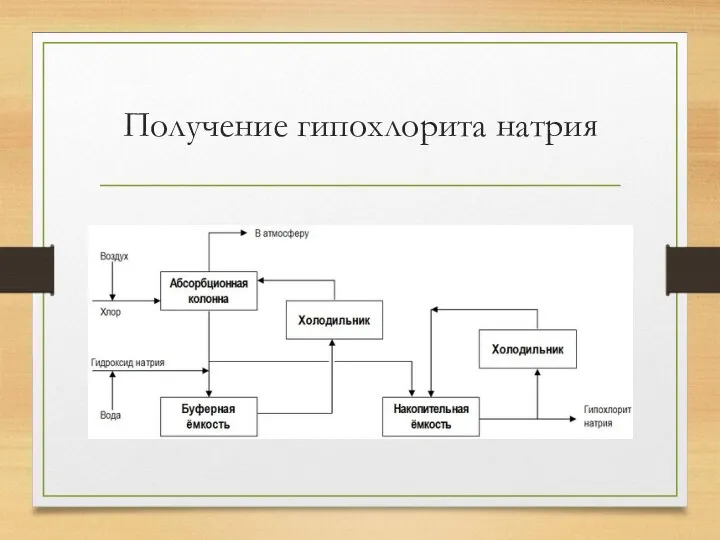
Получение гипохлорита натрия
Слайд 13
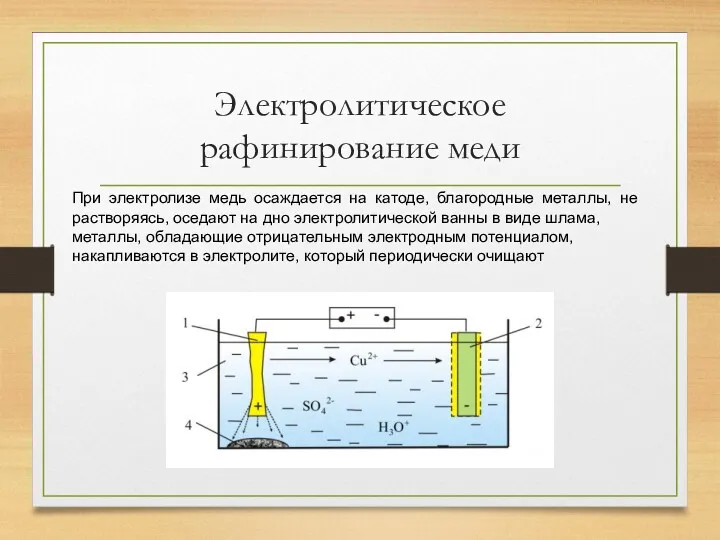
Электролитическое рафинирование меди
При электролизе медь осаждается на катоде, благородные металлы, не растворяясь, оседают
на дно электролитической ванны в виде шлама,
металлы, обладающие отрицательным электродным потенциалом, накапливаются в электролите, который периодически очищают
Слайд 14














 Электротехника. Классический метод анализа переходных процессов. (Лекция 12)
Электротехника. Классический метод анализа переходных процессов. (Лекция 12) Твердые тела и их свойства
Твердые тела и их свойства Кто открыл электричество? Исследования и открытия
Кто открыл электричество? Исследования и открытия Лампа накаливания. История создания. Современная конструкция
Лампа накаливания. История создания. Современная конструкция Расчет количества теплоты
Расчет количества теплоты SCR - Система каталитического восстановления выхлопных газов на двигателях Weichai Euro 4 & 5
SCR - Система каталитического восстановления выхлопных газов на двигателях Weichai Euro 4 & 5 Плазма и её свойства
Плазма и её свойства Масс-спектрометрия
Масс-спектрометрия Магнитное поле. Взаимодействие токов
Магнитное поле. Взаимодействие токов презентация к уроку на тему: Основные положения МКТ
презентация к уроку на тему: Основные положения МКТ Выпрямительные диоды
Выпрямительные диоды Тюнинг подвески
Тюнинг подвески e202dc03076113ae32ac6b39fa8609a1(1)
e202dc03076113ae32ac6b39fa8609a1(1) Презентация к уроку по теме Кристаллы (10класс).
Презентация к уроку по теме Кристаллы (10класс). Количество теплоты. Уравнение теплового баланса
Количество теплоты. Уравнение теплового баланса Ходовая часть
Ходовая часть К чему приводит действие одного тела на другое. Силы. Всемирное тяготение
К чему приводит действие одного тела на другое. Силы. Всемирное тяготение Brakes. Brake System Components
Brakes. Brake System Components Закон Дарси. Вывод формулы Дюпюи
Закон Дарси. Вывод формулы Дюпюи Курс лекций по теоретической механике
Курс лекций по теоретической механике Действие жидкости и газа на погруженное в них тело. Физика, 7 класс
Действие жидкости и газа на погруженное в них тело. Физика, 7 класс Квантові генератори
Квантові генератори Давление. Способы уменьшения и увеличения давления
Давление. Способы уменьшения и увеличения давления Объемные ионизационные эффекты в ПП и ИС (ИЭТ) при воздействии импульсного ИИ
Объемные ионизационные эффекты в ПП и ИС (ИЭТ) при воздействии импульсного ИИ Жерсерік байланысын ұйымдастыру қағидасын түсіндіру
Жерсерік байланысын ұйымдастыру қағидасын түсіндіру Перспективные материалы и технологии. Экскурсия в наномир
Перспективные материалы и технологии. Экскурсия в наномир Презентация Мощность
Презентация Мощность Уплотнения опор
Уплотнения опор